环境胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
2017-07-18班艳丽李培培
魏 杰, 班艳丽, 王 媛, 赵 文, 谢 玺, 李培培
(1. 大连海洋大学 辽宁省水生生物学重点实验室, 大连 116023; 2. 辽宁省海洋水产科学研究院, 大连 116023)
环境胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
魏 杰1, 班艳丽1, 王 媛1, 赵 文1, 谢 玺2, 李培培1
(1. 大连海洋大学 辽宁省水生生物学重点实验室, 大连 116023; 2. 辽宁省海洋水产科学研究院, 大连 116023)
采用实验生态学方法,研究了高盐(20和25)和高温(20℃和25℃)胁迫对西藏拟溞幼溞和成溞的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量的变化。结果发现:1)在高盐胁迫下,幼溞的SOD、CAT活性增强,MDA含量降低;成溞的SOD活性变化不明显,CAT活性和MDA含量均降低。2)在高温胁迫下,幼溞的SOD、CAT活性显著增强,MDA含量也显著增加;成溞的SOD、CAT活性增强,MDA含量则降低。研究表明幼溞对高盐胁迫的应激能力较强,而对高温胁迫的应激能力较弱,成溞则相反。
环境胁迫;西藏拟溞;超氧化物歧化酶;过氧化氢酶;丙二醛
西藏拟溞(DaphniopsistibetanaSars,1903)是我国唯一有文献记录的拟溞属枝角类[1],主要分布于西藏、新疆、青海等盐水水体,水温-2℃~18℃、pH 9.0~10.4、盐度2~35,水体多为碳酸盐型。在枝角类生物学研究中有其独特的地位[2-7]。国内外学者对开发盐水枝角类作为海洋经济动物新的活饵料进行了一系列研究,其中蒙古裸腹溞(MoinamongolicaDaday)在海水中大量培养和投喂试验取得了较好效果[8],但该溞属喜暖种类,在我国北方低水温期培养有其局限性。西藏拟溞喜低温和耐高盐,在我国西北盐湖中多为优势种群,且密度和生物量相当可观,经引种驯化后,可作为北方海水鱼虾早期苗种培育阶段的一种活饵料[9]。
目前,国内外在西藏拟溞的形态构造、自然分布、进化与分类等方面已有相关报道[1-2, 10-12],本实验室于2001年对该溞进行海水驯化,进一步研究了其营养成分[13]、遗传多样性[14]以及环境因子对其种群增长和生理代谢等方面的影响[15-19],获得了该种枝角类生物学参数的第一手材料[20],为其规模化培养技术的研发[21]与优化奠定了基础。环境胁迫可造成体内抗氧化酶系统紊乱,活性氧自由基大量积累,从而损害机体细胞和组织正常的生理机能和免疫防御能力,酶活性可作为衡量水生生物对环境适应能力、健康以及营养状况的一个重要指标[22]。实验室前期工作表明,水体温度和盐度胁迫对西藏拟溞的成溞抗氧化酶系统具有一定影响[23]。然而生物体不同发育阶段对环境胁迫所产生的适应能力不同[24-25],为了进一步比较西藏拟溞幼溞和成溞对环境胁迫的应激能力,本文研究了高盐(20和25)和高温(20℃和25℃)胁迫对西藏拟溞幼溞和成溞的SOD、CAT活性和MDA含量的影响,旨在为西藏拟溞室内驯化及规模化培养条件提供科学依据。
1 材料与方法
1.1 试验用溞
试验所用的西藏拟溞于2007年6月采自藏北纳木卡错,于盐度16的稀释海水中驯化培养,将饵料藻蛋白核小球藻(Chlorellapyrenoidesa)、牟氏角毛藻(Chaetocerosmuelleri)、盐生杜氏藻(Dunaliellasalina)和湛江等鞭金藻(Isochrysiszhanjiangensis)混合作为食物。试验前挑选若干同步性良好、体格健壮的母溞,在盐度16、水温为16℃的稀释海水中培养,孤雌生殖后将幼溞吸出,继续培养幼溞,如此反复,获得生长相对同步的幼溞和成溞。
1.2 试验条件
试验用海水取自大连市黑石礁近海,盐度31,pH 8.2,经沉淀、砂滤、300目筛绢网过滤、煮沸消毒,用曝气的自来水调至试验所需的盐度,现用现配。温度用恒温光照培养箱(美国Themo,型号:3744)控制,光周期L∶D =12 h∶12 h,光照强度为1000 lx。饵料配置的体积比为2(湛江等鞭金藻)∶1(牟氏角毛藻)∶1(蛋白核小球藻)∶1(盐生杜氏藻),用曝气的自来水稀释混合饵料,至试验所需盐度后进行投喂,饵料密度为8.5~9.5×106cell/mL。
1.3 试验设计
采用群体急性试验,试验分为胁迫组和对照组,盐度胁迫组为20和25,对照组盐度为16,试验温度为16℃;温度胁迫组为20℃和25℃,对照组温度为16℃,试验盐度为16。胁迫组和对照组每组均设置3个重复。试验均使用250 mL烧杯,每个烧杯装入培养液200 mL,放入幼溞40只或成溞20只,幼溞体长为(0.90±0.05)mm,成溞体长为(1.80±0.05)mm。试验过程中不投饵。经24 h胁迫后,将幼溞或成溞从试验液中挑出,吸干体表水分,放入离心管中,经超微量电子天平(德国Sartorius,型号:MSA2.7S-000-DM)称得体质量(精确至0.000 1 g)。
1.4 粗酶液制备和酶活测定
将装有溞体的离心管中加入预冷的匀浆介质(4℃,pH 7.36,0.01 mol/L PBS),于冰浴条件下超声波破碎(400 A,5 s每次,间隔10 s反复3~5次),再经4℃、10 000 r/min离心10 min(德国Hermle,型号:Z36HK),取上清液保存于-80℃备用。采用南京建成生物研究所生产的试剂盒测定SOD、CAT活性和MDA、蛋白质含量,操作步骤按试剂盒说明进行,均使用全波长酶标仪(美国Thermo,型号:Multiskan GO 51119200)测定。
1)SOD活性的测定。采用黄嘌呤氧化酶法测定,SOD活性定义:每毫升反应液中SOD抑制率达50.0%时所对应的SOD量为一个SOD活力单位(U)。
2)CAT活性的测定。采用可见光法测定,CAT活性定义:每毫升反应液每秒钟分解1 μmol的H2O2的量为一个活力单位(U)。
3)MDA含量的测定。采用硫代巴比妥酸法测定,过氧化脂质降解产物中丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm处有最大吸收峰,从而计算MDA含量。
4)可溶性蛋白含量的测定。采用考马斯亮蓝法测定蛋白质含量。
1.5 统计分析
2 结果
2.1 高盐胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
高盐胁迫下西藏拟溞SOD的活性见图1。幼溞在高盐(20和25)胁迫下SOD活性分别为(14.61±1.29)U/mg·μg和(19.36±0.65)U/mg·μg,均高于对照组(12.08±1.33)U/mg·μg,且在盐度为25时与对照组差异显著(P<0.05);成溞在高盐胁迫下SOD活性变化不明显,与对照组差异不显著(P>0.05)。

图1高盐胁迫下西藏拟溞SOD的活性
高盐胁迫下西藏拟溞CAT的活性如图2所示。幼溞在高盐(20和25)胁迫下CAT活性分别为(8.76±0.49)U/mg·μg和(6.57±0.25)U/mg·μg,均高于对照组(5.06±0.47)U/mg·μg,且在盐度为20时与对照组差异显著(P<0.05);成溞在高盐胁迫下CAT活性均低于对照组,但与对照组差异不显著(P>0.05)。

图2高盐胁迫下西藏拟溞CAT的活性Fig 2 The activity of CAT in D. tibetana Sars under high salinity stress
高盐胁迫下西藏拟溞MDA的含量见图3。幼溞在高盐(20和25)胁迫下MDA含量分别为(1.90±0.14)nmol/mg·μg和(2.42±0.15)nmol/mg·μg,明显低于对照组(3.11±0.29)nmol/mg·μg,且在盐度20时与对照组差异显著(P<0.05);成溞在高盐(20和25)胁迫下MDA含量分别为(1.18±0.15)nmol/mg·μg和(1.76±0.16)nmol/mg·μg,均低于对照组(2.17±0.15)nmol/mg·μg,且在盐度20时与对照组差异显著(P<0.05)。
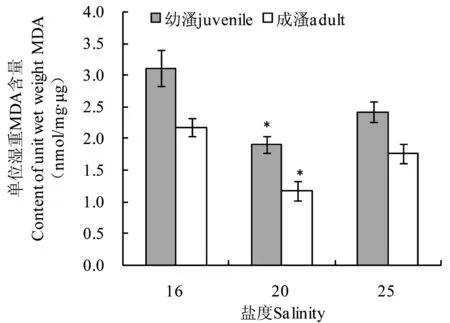
图3高盐胁迫下西藏拟溞MDA的含量Fig 3 MDA content in D. tibetana Sars under high salinity stress
2.2 高温胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
高温胁迫下西藏拟溞SOD的活性见图4。幼溞在高温(20℃和25℃)胁迫下SOD活性分别为(22.22±1.79)U/mg·μg和(27.35±1.41)U/mg·μg,均高于对照组(13.08±1.03)U/mg·μg,且幼溞在20℃时SOD活性与对照组差异显著(P<0.05),在25℃时其活性与对照组差异极显著(P<0.01);成溞在高温(20℃和25℃)胁迫下SOD活性分别为(2.93±0.39)U/mg·μg和(6.16±0.62)U/mg·μg,均高于对照组(1.93±0.47)U/mg·μg,且成溞在25℃时SOD活性与对照组差异显著(P<0.05)。

图4 高温胁迫下西藏拟溞SOD的活性Fig 4 The activity of SOD in D. tibetana Sars under high temperature stress
高温胁迫下西藏拟溞CAT的活性如图5所示。幼溞在高温(20℃和25℃)胁迫下CAT活性分别为(10.11±0.61)U/mg·μg和(12.04±0.73)U/mg·μg,显著和极显著高于对照组(5.66±0.57)U/mg·μg (P<0.05和P<0.01);成溞在高温胁迫下CAT活性均高于对照组,但与对照组差异不显著(P>0.05)。
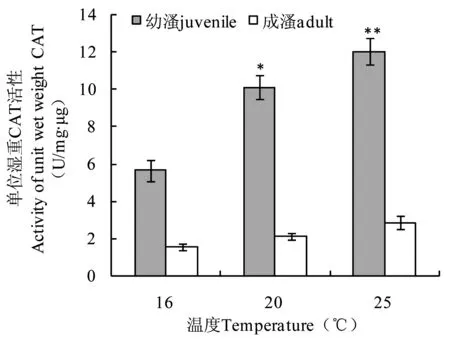
图5 高温胁迫下西藏拟溞CAT的活性Fig 5 The activity of CAT in D. tibetana Sars under high temperature stress
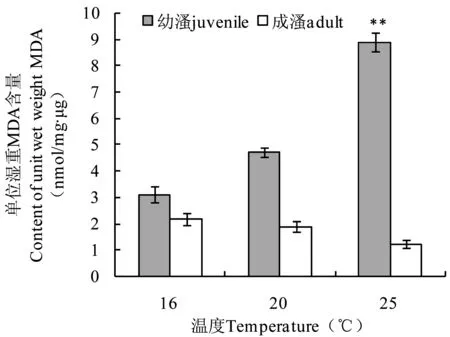
图6 高温胁迫下西藏拟溞MDA的含量Fig 6 MDA content in D. tibetana Sars under high temperature stress
高温胁迫下西藏拟溞MDA的含量如图6所示。幼溞在高温(20℃和25℃)胁迫下MDA含量分别为(4.72±0.19)nmol/mg·μg和(8.88±0.36)nmol/mg·μg,均高于对照组16℃下MDA含量(3.11±0.29)nmol/mg·μg,且在温度为25℃时幼溞MDA含量与对照组差异极显著(P<0.01);成溞在高温胁迫下MDA含量均低于对照组,但与对照组差异不显著(P>0.05)。
3 讨论
3.1 高盐胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
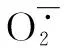
盐度是水环境中重要的理化因子,水体盐度的变化会引起水生动物产生一定的应激反应,盐度通过渗透压调节机体的各项生理机能和机体氧自由基的平衡[31]。赵文等研究了盐度对西藏拟溞排氨率、个体耗氧率和比耗氧率的影响[18-19],结果发现,随着盐度(5、10、15、20和25)的升高,其排氨率和耗氧率均升高,说明该溞的呼吸代谢能力随着盐度的升高而增强。也有研究表明,机体的抗氧化酶活性随呼吸代谢的增加而升高[32]。
本研究发现,幼溞在高盐(20和25)胁迫下,其体内的抗氧化酶SOD、CAT活性增强,MDA含量降低。这说明随着水体盐度的升高,在生物体内细胞与外界水环境之间,形成较高的渗透压落差,导致幼溞机体的渗透调节功能加强。此时,幼溞为了应答盐胁迫环境,机体活动代谢在短时间内过于旺盛,代谢产生过多的氧自由基,刺激诱导体内SOD和CAT 的产生。大量的SOD和CAT降低或清除了活性氧,减少了氧自由基对机体造成的氧化损伤,使机体MDA含量降低。
本试验幼溞体内SOD和CAT分别在盐度25和盐度20时活性最高,分析可能不同的抗氧化酶在同一环境胁迫下所产生的应激性不同,包斯琴等[33]在研究外生菌根菌Paxillus的抗盐机理时发现,随盐度胁迫程度的不同,菌株体内抗氧化酶活性的变化规律有所差异,但是盐处理的菌株抗氧化酶活性明显高于对照菌株。本试验结果与之相符。本试验幼溞体内MDA含量在盐度25组较盐度20组有所升高,说明在盐度25下,机体脂质过氧化程度较高,间接反映出氧自由基对细胞膜损伤较为严重,机体在盐度25下的生理功能和免疫防御能力有所减弱。
通常情况下,机体受到轻度逆境胁迫时,SOD和CAT活性往往升高,清除胁迫反应代谢过程中产生的自由基[26]。而随着逆境胁迫程度的增加,干扰了机体SOD、CAT等抗氧化防御物质的产生,使得SOD和CAT等酶活性降低,体内积累了过多的氧自由基无法清除,导致机体受到氧化损伤[34]。本试验结果发现,在高盐(20和25)胁迫下,成溞的SOD活性变化不明显,CAT活性和MDA含量均降低,这说明盐度胁迫对成溞机体已造成严重伤害,蛋白质、脂类等机体物质的代谢过程都受到影响,其中抗氧化酶等防御物质的合成与活性可能受到了抑制。本实验室前期研究结果表明[23],成溞在盐度20和25组的MDA含量均低于盐度15组,且盐度20组显著低于盐度15组。王巧晗等研究发现,盐度影响西藏拟溞的生长和生殖[35],在适合盐度(10,15)范围内,溞体内各组织器官代谢活动能够保持平衡状态。本试验结果与之相符。
通过上述分析得出,幼溞对高盐胁迫应激能力较强。虽然西藏拟溞对渗透压具有低渗和高渗双重调节机制,但从本试验结果来看,幼溞的渗透压调节能力较强具有一定可塑性,而成溞由于长时间室内培养于盐度为16的稀释海水中,其渗透压的调节能力减弱。
3.2 高温胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响
温度作为影响生物生理活动的重要环境因子,影响着生物体的抗氧化防御体系,能有效地控制生物代谢的反应速率,是影响生物生理活动的重要环境变量。温度胁迫也会引起水生动物产生一定的应激反应,导致体内生理生化指标发生改变。赵文等研究了温度对西藏拟溞排氨率、个体耗氧率和比耗氧率的影响[18-19],结果发现,随着温度(3℃、8℃、14℃、20℃和22℃)的升高,其排氨率和耗氧率均增加,说明该溞体内代谢反应速率随温度的升高而增强。
西藏拟溞属耐低温种类,适宜温度为16℃[35]。本研究发现,在高温(20℃和25℃)胁迫下,幼溞的SOD和CAT活性显著增强,MDA含量也显著升高。表明幼溞在高温胁迫下产生了抗氧化应激反应,随胁迫温度的升高,活性氧自由基越多,为了维持细胞内环境的稳定,SOD和CAT消除活性氧自由基的能力也随之增强,但超过一定的耐受范围后,体内积累过多的氧自由基对西藏拟溞幼溞造成了严重的氧化损伤,导致MDA含量随胁迫程度的增加而升高。
本研究发现,在高温(20℃和25℃)胁迫下,成溞的SOD、CAT活性增强,MDA含量则降低。说明成溞随温度的升高,体内SOD和CAT活力随之增强,体内活性氧自由基能够维持平衡,可减少氧自由基攻击或破坏生物膜,因而机体内MDA含量降低。本实验室前期研究结果表明[23],胁迫24 h后,同一盐度下,西藏拟溞成溞的SOD活性随着温度(16℃、19℃、22℃、25℃和28℃)的升高而升高,25℃和28℃与其他处理组差异显著;MDA含量随着温度的升高呈先降低后升高的趋势。本试验结果与之相符。王巧晗等研究发现,温度影响西藏拟溞的生长和生殖[35],温度高于16℃时,机体活动代谢失衡影响其正常的生长发育。高温胁迫可能促进了成溞的性成熟和能量分配,机体代谢发生改变,导致成溞体内某些蛋白类物质的产生,从而也可导致成溞体内MDA含量的相对下降。
通过上述分析得出,成溞对高温胁迫应激能力较强。幼溞体质较成溞弱,各项生理机能可能尚未发育完全,因此对温度变化更为敏感。西藏拟溞在驯化和培养中应充分考虑温度和盐度对其的交互影响,尽量减少调整渗透压生理耗能,降低氧化应激,以较好地发挥西藏拟溞的生长潜能。该研究结果可为西藏拟溞驯化和规模化培养利用提供科学依据,为环境因子对其他枝角类抗氧化系统的影响提供基础数据。
[1]SARS G O.On the crustacean fauna of central Asia. Pt.Ⅱ[J].Ann Mus Zool St. Pétersb, 1903, 8:157-194.
[2]赵 文,王巧晗,郑绵平,等.西藏拟溞生物学的初步研究[J].大连水产学院学报,2002,17(3):209-214.
[3]蒋燮治,堵南山.中国动物志(节肢动物门甲壳纲淡水枝角类)[M].北京:科学出版社,1979:122-124.
[4]蒋燮治,沈韫芬,龚循矩.西藏无脊椎动物[M].北京:科学出版社,1983:443-492.
[5]赵 文.内陆盐水水体枝角类研究述评[J].大连水产学院学报,1991,6(2):31-41.
[6]赵 文,姜 宏,何志辉.三北地区内陆盐水的浮游甲壳类[J].大连水产学院学报,1996,11(1):1-13.
[7]沈嘉瑞,宋大祥.西藏枝角类的初步研究[J].动物学报,1964,16(1):61-69.
[8]何志辉,姜 宏,姜志强,等.蒙古裸腹溞作为海水鱼苗活饵料的试验[J].大连水产学院学报,1997,12(4):1-7.
[9]霍元子,赵 文,梁 淼.海水中大量培养西藏拟溞及作为红鳍东方鲀鱼苗活饵料的研究[J].大连水产学院学报,2006,21(4):325-330.
[10]赵 文,王巧啥.西藏拟溞形态构造的再描述[J].大连水产学院学报,2005,20(3):165-173.
[11]赵 文,张 鹏,霍元子,等.西藏拟溞的染色体核型研究[J].大连水产学院学报,2004,19(3):167-170.
[12]赵 文,李 睿.4个品系西藏拟溞12S rRNA基因序列及其分子进化研究[J].大连海洋大学学报,2012,27(4):006.
[13]赵 文,霍元子,高 敬.西藏拟溞营养成分的分析与评价[J].中国水产科学,2006,13(3):446-451.
[14]赵 文,毕进红,韩婷婷,等.西藏拟溞遗传多样性的初步研究[J].大连海洋大学学报,2011,26(2):108-113.
[15]郭君秀,唐 珏,赵 文,等.重金属Hg2+、Cd2+对西藏拟溞的急性毒性研究[J].生物学杂志,2012,29(3):14-16.
[16]霍元子,赵 文,魏 杰.Cu2+、Zn2+、Co2+、Ni2+、Li+对西藏拟溞的急性与联合毒性效应[J].中国水产科学,2011,18(2):466-471.
[17]赵 文,霍元子,薛东宁.碱度和pH对西藏拟溞存活、生长和生殖的影响[J].水生生物学报,2007,31(3):332-338.
[18]赵 文,张 琳,霍元子.温度、盐度和体长对西藏拟溞耗氧率的影响[J].生态学报,2005, 25(7):1549-1553.
[19]赵 文,梁 萧,谢 玺,等.温度、盐度和体长对西藏拟溞(DaphniopsistibetanaSars)排氨率的影响[J].生态学报,2008,28(12):6385-6389.
[20]赵 文,何志辉,殷守仁.盐水枝角类的生物学及海水培养利用[M].北京:科学出版社,2008:141-184.
[21]由志欣,赵 文,魏 杰,等.海水中规模化培养西藏拟溞的技术优化研究[J].大连海洋大学学报,2015,30(1):73-78.
[22]RUDNEVA I I.Blood antioxidant system of Black Sea elasmobranch and teleost[J].Comparative Biochemistry and Physiology,1997,118(2):255-260.
[23]亢玉静,赵 文,魏 杰.温度和盐度对西藏拟溞抗氧化酶和脂质过氧化作用的影响[J].生态学报,2015,35(4):1037-1044.
[24]BARATA C, NAVARRO J C, VARO I, et al.Changes in antioxidant enzyme activities, fatty acid composition and lipid peroxidation inDaphniamagnaduring the aging process[J].Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 140(1):81-90.
[25]ALBERTO A C, ROCIO O B, FERNANDO M J. Age effect on the antioxidant activity ofDaphniamagna(Anomopoda: Daphniidae): Does younger mean more sensitivity?[J].Journal of Environmental Biology, 2011, 32(4):481-487.
[26]BORGERAAS J, HESSEN D O. UV-B induced mortality and antioxidant enzyme activities inDaphniamagnaat different oxygen concentrations and temperatures[J].Journal of Plankton Research, 2000, 22(6):1167-1183.
[27]BECKER D, BRINKMANN B F, ZEIS B, et al.Acute changes in temperature or oxygen availability induce ROS fluctuations inDaphniamagnalinked with fluctuations of reduced and oxidized glutathione, catalase activity and gene (haemoglobin) expression[J].Biology of the Cell, 2011, 103(8):351-363.
[28]亢玉静,郎明远,赵 文.水生生物体内抗氧化酶及其影响因素研究进展[J].微生物学杂志,2013,33(3):75-80.
[29]PIPE R K, PORTE C, LIVINGSTONE D R. Antionxidant enzymes associated with the blood cells and haemolymph of the musselMytilusedulis[J].Fish and Shellfish Immunology, 1993, 3(3):221-233.
[30]王 妤,庄 平,章龙珍,等.盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J].水产学报,2011,35(1):66-73.
[31]JARVIS P L, BALLANTYNE J S.Metabolic responses to salinity acclimation in juvenile shortnose sturgeonAcipenserbrevirostrum[J].Aquaculture, 2003, 219(1-4):891-909.
[32]FJLHO D W, GIULIVI C, BOVERIS A.Antioxidant defences in marine fish-Elasmobranhs[J].Comparative Biochemistry and Physiology,1993,106(2):409-413.
[33]包斯琴,李 静,孙 健,等.盐胁迫下外生菌根菌Paxillus抗氧化酶活性的变化[J].安徽农业科学, 2012, 40(15):8401-8403.
[34]孔繁翔.环境生物学[M].北京:高等教育出版社, 2002: 55.
[35]王巧晗.温度和盐度对西藏拟溞存活、生长、发育和生殖的影响[D].大连:大连水产学院, 2004.
Effects of environmental stress on activity of SOD, CAT and MDA content inDaphniopsisTibetanaSars
WEI Jie1, BAN Yan-li1, WANG Yuan1, ZHAO Wen1, XIE Xi2, LI Pei-pei1
(1. Key Laboratory of Hydrobiology in Liaoning Province, Dalian Ocean University, Dalian 116023; 2. Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China)
The present study investigated the effects of salinity (20 and 25) and temperature (20℃ and 25℃) stress on activities of SOD(Superoxide Dlismutase), CAT(Catalase) and MDA(Maldondialdehyde) content in juvenile and adult ofDaphniopsistibetanaSars, by method for experimental ecology, respectively. The result showed that high concentration of salt stress treatment increased the activities of SOD and CAT and reduced MDA content in juvenile. There were no significant differences in adult SOD activity induced by high salinity stress. And the activity of CAT and MDA content were higher in experimental group (salinity 20 and 25) compared with the control group (salinity 16). High temperature stress (20℃ and 25℃) obviously increased the activities of SOD and CAT, MDA content in juvenile. While the adult under high temperature treatment showed the increase SOD and CAT activities, yet the decrease of MDA content. The results indicated that the juveniles were more tolerant to high salinity stress, less tolerant to high temperature stress than the adults. The results were opposite in adults compared with juveniles under high salinity or temperature stress. These results provide some basic data for the research on antioxidative enzyme system in other cladocerans species under environmental stress, and scientific base for the domestication and large-scale culture ofDaphniopsistibetanaSars.
environmental stress;DaphniopsistibetanaSars; SOD; CAT; MDA
2016-10-18;
2016-10-24
国家自然科学基金项目 (41501535);国家科技基础性工作专项(2014FY210700)
魏 杰,副研究员,主要从事浮游生物实验生态学研究,E-mail:weijie@dlou.edu.cn
赵 文,教授,博士生导师,主要从事水域生态学研究,E-mail:zhaowen@dlou.edu.cn
Q178.1
A
2095-1736(2017)03-0042-05
doi∶10.3969/j.issn.2095-1736.2017.03.042
