猪重要感染病毒蛋白的二级结构、抗原表位分析及三联表位多肽疫苗的重组预测
2017-07-18陈春琳吴三桥
刘 祥, 陈 琛, 陈春琳, 吴三桥
(陕西理工大学 中德天然产物研究所 陕西省天麻山茱萸工程技术研究中心, 汉中 723001)
猪重要感染病毒蛋白的二级结构、抗原表位分析及三联表位多肽疫苗的重组预测
刘 祥, 陈 琛, 陈春琳, 吴三桥
(陕西理工大学 中德天然产物研究所 陕西省天麻山茱萸工程技术研究中心, 汉中 723001)
为设计猪重要感染病毒的蛋白表位多肽疫苗,选取猪感染病毒的候选疫苗蛋白:猪繁殖与呼吸综合征病毒的GP5蛋白,猪圆环病毒2型的CAP蛋白,猪瘟病毒的E2蛋白。综合ABCpred和BepiPred方案,预测候选蛋白的B细胞表位;利用神经网络与量化矩阵法预测蛋白的CTL表位;采用MHC-Ⅱ类分子结合肽在线程序预测蛋白的Th表位。使用SOPMA方法与DNASTAR软件分析候选蛋白的二级结构,进一步验证B/T细胞表位预测结果的准确性。然后,通过Protean程序重组拼接获得的B/T细胞抗原表位。结果显示GP5蛋白具有4个优势B细胞表位,CAP、E2蛋白分别具有5个B细胞表位;GP5、CAP与E2蛋白各具有1个CTL表位;GP5、E2蛋白分别具有2个Th表位,CAP蛋白存在1个Th表位。二级结构分析显示预测获得的B/T细胞表位均处于蛋白易于产生表位的暴露表面、无规则卷曲与转角等位置,验证了B/T细胞表位预测结果的准确性。Protean程序重组拼接获得优势的B/T细胞抗原表位。最终设计获得抗原性较好的猪病毒三联表位多肽,为猪易感病毒的多联疫苗开发奠定基础。
猪病毒;表位疫苗;二级结构分析;抗原分析
猪呼吸道疾病是诱发猪死亡的重要原因之一,主要症状为发热、咳嗽、呼吸困难、生长缓慢等,给猪养殖业造成巨大经济损失[1]。感染的病毒主要为猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)[2],猪圆环病毒2型(Porcine circovirus type 2, PCV2)[3]以及猪瘟病毒(Classical swine fever virus, CSFV)[4]。针对猪病毒感染的治疗尚无高效药物,主要为抗病毒剂如干扰素、白细胞介导素、免疫球蛋白、转移因子等,治疗成本高[5]。研究发现猪病毒疾病防治根本途径为免疫制剂[6]。目前,人们针对猪病毒蛋白开展了一些研究,证实PRRSV、PCV2与CSFV病毒抗原性较好的蛋白分别为GP5、CAP和E2[7-9],并进行了免疫功能的验证,发现这些蛋白是很好的候选蛋白疫苗,但均处于研究的初步阶段,商业化较少见[10]。而且猪病毒感染往往是混合型,给防治带来一定难度,有必要开发新型的蛋白疫苗。
表位疫苗是近年发展起来的一种新型疫苗,具有安全、稳定、产量高、免疫效果好,以及可人为设计等优点。在肿瘤、肝炎、流感等疾病防治上均有研究[11],是疫苗研究的新方向。然而,表位疫苗在猪病毒感染的防治上尚未展开。我们期望通过生物信息学方法,将猪病毒候选蛋白疫苗进行B/T细胞表位预测、重组拼接,以期设计安全、免疫简洁与高效的猪病毒蛋白表位多肽重组疫苗,进而实现猪单次免疫就可有效抵御3种病毒的感染。
1 材料与方法
1.1 材料
选取猪繁殖与呼吸综合征病毒,猪圆环病毒2型,以及猪瘟病毒的候选蛋白疫苗,分别为GP5、CAP与E2,其NCBI网站公布的氨基酸序列登录号分别为ACJ23261.1、AAW79866.1、NP_777498.1。
1.2 方法
1.2.1 B细胞表位预测 采用BepiPred和ABCpred方法联合预测B细胞表位。最终B细胞表位为两种方案共有的氨基酸序列[12]。
1.2.2 T细胞表位预测 细胞毒性T细胞(CTL)抗原表位采用量化矩阵与人工神经网络法预测,选择HLA-A2、HLA-A*0201、HLA-A*0202、HLA-A*0203、HLA-A*0205分子结合肽,通过CTLpred程序预测。辅助T细胞(Th)抗原表位预测选择结合肽类型为DRB1-0101、DRB1-0102和DRB1-0301,预测的软件为:http://www.imtech.res.in/raghava/propred/[13]。
1.2.3 蛋白二级结构预测 蛋白二级结构采用SOPMA方法与DNASTAR软件进行联合预测,从而检测获得各个蛋白B/T细胞表位信息。目的是验证获得的B/T细胞表位是否处于蛋白抗原性较好的肽段位置。
1.2.4 重组表位疫苗的设计 将各个蛋白预测获得的B/T细胞表位,按照B细胞表位、CTL细胞表位及Th细胞表位顺序进行编号,每个表位之间通过4个甘氨酸(GGGG)进行柔性连接,以尽量减少各自表位间的相互干扰。然后,通过DNASTAR软件分析表位的不同排列方式,以各表位相对独立且具有较好抗原性参数的组合方式,作为重组表位多肽的氨基酸序列。最后,将多肽序列翻译为核酸序列,获得重组表位多肽的核酸序列。
2 结果
2.1 B细胞表位预测
综合BepiPred和ABCpred两种方法预测B细胞表位。BepiPred方法预测蛋白B细胞表位结果如表1所示;ABCpred方法预测结果见表2。综合BepiPred和ABCpred两种方案的共同序列区段,最终获得猪繁殖与呼吸综合征病毒GP5蛋白优势B细胞表位区段为:32~36,98~101,164~168,184~192;猪圆环病毒2型CAP蛋白B细胞表位区段为:60~65,79~88,109~116,164~168,172~180;猪瘟病毒E2蛋白B细胞表位区段为:25~32,89~97,142~147,156~163,270~285。

表1 BepiPred方法预测蛋白B细胞表位的肽段位置

表2 ABCpred方法预测蛋白B细胞表位的肽段位置
2.2 T细胞表位预测2.2.1 CTL细胞表位预测 CTL抗原表位预测采用人工神经网络与量化矩阵法,分子结合肽选择HLA-A2、HLA-A*0201、HLA-A*0202、HLA-A*0203、HLA-A*0205,结果见表3。综合多肽共有的区段,获得猪繁殖与呼吸综合征病毒GP5蛋白的优势CTL细胞表位区段为119~127的ALICFVIRL;猪圆环病毒2型CAP蛋白CTL细胞表位区段为22~29的ILRRRPWL;猪瘟病毒E2蛋白CTL细胞表位区段为349~357的ALLGGRYVL。
2.2.2 Th细胞表位预测 采用人工神经网络与量化矩阵法预测Th抗原表位,预测结合多肽种类选择DRB1*0101、DRB1*0102、DRB1*0301,结果见表4。综合多肽共有的区段,获得猪繁殖与呼吸综合征病毒GP5蛋白优势Th细胞表位区段为28~36的LVNASNNNS,以及125~133的IRLAKNCMS;猪圆环病毒2型CAP蛋白Th细胞表位区段为185~193的LRLQTAGNV;猪瘟病毒E2蛋白Th细胞表位区段为227~232的LVNETG;以及348~354的VALLGGR。

表3蛋白CTL抗原表位预测

表4 蛋白Th抗原表位预测
2.3 蛋白二级结构预测
为检测获得的3种蛋白B细胞与T细胞表位的准确性,利用DNASTAR软件和SOPMA方法对蛋白二级结构进行预测,验证获得的蛋白B/T细胞抗原表位是否处于易于产生抗体的无规则卷曲、暴露表面及转角等位置。使用DNASTAR程序,从蛋白的亲水性、可柔性、表面可极性与抗原指数方面,预测的3种蛋白抗原性结果如图1~3所示。应用SOPMA方法预测3种蛋白的二级结构结果如图4~6所示。结果发现预测的3种蛋白B/T细胞表位均处于抗原性较好的区段,支持预测的B/T细胞抗原表位的合理性。
2.4 表位多肽疫苗的重组
将预测获得的3种细菌各自的B/T细胞表位,分别按照B细胞表位、CTL表位、Th表位顺序进行编号,再通过Protean程序分析线性表位的各种排列方式,以重组的多表位间相对独立,抗原性参数较好为标准;并且各多肽间柔性接头氨基酸采用4个甘氨酸(GGGG)。结果发现猪繁殖与呼吸综合征病毒GP5蛋白表位排列顺序为:epitope4-epitope6-epitope7-epitope3-epitope5-epitope2-epitope1;猪圆环病毒2型CAP蛋白表位排列顺序为:epitope1-epitope3-epitope4-epitope6-epitope7-epitope2-epitope5;猪瘟病毒E2蛋白表位排列顺序为:epitope3-epitope4-epitope6-epitope7-epitope1-epitope8-epitope5-epitope2。再将3种菌各自预测完成的串联表位进一步拼合,并采用Protean程序进行分析,获得抗原性参数较好的重组表位多肽,如图7所示。至此,设计获得猪重要感染病毒的三联表位疫苗多肽的序列为:SAATPLTRVGGGGLVNASNNNSGGGGIRLAKNCMSGGGGGGKVEGGGGALICFVIRLGGGGTAGYGGGGSNNNSGGGGTTVKTPGGGGSPITQGDRGGGGKPVLDGGGGILRRRPWLGGGGLRLQTAGNVGGGGFLPPGGGSNPGGGGDYFQPNNKRGGGGVSPTTLGGGGRRDKPFPHGGGGALLGGRYVLGGGGLVNETGGGGGGLTTTWKEGGGGVALLGGRGGGGERLGPMPCRPKEIVSSGGGGPSTEEMGDD(下划线表示接头氨基酸序列);翻译成核酸序列为:TCCGCGGCAACCCCTTTAACCAGAGTTGGTGGCGGTGGCCTCGTCAACGCCAGCAACAACAACAGCGGTGGCGGTGGCATTAGGCTTGCGAAGAACTGCATGTCCGGTGGCGGTGGCGGAGGTAAGGTTGAGGGTGGCGGTGGCGCGCTGATTTGCTTTGTCATTAGGCTTGGTGGCGGTGGCACCGCCGGATATGGTGGCGGTGGCAGCAACAACAACAGCGGTGGCGGTGGCACCACAGTCAAAACGCCCGGTGGCGGTGGCTCCCCGATCACCCAGGGTGACAGGGGTGGCGGTGGCAAACCTGTCCTAGATGGTGGCGGTGGCATCCTCCGCCGCCGCCCCTGGCTCGGTGGCGGTGGCCTGAGACTACAAACTGCTGGAAATGTAGGTGGCGGTGGCTTTCTTCCCCCAGGAGGGGGCTCAAACCCCGGTGGCGGTGGCGATTACTTCCAACCAAACAACAAAAGAGGTGGCGGTGGCGTGAGCCCAACAACTCTGGGTGGCGGTGGCAGGAGAGACAAGCCCTTTCCGCACGGTGGCGGTGGCGCACTGTTAGGAGGAAGATATGTCCTGGGTGGCGGTGGCTTGGTAAATGAGACAGGTGGTGGCGGTGGCGGTCTCACCACCACCTGGAAAGAAGGTGGCGGTGGCGTAGCACTGTTAGGAGGAAGAGGTGGCGGTGGCGAAAGACTGGGCCCTATGCCATGCAGACCCAAAGAGATTGTCTCTAGTGGTGGCGGTGGCCCATCAACTGAGGAAATGGGAGATGAC(下划线为接头氨基酸的核酸序列)。

图1 猪繁殖与呼吸综合征病毒GP5蛋白表位分子的抗原性分析
Fig 1 Antigenicity analysis of PRRSV GP5 protein epitopes molecular

图2 猪圆环病毒2型CAP蛋白表位分子的抗原性分析
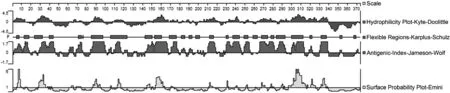
图3 猪瘟病毒E2蛋白表位分子的抗原性分析

图4 DNASTAR软件预测猪繁殖与呼吸综合征病毒GP5蛋白二级结构
c:无规则卷曲;e:β-片层;h:a-螺旋;t:β-转角

图5 DNASTAR软件预测猪圆环病毒2型CAP蛋白二级结构
c:无规则卷曲,e:β-片层,h:a-螺旋,t:β-转角

图6 DNASTAR软件预测猪瘟病毒E2蛋白二级结构
c:无规则卷曲;e:β-片层;h:a-螺旋;t:β-转角

图7 重组多表位分子的抗原性分析
3 讨论
表位疫苗是利用体外表达或人工合成细菌、病毒蛋白结构中具有免疫合性的片段而制成的疫苗[14];具有安全、稳定、免疫效果好,以及可人为设计等优点。在艾滋病、肿瘤、肝炎、寄生虫和流感等疾病防治上均有大量研究[11,15]。生物信息学可实现蛋白表位的预测、设计,增加试验的针对性,为人们合成表位疫苗奠定基础[16-17]。表位预测类型可分为线性表位与构象型表位两种[18]。线性表位基于蛋白的氨基酸一级结构,准确度可达60 %;构象型表位基于目标蛋白的三维结构预测,对于未知结构蛋白预测存在一定难度[19]。总体上,构象型表位较线性表位研究缺乏,技术手段上也不成熟[20],现行的表位预测大多针对线性表位。
目前,关于猪呼吸道病毒的表位疫苗研究尚处于起步阶段。有人合成呼吸综合征病毒GP5蛋白部分抗原,制备抗体进行猪病毒的检测[21];吴胜昔等设计获得了免疫原性较好的猪圆环病毒CAP表位多肽[8]。然而这些初步设计的表位疫苗,仅针对单个病毒,且免疫功能研究缺乏,对于防治猪呼吸道病毒疾病具有局限性。本研究从猪呼吸道病毒主要感染病毒着手,设计了三联表位多肽疫苗,有望进一步提高猪呼吸道病毒感染的防治效果。
B细胞表位是抗原被B细胞表面受体或抗体特异性识别并相互结合的多肽片段,其预测常见的方法主要应用BepiPred、ABCpred及DNASTAR软件。BepiPred主要利用氨基酸的性质和隐形马尔可夫模型预测线性表位[22];ABCpred是基于人工神经网络算法,准确率达65.9%[23]。前期,我们通过两种方法的结合,对猪链球菌蛋白和溶藻弧菌外膜蛋白U开展了B细胞表位预测[12-13]。本研究采用BepiPred和ABCpred联合预测的方式,对3种病毒的蛋白进行了B细胞表位预测。
T细胞表位包含有CTL(细胞毒性T淋巴细胞)表位和Th(T辅助细胞)表位,分别是抗原中与MHC-Ⅰ、MHC-Ⅰ类分子结合的短肽[24-25]。CTL预测常采用人工神经网络法结合量化矩阵法[26],在细菌、病毒蛋白CTL抗原表位预测上研究广泛[12, 27]。Th表位预测方法在病毒蛋白、细菌蛋白均实现了成功预测[13,28]。但在猪呼吸道病毒T细胞表位预测上尚未开展。本试验借助于T细胞表位预测的成熟方法,预测获得了CTL、Th细胞表位,为防治猪呼吸道病毒感染提供科学依据。
表位间的柔性连接接头使得各表位间相对独立,具有分子刚性[29]。采用较多的柔性接头氨基酸序列有GGGG、GGGGS、KK与AAY[30-31]。本研究采用GGGG氨基酸接头,并通过Protean程序对不同表位拼接方式进行优化,最终预测获得抗原性较好的重组表位多肽,为猪易感病毒的多联疫苗开发奠定基础。
[1]SALGUERO F J, FROSSARD J P, REBEL J M, et al. Host-pathogen interactions during porcine reproductive and respiratory syndrome virus 1 infection of piglets[J]. Virus Res, 2015, 202:135-143.
[2]FERRARINI G, BORGHETTI P, DE ANGELIS E, et al. Immunoregulatory signal FoxP3, cytokine gene expression and IFN-γ cell responsiveness uponporcine reproductive and respiratory syndrome virus (PRRSV) natural infection [J]. Res Vet Sci, 2015, 103:96-102.
[3]张挺杰, 刘 星, 孙 涛, 等. 表达猪圆环病毒"型 Z9U"基因的重组猪繁殖与呼吸综合征病毒的构建与鉴定 [J]. 病毒学报, 2015, 31(1):65-73.
[4]高 飞, 曲泽慧, 姜一峰, 等. 重组猪瘟病毒C株E2蛋白的猪繁殖与呼吸综合征病毒的构建及鉴定 [J]. 中国动物传染病学报, 2015, 23(5):1-9.
[5]刘淑敏, 闫若潜, 吴志明, 等. 重组猪a干扰素-白细胞介素-2复合蛋白在猪体内抗高致病性PRRSV活性的研究 [J]. 中国兽医科学, 2013, 43(8):855-860.
[6]闫若潜, 王东方, 吴志明, 等. 猪圆环病毒2型ORF2/猪白介素2嵌合表达质粒在猪体内诱导的保护性免疫反应 [J]. 中国兽医学报, 2014, 34(2):199-206.
[7]FAN B C, LIU X, BAI J, et al. The amino acid residues at 102 and 104 in GP5 of porcine reproductive and respiratory syndrome virus regulate viral neutralization susceptibility to the porcine serum neutralizing antibody [J]. Virus Res, 2015, 204:21-30.
[8]吴胜昔,曾 政,蔡家利, 等. 猪圆环病毒 2 型 CAP 蛋白新型表位抗原肽的设计、合成及免疫原性研究 [J]. 免疫学杂志, 2014, 30(5):397-401.
[9]WU R, LI L, ZHAO Y, et al. Identification of two amino acids within E2 important for the pathogenicity of chimeric classical swinefever virus[J]. Virus Res, 2016, 211:79-85.
[10]FANG X, QI B, MA Y, et al. Assessment of a novel recombinant vesicular stomatitis virus with triple mutations in its matrix protein as avaccine for pigs [J]. Vaccine, 2015, 33(46):6268-6276.
[11]Yuan X M, Lin H X, Fan H J. Efficacy and immunogenicity of recombinant swinepox virus expressing the A epitope of the TGEVS protein [J]. Vaccine, 2015, 33(32):3900-3906.
[12]刘 祥. 猪链球菌Lmb、Sao、ZnuA蛋白的抗原表位、二级结构分析及重组表位疫苗分子的设计 [J]. 生物技术, 2016, 26(2):181-187.
[13]刘 祥. 溶藻弧菌外膜蛋白OmpU的原核表达、抗原性鉴定与生物信息学分析 [J]. 华北农学报, 2015, 30(6):37-43.
[14]赵 德, 冯 磊, 张 强. 表位疫苗的设计及应用研究进展 [J]. 生命科学, 2012, 24(2):174-180.
[15]HUBER S K R, CAMPS M G M, JACOBI R H, et al. Synthetic long peptide influenza vaccine containing conserved T and B cell epitopes reduces viral load in lungs of mice and ferrets [J]. PLoS One, 2015, 10(6):e0127969.
[16]AMAT-UR-RASOOL H, SAGHIR A, IDREES M. Computational prediction and analysis of envelop glycoprotein epitopes of DENV-2 and DENV-3 pakistani isolates: a first step towards dengue vaccine development[J]. PLoS One, 2015, 10(3):e0119854.
[17]胡晓波, 朱乃硕. 狂犬病毒MHC限制性CTL与Th表位的预测与鉴定 [J]. 中国免疫学杂志, 2013, 29(7):736-740.
[18]赵 德, 冯 磊, 张 强, 等. 表位疫苗的设计及应用研究进展 [J]. 生命科学, 2012, 24(2): 174-180.
[19]贾秋磊, 尹茂鲁, 陈 磊, 等. 巴曲酶的线性和构象型 B 细胞抗原表位的预测 [J]. 中国免疫学杂志, 2013, 29(11): 1193-1201.
[20]LIANG Y, GUTTMAN M, DAVENPORT T M, et al. Probing the impact of local structural dynamics of conformational epitopes on antibody recognition [J]. Biochemistry, 2016, 55(15): 2197-2213.
[21]陈如敬, 吴学敏, 车勇良, 等. 串联表达猪繁殖与呼吸综合征病毒GP5表位蛋白间接ELISA方法的建立 [J]. 中国畜牧兽医, 2014, 41(4):43-47.
[22]CHEN H, YANG H W, WEI J F, et al. In silico prediction of the T-cell and IgE-binding epitopes of Pera 6 and Blag 6 allergens in cockroaches [J]. Mol Med Rep, 2014, 10(4):2130-2136.
[23]SAHA S, RAGHAVA G P. Prediction of continuous B-cell epitopes in an antigen using recurrent neural network [J]. Proteins, 2006, 65(1):40-48.
[24]LI J, BAI J, GU L, et al. Prediction and identification of HLA-A*0201 restricted epitopes from leukemia-associated protein MLAA-22 which elicit cytotoxic T lymphocytes [J]. Med Oncol, 2014, 31(12):293.
[25]秦培兰, 李 艳, 米荣升, 等. 微小隐孢子虫三个基因主要抗原表位区的串联表达及其抗原性分析 [J]. 中国动物传染病学报, 2012, 20(3):36-43.
[26]王光祥, 尚佑军, 吕占禄, 等. 羊口疮病毒F1L蛋白二级结构分析与表位预测[J]. 中国人兽共患病学报, 2012, 28(12):1185-1190.
[27]王 晶, 李 敏, 杜骁杰, 等. 2型猪链球菌表面蛋白Sao的生物信息学分析及基因工程疫苗的设计 [J]. 中国病原生物学杂志, 2014, 9(3):211-215.
[28]ZHANG L, ZHOU X, FAN Z, et al. Identification of a conserved B-cell epitope on the GapC protein ofStreptococcusdysgalactiae[J]. Microb Pathog, 2015, 83-84:23-28.
[29]季晶晶, 李槿年. 拟态弧菌 Om pU抗原表位的预测与多表位疫苗分子的设计 [J]. 水生态学杂志, 2008, 1(1):75-79.
[30]董 林, 王艳萍, 沈志强, 等. 猪圆环病毒2型多表位串联体诱导表达及其免疫活性 [J]. 中国兽医学报, 2014, 34(11):1716-1720.
[31]LEROUX L P, DASANAYAKE D, ROMMEREIM L M, et al. Secreted toxoplasma gondii molecules interfere with expression of MHC-II in interferon gamma-activated macrophages [J]. Int J Parasitol, 2015, 45(5):319-332.
The secondary structure, antigen epitope analysis and recombination prediction triple epitope peptide vaccine of porcine important infection virus protein
LIU Xiang, CHEN Chen, CHEN Chun-lin, WU San-qiao
(Chinese-German Joint Institute for Natural Product Research, Shaanxi University of Technology, Shaanxi Engineering Research Center of Tall Gastrodia Tuber and Medical Dogwood, Hanzhong 723001, China)
In order to design protein epitope polypeptide for important infectious virus of porcine, the candidate proteins vaccine of swine infection virus was selected. The selected proteins included GP5 protein of PRRSV (porcine reproductive and respiratory syndrome virus), CAP protein of PCV2 (porcine circovirus type 2), and E2 protein of CSFV (classical swine fever virus). ABCpred and BepiPred prediction programs were used to predict B cell epitopes, quantitative matrix, the artificial neural network was used to predict CTL cell epitopes, and an online server prediction was used to analysis MHC class Ⅱ peptide binding affinity. The secondary structure further verifying the accuracy of B/T cell epitopes was analyzed by SOPMA and DNASTAR software. The B/T cell epitopes were recomposed by protean program. The results showed that GP5 protein had 4 B cell epitopes, CAP and E2 had 5 B cell epitopes, and GP5, CAP and E2 protein had 1 CTL cell epitopes. GP5 and E2 protein had 2 Th cell epitopes, and CAP protein had 1 Th cell epitopes. The secondary structure showed that most of the B/T cell epitopes were located in the exposed surface, the random coil and the corner, which verified the prediction accuracy of B/T cell epitopes. The B/T cell epitopes were recomposed by protean program, and triple epitope vaccine of porcine virus holding better antigen was designed finally, and laid the foundation for the development of swine virus multi vaccine.
porcine virus; epitope vaccine; secondary structure analysis; antigenic analysis
2016-05-16;
2016-05-27
陕西省农业科技创新与攻关项目(2016NY-088);陕西理工大学校级科研项目(SLGKY16-13)
刘 祥,博士,讲师,主要从事蛋白质组学与免疫学研究,E-mail:liuxiang888525@163.com
S852.6
A
2095-1736(2017)03-0018-06
doi∶10.3969/j.issn.2095-1736.2017.03.018
