铁皮石斛多聚泛素基因Polyubiquitin1(DoUb1)的克隆及表达分析
2017-07-18安红强王万军
裴 薇, 梁 易, 范 静, 安红强, 王万军
(西南交通大学 生命科学与工程学院, 成都 610031)
铁皮石斛多聚泛素基因Polyubiquitin1(DoUb1)的克隆及表达分析
裴 薇, 梁 易, 范 静, 安红强, 王万军
(西南交通大学 生命科学与工程学院, 成都 610031)
采用RACE (rapid amplification of cDNA ends) 技术获得铁皮石斛(DendrobiumofficinaleKimuraetMigo)Polyubiquitin1 (DoUb1) ,该基因全长1985 bp,开放阅读框为1371 bp,编码457个氨基酸残基的亲水性蛋白,分子质量为51 179.7 ku,理论等电点pI为7.76;亚细胞定位分析表明该基因产物主要在细胞质或线粒体基质中发挥作用。DoUb1与水稻、玉米及谷子等单子叶植物的多聚泛素基因亲缘关系较近。实时荧光定量PCR (RT-qPCR)分析结果显示,DoUb1在铁皮石斛幼苗根和叶中表达量较高,茎中表达量较低;在干旱胁迫和温度胁迫过程中的表达量都低于正常状况,在干旱胁迫的早期,表达量降低,6 h时达到最低,之后随胁迫时间的延长而缓慢升高;在温度胁迫情况下,DoUb1具有与干旱胁迫相近的响应特性,但低温胁迫相比高温胁迫下,DoUb1表达量更低,表明该基因对低温胁迫更敏感,结果为后期研究铁皮石斛生长发育提供一定基础。
RACE;铁皮石斛;Polyubiquitin;RT-qPCR
细胞内永不停歇地进行着蛋白质的合成、更新与降解,蛋白质的选择性降解在这一过程中起着非常重要的作用。泛素(Ubiquitin)是这一过程中的一个重要成员。泛素是Goldstein首次于1975年从小牛胰脏中分离得到一个含76个氨基酸残基的小肽,后来人们又发现该小肽广泛存在于所有真核细胞中,并因而得名[1]。泛素基因家族可分为UbEP(UbiquitinExtensionProtein)和Polyubiquitin两类。UbEP是只编码1个泛素单位的泛素蛋白基因,而Polyubiquitin为多聚泛素蛋白基因,其编码产物为多个串联的泛素单位头尾相连形成[2]。UbEP编码的泛素单体通常作为分子伴侣参与核糖体的装配过程,多聚泛素基因表达产物主要参与泛素-蛋白酶体途径(Ubiquitin-proteasome system, UPS)中的蛋白质水解[3]。
在高等真核生物中,Polyubiquitin基因的表达相当复杂,在不同的细胞生长、发育时期和胁迫条件下,Polyubiquitin基因表达情况不同[4]。研究发现高等植物在应对高温、严寒和干旱等外界非生物胁迫或生物胁迫下均会产生各种胁迫应答蛋白,而这些蛋白会随着逆境的解除而被陆续降解[5]。泛素基因在逆境条件下表达会增加,异常蛋白降解速率加快,这种结果间接说明泛素系统在生物逆境适应中的作用[6]。
当细胞所处的环境温度突然升高时,会产生热激蛋白和大量的变性蛋白,当细胞所处的环境温度突然降低,或在干旱条件下,也会产生一些错误折叠的蛋白,细胞首先会将变性蛋白或错误折叠蛋白作为靶蛋白进行泛素化标记,然后转运至蛋白酶体,并降解成短肽[7]。如果泛素链形成或者修饰过程中有任何的失调,均会导致生物体内环境的紊乱,从而产生严重病害[8]。
铁皮石斛是一种传统的中国药用植物,具有观赏价值和广泛的药用价值[9]。本文结合PCR技术获得了铁皮石斛多聚泛素基因DoUb1并利用RT-qPCR技术,分析在温度胁迫、干旱胁迫条件下对铁皮石斛DoUb1基因表达的影响,为分析胁迫对铁皮石斛发育影响的研究奠定基础。
1 材料与方法
1.1 材料
铁皮石斛成熟种子接种于1/2MS培养基、25℃培养室进行培养获得试管苗,选取具4片完全伸展叶片的试管植株备用。对备用植株分别进行35℃高温和5℃低温以及50% PEG模拟干旱两种类型胁迫处理,处理时间均为1~48 h。
1.2 铁皮石斛总RNA的提取及第一链cDNA的合成
使用Plant RNA Kit 试剂盒(Omega) 分别对备用植株的根、茎、叶组织以及胁迫处理和未胁迫处理的整苗植株提取总RNA。选择D260 nm/D280 nm为1.8~2.0、凝胶电泳检测结果清晰的总RNA进行反转录,反转录反应按cDNA合成试剂盒(TAKARA)说明书进行。
1.3 铁皮石斛DoUb1 cDNA的获取
根据铁皮石斛原球茎转录组数据中的多聚泛素基因序列,利用Primer Primer 5.0设计其3′RACE的5′端巢式PCR引物(Outer Primer:5′-ATTGATTGAGAGTGTGTATGTGGTTCC-3;Inner Primer:5′-TTGAGGCTCTGTTTCCTTGTA-3′)、3′端巢式PCR引物(Outer Primer:RP5′-GTCAACGATACGCTACCTAACG-3′,Inner Primer:RNP5′-TACGTACGGCATGACAGTG-3′),5′RACE的5′端巢式PCR引物(Outer Primer:Oligo(T)11AP5′-AGGACTCACTATAGGGCTTTTTTTTTTTVN-3′,Inner Primer:T7 promoter 5′-GTAATACGACTCACTATAGGGC-3′),3′端巢式PCR引物(Outer Primer:5′-AGAACGACCTAAAGCGGG-3′;Inner Primer:5′-CAAGGAAACAGAGCCTCAACA-3′)。以cDNA为模板,使用EasyTaqDNA Polymerase (TRANSGEN BIOTECH)分别进行PCR扩增,扩增体系为25 μL (EasyTaqDNA Polymerase 0.15 μL、正向引物1 μL、反向引物1 μL、cDNA模板1 μL、ddH2O 19.35 μL、EasyTaqbuffer 2.5 μL),扩增条件(退火温度以51℃~62℃梯度考察)为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸3 min,共35个循环;72℃延伸5 min。PCR结果进行凝胶电泳检测,再经过胶回收、T载体连接、质粒转化、蓝白斑筛选并经菌液PCR检测无误后,由成都擎科梓熙生物技术有限公司测序。测序数据与转录组数据验证一致后,将测序数据与转录组序列数据进行拼接得到具全长CDS的 cDNA序列。
1.4DoUb1的生物信息学分析
利用bioXM的ORF功能预测开放阅读框[10];利用NCBI(http://www.ncbi.nim.nih.gov/)的BLAST在线分析工具选出与基因序列相近的其他物种序列,利用DNAMAN(LynnonBiosoft)对其进行比对分析[11];利用Protparam软件对DoUb1氨基酸序列进行理化性质的分析;利用Bibsonomy软件对多聚泛素进行二级结构预测[12];使用在线工具Psort:http://psort.hgc.jp/对多聚泛素进行亚细胞定位[13]。将DoUb1进行Blastn比对,选取与其一致性在82%以上,不同植物的18条多聚泛素基因,使用MEGA6的邻近法(NJ)构建进化树[14]。
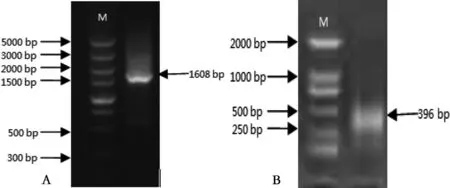
图1 DoUb1 cDNA扩增结果
A:3′RACE产物;B:5′RACE产物。M:Marker
1.5DoUb1在不同组织以及胁迫条件下的基因表达分析
通过Primer Primer5.0对已得到的克隆序列设计的定量引物为:上游引物F:5′-TCCATCTTGTTCTCCGCC9-3′,下游引物R:5′-TCCTTGTCCTGTATCTTAGCCT-3′。将提取的各类cDNA按10 μL反应体系进行扩增(SYBR green 5 μL、cDNA 0.5 μL、MilliQ ddH2O 2.9 μL、引物各0.8 μL),反应体系为95℃预变性30 s;95℃变性5 s,60℃退火10 s,72℃延伸25 s,45个循环;72℃延伸30 s。得出基因的相对表达量并进行分析。
2 结果与分析
2.1DoUb1 cDNA序列的获得以及序列分析
RACE测序数据与转录组序列数据拼接后得到1985 bp cDNA序列。图1为3′RACE和5′RACE的PCR电泳图,3′RACE测序得到1608 bp长度的序列,5′RACE测序得到396 bp长度的序列。拼接后的序列其5′端和3′端各有一段非编码区,分别由402个和212个核苷酸组成,3′末端具有一个含18个A的poly(A)尾。利用BioXM软件对其进行序列分析,开放阅读框长度为1371 bp,位于403~1774 bp,编码457个氨基酸蛋白残基。经NCBI Blastn比对,该基因与其他植物多聚泛素基因核苷酸序列相似性均在81%以上,故命名为DoPolyubiquitin1 (DoUb1)。将其编码产物序列通过NCBI在线比对工具Blastp分析,保守结构域分析结果显示该产物是由6个泛素单位所组成,每个泛素单位由76个氨基酸残基构成,都含有保守的Ubq-E2、Ubq-UCH、Ubq-CUE作用位点(图2);序列比对结果显示,该产物序列与其他物种的多聚泛素蛋白的“query cover”均在99%以上、“identical”在97%以上;选择与DoUb1编码产物比对结果中“Max. score”最高的5个物种的多聚泛素蛋白序列进行同源分析,结果如图3所示,此基因的结构域非常保守,蓝色部分表示比对结果完全相同,粉红色部分和绿色部分表示比对结果部分同源,同源性极高,进一步证明克隆得到的基因为多聚泛素基因。

图2 DoUb1保守域预测
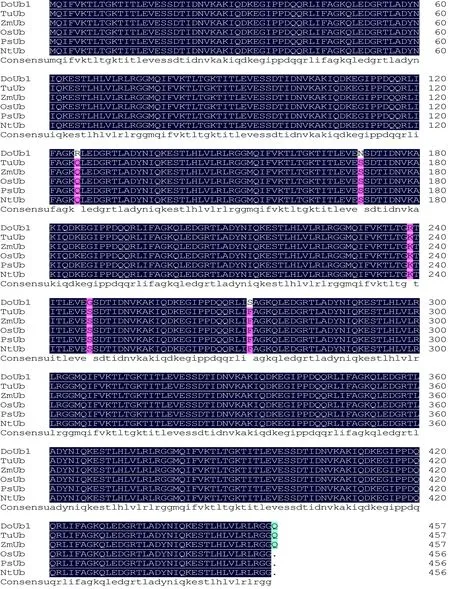
图3 不同物种氨基酸序列的多重比对
图中各条序列的accesion number为:TuUb (Triticumurartu, gi|474093556)、ZmUb (Zeamays, gi|413926513)、OsUb (Oryzasativa, gi|530684260)、PsUb (Pucciniastriiformis, gi|909605082)、NtUb (Nicotianatomentosiformis, gi|697128365)
2.2DoUb1生物信息学分析结果
利用Protparam软件对DoUb1氨基酸序列进行理化性质分析,结果表明其分子质量为51 179.7 ku,分子式为C2250H3747N637O704S6,总原子数为7344,理论等电点pI为7.76,带负电荷的残基数为66、正电荷残基数为67。不稳定系数为27.92,表明该蛋白状态稳定。疏水性分析结果表明,其疏水性最大值为1.133,亲水峰最大值为-1.956,表明整个蛋白质表现出亲水性(图4)。利用Bibsonomy软件对DoUb1进行二级结构预测,二级结构中α螺旋(alpha helix)占43.54%,延伸链(extended strand)占15.97%,无规则卷曲(random coil)占40.48%。由此表明,α螺旋、无规则卷曲和延伸链是蛋白质二级结构的主要组成部分(图5)。
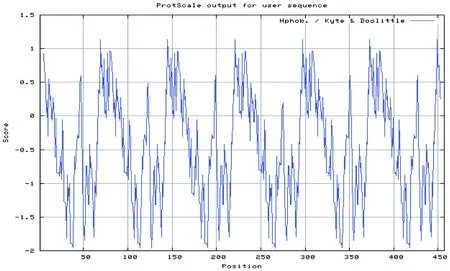
图4 DoUb1蛋白质的疏水性分析
蓝色:α螺旋;红色:延伸链;紫色:无规则卷曲
使用在线工具Psort (http://psort.hgc.jp/)对DoUb1进行亚细胞定位分析。结果显示,其主要定位于细胞质以及线粒体基质,概率分别0.45和0.36,说明该基因产物主要在细胞质或线粒体基质中发挥作用,可能主要参与高等植物细胞的信号转导,物质运输等。
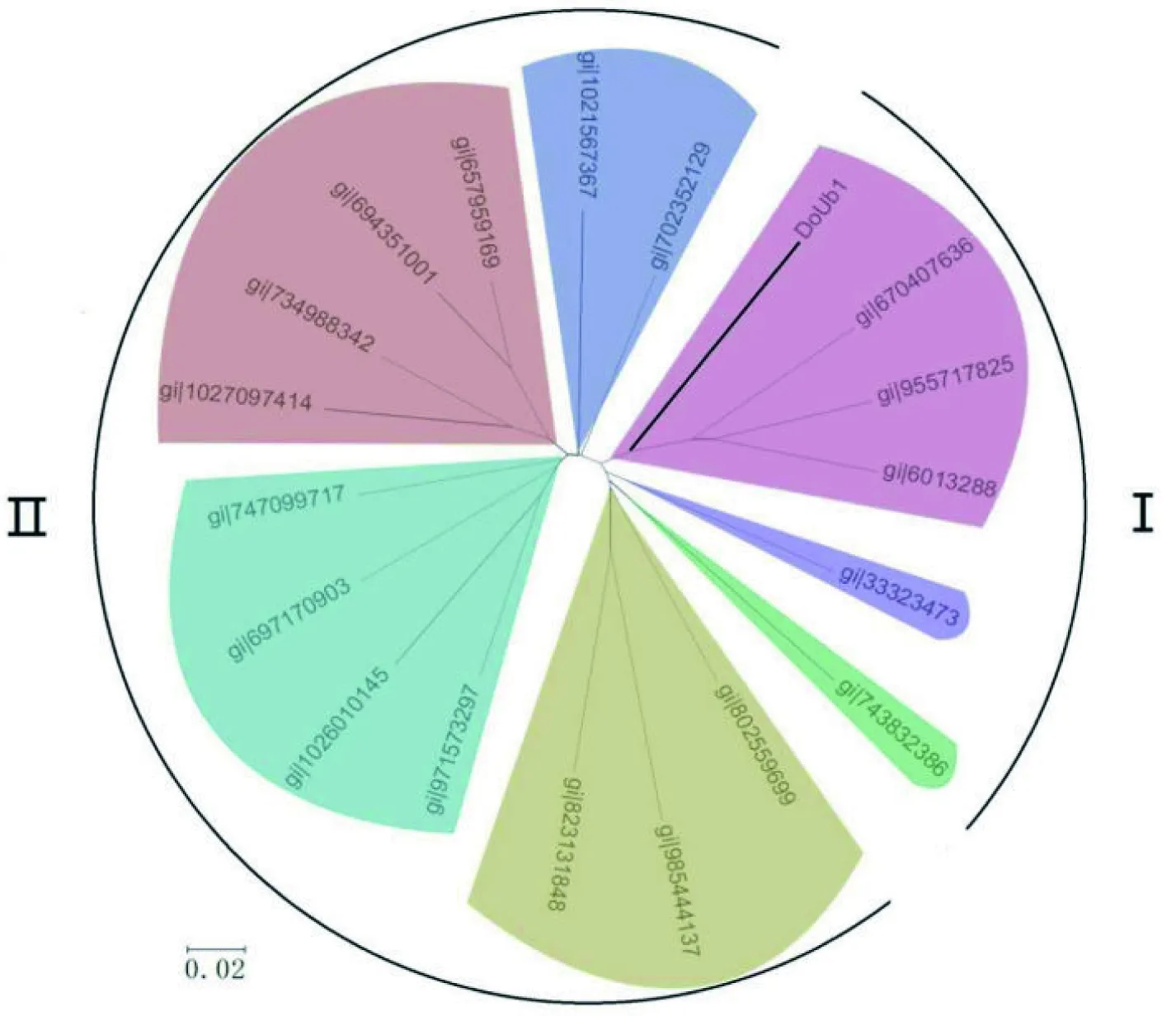
图6 不同物种多聚泛素基因核苷酸序列系统发育树
图中各条序列的基因号所对应的物种名称为:gi|955717825(Setariaitalica);gi|6013288(Oryzasativa)、gi|747099717(Sesamumindicum)、gi|1027097414(Prunusmume)、gi|702352129(Eucalyptusgrandis)、gi|670407636(Zeamays)、gi|743832386(Elaeisguineensis)、gi|971573297(Solanumtuberosum)、gi|734988342(Prunuspersica)、gi|694426526(Pyrus)、gi|802559699(Jatrophacurcas)、gi|1026010145(Capsicumannuum)、gi|657959169(Malus)、gi|697170903(Nicotiana)、gi|1021567367(Arachisipaensis)、gi|985444137(Citrussinensis)、gi|33323473(Musaacuminate)、gi|823131848(Gossypiumraimondii)
利用MEGA6构建铁皮石斛DoUb1与其他物种多聚泛素基因的进化树,结果如图6所示。其中Ⅰ类为单子叶植物,Ⅱ类为双子叶植物。DoUb1与水稻、玉米及谷子的多聚泛素基因聚为一簇,并与另2个植物多聚泛素基因(芭蕉、油棕)相邻,而这6个物种都为单子叶植物;蔷薇科双子叶植物海棠、梨、桃和梅花的多聚泛素基因聚为一支;自花授粉双子叶植物芝麻、烟草、辣椒和马铃薯的多聚泛素基因聚为一支。进化树分析结果与植物分类学特征具有较高的一致性。
2.3DoUb1在不同组织以及胁迫条件下的基因表达分析
以铁皮石斛Actin作为内参基因,进行荧光定量PCR的分析,结果如图7所示。DoUb1在铁皮石斛幼苗根和叶中表达量较高,而在茎中的表达量较少,约为根中表达量的一半(图7-A)。干旱初期基因表达量下降,到胁迫处理6 h,表达量降到最低,然后缓慢回升,表达量升高,说明泛素基因与铁皮石斛抗逆过程有关。由此可以推测,当细胞应激反应发生时,产生错误折叠的蛋白质,泛素可活化并标记它们以供降解(图7-B)。高温胁迫使得铁皮石斛泛素基因表达量逐渐降低,6 h表达量约为正常表达量的20%,达到最低值,而后又逐渐升高;而在低温胁迫下,DoUb1在胁迫初期表达量急剧下降,胁迫1 h时约为正常表达量的4%,在6 h和48 h有一个表达量的升高,但低温胁迫相比高温胁迫,DoUb1表达量更低。由此说明泛素基因在低温胁迫下的响应更为敏感(图7-C)。

图7 DoUb1在不同组织以及胁迫下的表达分析
A:不同组织DoUb1的表达水平;B:干旱胁迫下DoUb1的表达水平;C:温度胁迫下DoUb1的表达水平
3 讨论
植物在自然环境中通常会遭遇多种逆境胁迫的侵袭,即综合逆境胁迫[15]。植物对于综合胁迫的响应不仅仅是对各种逆境反应的简单加和,还有某些特殊机制[16]。在植物生长过程中,温度胁迫和干旱胁迫是一种比较普遍的逆境,而且会对植物造成比较大的伤害[17]。泛素可以提高植物对胁迫抗性的作用[18]。泛素蛋白酶体系统在细胞内会参与众多的调节过程,不仅在植物的正常生长发育过程中起作用,而且在温度、干旱以及疾病等生物和非生物胁迫中也发挥了重要作用[19]。在铁皮石斛中,通过对DoUb1的表达进行分析,不同的胁迫条件下,泛素所对应的机制不同,其表达量也有所变化。Ubiquitin能够共价结合到底物蛋白上,对底物蛋白进行翻译后的修饰[20]。通常情况下,逆境胁迫下生物细胞内无功能蛋白质或错误蛋白质的积累增多,而及时清除这些无功能或错误蛋白质成为生物适应逆境的重要方式[21]。在铁皮石斛中,泛素基因的表达与植物抗逆性有关,在干旱以及温度胁迫下,表达都会发生上调或下调的变化。泛素蛋白酶体系统,不仅是植物中蛋白高效专一降解最精致的调控机制之一,也是整个真核生物蛋白高效专一降解最重要的调控机制之一[22]。
非生物胁迫下,首先在泛素活化酶(ubiquitin-activating enzyme E1)的催化作用下获得活性,再经过酶以及一系列中间底物的催化过程,将其连接到靶蛋白上,最终完成错误折叠蛋白质的降解过程[23]。许多刺激和细胞内上游信号事件可诱导蛋白质泛素化,泛素化在生物体内复杂得多,主要是泛素与其他蛋白质相互作用有较大的表面积,泛素能形成不同链的事实进一步增大了其复杂性[24]。DoUb1为6个泛素分子形成的多聚泛素,其空间构象与单泛素分子明显不同,造成了其与底物蛋白分子不同的结合方式。泛素为难于标记的靶点提供了一个切入点[25]。
多聚泛素基因能在分生组织、微管组织和衰老组织中被热激和创伤等诱导胁迫下表达,其表达产物主要参与泛素蛋白酶体途径中的蛋白质水解过程[26]。胁迫条件下,多聚泛素被激活以提供自由泛素,并且细胞优先降解蛋白质[27]。DoUb1在非生物胁迫下,表达量降低,可能是胁迫条件下对泛素基因的表达水平产生了一定影响,胁迫后期表达量慢慢回升,说明其对胁迫反应的调整性及适应性,在蛋白质降解过程中发挥积极作用。
[1]GOLDSTEIN G, SCHEID M, HAMMERLIN U, et al. Isolation of a polypeptide thathaslym-phocyte-differentiation properties and is probably represented universally in living cells[J]. Proc Natl Acad Sci USA, 1975, 72(1): 11-15.
[2]彭世清,陈守才.巴西橡胶树polybiquitin基因5调控序列的克隆及分析[J]. 农业生物技术学报,2002,10(1): 56-59.
[3]黄新敏,张艳霞,万小荣. 泛素蛋白的研究进展[J]. 广东农业科学,2010,37(6): 191-194, 197.
[4]彭世清,陈守才. 植物的遍在蛋白系统[J].热带农业科学,2001(4):49-54.
[5]强承魁,凤舞剑,王胜永,等. 拟南芥泛素家族的全基因组分析[J]. 基因组学与应用生物学,2010,29(5): 969-975.
[6]FU D, ZHANG Y, YU Z. Cloning and expression analysis of a ubiquitin gene (Ub L40 ) in the haemocytes ofCrassostreahongkongensisunder bacterial challenge[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(1): 80-86.
[7]金伟军,姚祥春,吕美巧,等. 泛素-蛋白酶体系统的结构、作用和调控机制[J]. 科技通报,2008,24(1): 29-34.
[8]兰秋艳,高 媛,李衍常,等. 泛素、泛素链和蛋白质泛素化研究进展[J]. 生物工程学报,2016,32(1): 14-30.
[9]YAN L, WANG X, LIU H, et al. The genome of dendrobium officinale illuminates the biology of the important traditional Chinese orchid herb[J]. Molecular Plant, 2015, 8(6): 922-934.
[10]邢朝斌,龙月红,何 闪,等. 刺五加法尼基焦磷酸合酶基因的克隆、生物信息学及表达分析[J]. 中国中药杂志,2012,37(12): 1725-1730.
[11]贾培义,董 丽,王彦杰,等. 牡丹泛素延伸蛋白基因片段的克隆及序列分析[J]. 生物技术,2010,20(4): 1-3.
[12]韩俊英,李 健,李吉涛,等. 脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析[J]. 水产学报,2011,35(8): 1130-1138.
[13]蔡振锋,平军娇,张 珍,等. 千里光泛素(Ubiquitin)基因生物信息学与功能分析[J]. 生物技术通报,2012(10): 163-167.
[14]何 欣,叶 伟,高晓霞,等. 白木香倍半萜合成酶As-SesTPS1基因的克隆、生物信息学和表达分析[J]. 中草药,2015,46(5): 733-739.
[15]王 维,张玉娟,陈 洁,等. 植物逆境胁迫相关miRNA研究进展[J]. 生物技术通报,2015,31(1): 1-10.
[16]REGOLI F, WINSTON G W. Quantification of total oxidant scavenging capacity of antioxidants for peroxynitrite peroxyl radicals and hydroxyl radicals[J]. Toxicol Appl Pharm, 1999, 156(2): 96-105.
[17]KNIGHT H, KNIGHT M R. Abiotic stress signalling pathways:specificity and cross-talk[J]. Trends in Plant Science, 2001, 6(6):262-267.
[18]FAGGIANO S, ALFANO C, PASTORE A. The missing links to link ubiquitin: Methods for the enzymatic production of polyubiquitin chains[J]. Analytical Biochemistry, 2016, 492: 82-90.
[19]黄海杰,陈雄庭. 植物泛素/26S蛋白酶体途径研究进展[J]. 中国生物工程杂志,2008,28(7): 127-132.
[20]卢 亮,李 栋,贺福初. 蛋白质泛素化修饰的生物信息学研究进展[J]. 遗传,2013,35(1): 17-26.
[21]李泽琴,李静晓,张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J]. 遗传,2013, 35(1): 45-54.
[22]MURATANI M, TANSEY W P. How the ubiquitin-proteasome system controls transcription[J]. Nat Rev Mol Cell Biol, 2003, 4(3): 192-201.
[23]倪晓光,赵 平. 泛素-蛋白酶体途径的组成和功能[J]. 生理科学进展,2006,37(3): 255-258.
[24]YANG W L, ZHANG X, LIN H K. Emerging role of Lys-63 ubiquitination in protein kinase and phosphatase activation and cancer development[J]. Oncogene, 2010, 29(32): 4493-4503.
[25]NATUNEN T, TAKALO M, KEMPPAINEN S, et al. Relationship between ubiquilin-1 and BACE1 in human Alzheimer′s disease and APdE9 transgenic mouse brain and cell-based models[J]. Neurobiology of Disease, 2016, 85: 187-205.
[26]WANG J S, MALDONADO M A.The ubiquitin-proteasome system and its role in inflammatory and autoimmune disease[J]. Cellular and Molecular Immunology, 2006,3(4): 255-261.
[27]陈 科,程汉华,周荣家. 自噬与泛素化蛋白降解途径的分子机制及其功能[J]. 遗传,2012,34(1): 5-18.
Cloning and expression analysis of aPolyubiquitingene (DoUb1) in theDendrobiumofficinaleKimuraetMigo
PEI Wei, LIANG Yi, FAN Jing, AN Hong-qiang, WANG Wan-jun
(College of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China)
Polyubiquitin1 (DoUb1) inDendrobiumofficinaleKimuraetMigo was achieved by RACE (rapid amplification of cDNA ends).DoUb1 contained 1985 bp nucleotides with a putative open reading frame encoding 457 amino acid residues. The predicted molecular weight and theoretical isoelectric point of pI were 51 179.7 ku and 7.76 respectively. Subcellular localization analysis showed that gene product played a major role in the cytoplasm or the mitochondrial matrix. Phylogenetic analysis showed that theDoUb1 has the closest relativon with monocotyledonous plants such asZeamays,SetariaitalicaandOryzasativa. Results of real-time quantitative PCR (RT-qPCR) showed that the expression ofDoUb1 was higher in roots and leaves than in stems;DoUb1 was down-regulated during drought stress and temperature stress, the expression level was reduced in the early stage of stresses and then slowly increased. For drought stress, and the expression level was at the lowest after PEG treatment for 6 h; for temperature stress, it had similar responsive characteristics to drought stress, but in the low temperature stress, the expression ofDoUb1 was lower than in high temperature stress. These results showed that the gene was more sensitive to low temperature stress.
RACE;DendrobiumofficinaleKimuraetMigo;Polyubiquitin; RT-qPCR
2016-06-15;
2016-07-13
国家自然科学基金项目(31371232)
裴 薇,硕士研究生,主要从事植物发育生物学研究,E-mail: 1141217319@qq.com
王万军,教授,主要从事植物发育生物学研究,E-mail: wanjunwang@home.swjtu.edu.cn
Q785;Q786
A
2095-1736(2017)03-0006-05
doi∶10.3969/j.issn.2095-1736.2017.03.006
