恒河猴miR-125a-3p慢病毒载体的构建、鉴定以及功能研究
2017-07-18刘雅琳耿盼盼解裕萍乔洪图孙茂盛李鸿钧
刘雅琳, 周 艳, 耿盼盼, 解裕萍, 乔洪图, 孙茂盛, 李鸿钧
(中国医学科学院 北京协和医学院 医学生物学研究所云南省重大传染病疫苗研发重点实验室, 昆明 650118)
恒河猴miR-125a-3p慢病毒载体的构建、鉴定以及功能研究
刘雅琳, 周 艳, 耿盼盼, 解裕萍, 乔洪图, 孙茂盛, 李鸿钧
(中国医学科学院 北京协和医学院 医学生物学研究所云南省重大传染病疫苗研发重点实验室, 昆明 650118)
构建携带miR-125a-3p过表达与抑制表达shRNA的慢病毒,研究miR-125a-3p对轮状病毒感染乳鼠导致的腹泻的影响,为进一步研究miR-125a-3p对轮状病毒增殖过程中的影响及探究其机制提供前期研究基础。设计miR-125a-3p前体序列及其反向互补序列,与慢病毒骨架质pLVshRNA-EGFP(2A)Puro载体进行酶切连接,构建过表达与抑制表达miR-125a-3p的慢病毒表达载体。利用HEK293Ta细胞包装慢病毒颗粒,测定病毒滴度后,将获得的miR-125a-3p过表达慢病毒颗粒感染MA104细胞和灌胃感染乳鼠,检测miR-125a-3p的表达。同时对乳鼠进行轮状病毒攻毒试验,观察腹泻情况。研究成功构建了过表达及抑制miR-125a-3p表达的慢病毒载体,获得高效的过表达及抑制miR-125a-3p的慢病毒颗粒,成功感染MA104细胞,以及在乳鼠小肠组织有表达。同时发现miR-125a-3p过表达慢病毒感染乳鼠后对轮状病毒引起的腹泻有明显的抑制作用。
miR-125a-3p;慢病毒;过表达载体;抑制表达载体;乳鼠
MicroRNA(miRNAs)是一类长度约为22个碱基的非编码小RNA,它们通过抑制翻译和导致mRNA降解两种方式在转录后水平调控真核生物三分之一以上基因的表达,参与了细胞的分化发育、增殖、凋亡和代谢等几乎所有生物过程[1-2]。目前有众多的研究表明,miRNA在个体发育、免疫应答、肿瘤等多种生命过程中均具有重要的功能。最近研究发现,宿主miRNA的表达模式可能通过病毒的感染而被改变,如HCV[3-4]、HIV-1[5]、EBV[6]等。这些变化反映了宿主miRNA有可能在宿主与病毒之间的相互作用中发挥一些重要的功能[7-8]。
miR-125a家族在多种病毒感染中均有发挥功能。其中,宿主可通过提高miR-125a表达水平,从而抑制HBV的增殖[9]。近期,课题组前期研究表明[10]宿主细胞MA104中的miR-125a-3p在轮状病毒感染后表达下调,可能与宿主与病毒间的相互作用相关。人轮状病毒[11](Human Rotavirus,HRV)是导致五岁以下婴幼儿严重腹泻的最重要病原体之一。到目前为止,对于轮状病毒与宿主细胞之间的相互作用研究较少,相关机制仍然不是十分清楚。
因此,本研究旨在通过构建过表达与抑制miR-125a-3p表达的慢病毒载体并转染 MA104 细胞,筛选稳定转染的细胞株,为将来研究miR-125a-3p对轮状病毒增殖中的影响打下前期研究基础。同时,针对miR-125a-3p在轮状病毒感染后表达下调这一现象,将miR-125a-3p过表达慢病毒感染乳鼠后,感染轮状病毒,观察乳鼠的腹泻情况,从而反映过表达miR-125a-3p对轮状病毒的感染是有一定抑制作用的。
1 材料和方法
1.1 材料
MA104细胞、HEK293Ta细胞均为本实验室保存,DMEM 高糖培养基(CORNING),Opti-MEM(Gibco),胎牛血清(Biological Industries),EndoFectin-Lenti转染试剂(广州复能基因有限公司), 限制性内切酶BamH I与EcoR I(TaKaRa公司),pLVshRNA-EGFP(2A)Puro载体(北京英茂盛业生物技术有限公司),RNA逆转录试剂盒(QIAGEN),Real-time PCR 试剂(QIAGEN),ICR乳鼠(购于中国医学科学院医学生物学研究所)。
1.2 方法
1.2.1 miR-125a-3p过表达与抑制表达慢病毒载体的构建
根据小RNA深度测序结果,从miRBase数据库查找miR-125a-3p的成熟序列,设计并合成针对恒河猴miR-125a-3p的成熟序列、反相互补序列以及空白对照序列(negative control NC)。
分别为miR-125a-3p(ACAGGTGAGGTTCTTGGGAGCC)、shRNAmiR-125a-3p(GGCTCCCAAGAACCTCACCTGT)和shRNAcontrol(CATCGACTAGCCACTTAGAC)。
通过BamH I和EcoR I酶将载体pLVshRNA-EGFP(2A)Puro以及3种DNA oligo进行双酶切,T4连接酶16℃过夜连接。利用感受态大肠杆菌DH5α进行连接产物的转化,涂布于含氨苄抗生素的LB固体培养基平板上,挑选其中的阳性单克隆菌落,经过测序和比对分析PCR鉴定阳性的克隆。分别将鉴定正确的重组过表达慢病毒质粒命名为pLV-miR-125a-3p,抑制表达慢病毒质粒命名为pLV-shRNAmiR-125a-3p,空白对照命名为pLV-shControl-EGFP。
1.2.2 慢病毒包装
将生长状态良好的HEK293Ta细胞经消化传至10 cm圆碟中,37℃,5%CO2细胞培养箱培养,待细胞融合度达70%~80%时,将生长液换成含10% 热灭活FBS的DMEM高糖培养基,简称包装2溶液;在转染试剂EndoFectin-Lenti的作用下,分别将构建好的重组慢病毒质粒pLV-miR-125a-3p、pLV-shRNAmiR-125a-3p、pLV-shControl-EGFP与慢病毒包装的辅助质粒PH1和PH2共转染HEK293Ta细胞,于细胞培养箱中孵育过夜。
第2天将培养基由包装2溶液更换为含1%双抗和5%热灭活FBS的DMEM高糖培养基,该培养基称包装3溶液;培养48 h后,收集含病毒颗粒的细胞培养液,经1000 r/min离心2 min去除细胞碎片,将获得的上清分装保存至-80℃;在细胞培养碟中补充包装3溶液后继续培养至72 h,与48 h病毒液相同处理,并在荧光显微镜下观察细胞中绿色荧光的表达情况。
1.2.3 慢病毒滴度测定以及浓缩纯化
采用Real-time PCR法检测慢病毒的滴度。HEK293Ta细胞传至24孔板中,于10倍梯度稀释病毒液,在细胞孔中加入100 μL稀释好的病毒液,放置于细胞培养箱中培养,4 d后抽提细胞总RNA,利用Thermo逆转录试剂盒将总RNA逆转录成cDNA,PCR扩增程序为25℃ 5 min,42℃ 60 min,70℃ 5 min。随后以稀释10倍的cDNA为模板Real time PCR检测EGFP表达情况,上游引物:5′-TGCTTCAGCCGCTACCC-3′,下游引物:5′-AGTTCACCTTGATGCCGTTC-3′。PCR扩增条件为:95℃预变性 3 min;95℃变性20 s,56℃退火20 s,72℃延伸20 s;82℃再延伸5 s,共45个循环。溶解曲线65℃~95℃,每一步增加0.5℃,保持5 s。
采用高速离心的方法进行慢病毒的浓缩纯化。将收集的慢病毒液在4℃条件下融化后,用0.44 μm滤器过滤。滤过的病毒液利用Beckman SW41转头于4℃条件下,26 000 r/min超速离心120 min后保留沉淀,每40 mL病毒加400 μL PBS溶解沉淀即为浓缩的病毒,将病毒液分装冻存于-80℃。
1.2.4 MA104细胞的感染与稳定转染株的筛选
胰酶消化MA104细胞,接种于6孔板中,37℃,5% CO2培养箱培养, 待细胞融合率达40%~50%时, 更换成含5 μg/mL ploybrene的MEM培养基,用重组过表达慢病毒和抑制表达慢病毒上清液和空白对照病毒上清液分别感染MA104细胞,细胞培养箱中培养过夜; 将培养液更换为含 5% FBS,1%双抗的DMEM高糖培养基,继续培养48 h后,于荧光显微镜下随机选取6个视野,来观察绿色荧光蛋白的表达。根据嘌呤霉素对MA104细胞最小致死浓度实验, 加入最适浓度为8 μg/mL嘌呤霉素的培养基进行筛选,将形成miR-125a-3p过表达和抑制表达的稳定转染细胞系。
1.2.5 实时荧光定量PCR检测miR-125a-3p在稳定转染细胞株MA104中的表达
将筛选到的miR-125a-3p过表达和抑制表达的细胞传代培养,Trizol裂解细胞提取总RNA。经纯度和浓度测定后,逆转录成cDNA后进行实时荧光定量PCR检测。再以稀释10倍的cDNA为模板,对miR-125a-3p和U6进行实时定量PCR检测。每个样品设置2个复孔, 以U6作为内参, 重复3次, 计算Ct平均值, 采用相对定量法进行定量分析。
1.2.6 慢病毒感染动物实验
浓缩纯化后病毒滴度约为2 × 108TU/mL,对5 d龄的ICR乳鼠进行慢病毒灌胃(150 μL/只),分成3组进行感染:实验组分别是浓缩的pLV-miR-125a-3p慢病毒液,对照组灌同等体积的PBS溶液,空白组不予任何干预。灌胃72 h后取小肠进行冷冻切片,在荧光显微镜下观察小肠组织中慢病毒的绿色荧光。然后分别对试验组和对照组乳鼠进行轮状病毒灌胃攻毒试验,轮状病毒滴度为107PFU,每只灌胃200 μL,观察并记录乳鼠的腹泻情况。
2 结果
2.1 过表达与抑制表达miR-125a-3p慢病毒载体的构建
以pLV-miR-125a-3p、pLV-shRNAmiR-125a-3p、pLV-shControl-EGFP以及空慢病毒载体为模板进行PCR,并经过琼脂糖电泳检测PCR产物的大小(图1)。
2.2 过表达与抑制表达miR-125a-3p慢病毒载体的鉴定
将筛选出来的阳性克隆菌落进行PCR鉴定,后进行测序分析,并与miR-125a-3p的成熟序列以及反相互补序列进行比对,未出现突变或缺失等异常,可见完全相匹配(图2)。测序结果也证明了miR-125a-3p过表达与抑制表达慢病毒载体构建成功。

图 1 构建相关载体PCR鉴定结果
1、2、3为以重组慢病毒载体为模版(1:pLV-miR-125a-3p,2:pLV-shRNAmiR-125a-3p,3: pLV-shControl-EGFP);4为以慢病毒空载体为模版;M为DL500 DNA Marker
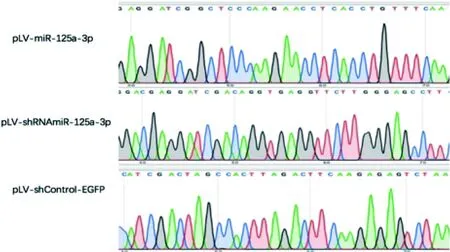
图 2 shRNA序列测定结果
2.3 过表达与抑制表达miR-125a-3p重组慢病毒的包装及滴度测定
重组慢病毒质粒转染HEK293Ta细胞48 h后,荧光显微镜下观察,pLV-miR-125a-3p组和pLV-shRNAmiR-125a-3p组的HEK293Ta细胞均可观察到绿色荧光的表达(图3),表明重组慢病毒质粒已成功转入HEK293Ta细胞中。将包装后收获的病毒进行滴度测定。结果显示,pLV-miR-125a-3p滴度为2×106TU/mL,pLVshRNAmiR-125a-3p滴度为3×106TU/mL,pLV-shControl-EGFP滴度为2× 106TU/mL(表1)。

表 1 实时定量PCR检测慢病毒滴度
2.4 筛选建立稳定过表达和抑制表达miR-125a-3p的MA104细胞系
重组慢病毒感染MA104细胞48 h后,荧光显微镜观察,pLV-miR-125a-3p组、pLV-shRNAmiR-125a-3p组及pLV-shControl-EGFP组,MA104细胞均可见绿色荧光表达(图4),且随时间的延长荧光数增多,未被慢病毒感染的细胞不表达绿色荧光蛋白,表明成功包装出具有感染活性的慢病毒粒。
A、B为pLV-miR-125a-3p质粒转染HEK293Ta细胞48 h后绿色荧光蛋白表达情况(A:明视野,B:暗视野);C、D为pLV-shRNAmiR-125a-3p质粒转染HEK293Ta细胞48 h后绿色荧光蛋白表达情况(C:明视野,D:暗视野);E、F为pLV-shControl-EGFP质粒转染HEK293Ta细胞48 h后绿色荧光蛋白表达情况(E:明视野;F:暗视野)本研究选取嘌呤霉素浓度为8 μg/mL作为筛选浓度,于细胞加入病毒液共培养后48 h,将培养基更换为含嘌呤霉素为8 μg/mL的5% FBS和1%双抗的DMEM高糖培养基。加入筛选培养基4 d后,待细胞基本不再死亡,对细胞进行传代,同时使用含嘌呤霉素的培养基加压筛选。因此认为,在本研究中,病毒转染和筛选效率均>80%。

图4 荧光显微镜观察包装后的重组慢病毒颗粒感染MA104细胞后的表达情况
A、B为pLV-miR-125a-3p慢病毒感染MA104细胞后绿色荧光蛋白表达情况(A:暗视野,B:明视野);C、D为pLV-shRNAmiR-125a-3p慢病毒感染MA104细胞后绿色荧光蛋白表达情况(C:暗视野,D:明视野)
2.5 实时荧光定量PCR检测慢病毒转染后细胞内miR-125a-3p的表达量
实时荧光定量PCR结果显示(图5),与空白对照组相比, pLV-miR-125a-3p的MA104细胞系中miR-125a-3p的表达水平上调70倍左右,表达量显著增加。pLV-shRNAmiR-125a-3p的MA104细胞系中miR-125a-3p的表达水平下调了10倍左右,表达量明显降低,组间比较差异有统计学意义。

图5 miRNA-125-3p过表达(A)和抑制表达(B)慢病毒载体转染MA104细胞后细胞内miRNA-125-3p的表达水平
2.6 慢病毒感染动物实验
灌胃72 h后,在乳鼠小肠组织中可见绿色荧光的表达(图6),说明包装pLV-miR-125a-3p慢病毒可以正常感染乳鼠。确定慢病毒感染成功后,分别对实验组,对照组以及空白组乳鼠感染轮状病毒,观察乳鼠腹泻情况。发现感染pLV-miR-125a-3p慢病毒的小鼠腹泻情况有明显的降低(图7)。

图6 荧光显微镜观察乳鼠小肠组织切片结果
A为感染pLV-miR-125a-3p慢病毒乳鼠小肠切片;B为PBS对照组乳鼠小肠切片
3 讨论
研究microRNA在生物学过程中的调控机制,通常需要通过在细胞中上调和下调其表达水平,来检测相应基因的mRNA或蛋白表达变化,从而观察miRNA对细胞生物学行为的影响。目前常用上调和下调microRNAs的方法主要有电穿孔法、阳离子聚合物法、慢病毒介导法等。其中,慢病毒介导法优点在于能够感染细胞范围广、可将外源基因整合到宿主染色体,实现稳定转染的特点,因此被作为研究基因功能及基因下调的有效工具[12-14]。MA104细胞属于比较难转染的非洲绿猴肾细胞,通过慢病毒介导的传递方法,可以将其携带的过表达和抑制miR-125a-3p的shRNA序列整合到宿主细胞的基因组中,随着宿主细胞的增殖不断扩增,使外源基因在宿主细胞中实现稳定持久的表达,筛选得到稳转细胞株[15]。

图7 观察感染轮状病毒后乳鼠的腹泻情况
A为PBS组感染轮状病毒乳鼠腹泻情况;B为感染pLV-miR-125a-3p慢病毒后感染轮状病毒乳鼠腹泻情况
本实验首先成功构建 pLV-miR-125a-3p、pLV-shRNAmiR-125a-3p慢病毒载体,并且利用 HEK293Ta 细胞包装产生具有一定感染活性的慢病毒颗粒。通过荧光显微镜来观察EGF绿色荧光蛋白表达情况来确定慢病毒的感染情况并大致判断感染效率,并且通过抗生素嘌呤霉素筛选稳定转染的MA104细胞系。RT-qPCR的结果显示,与对照组相比pLV-miR-125a-3p的miR-125a-3p的mRNA水平明显上调,pLV-shRNAmiR-125a-3p与对照组相比,miR-125a-3p的mRNA水平明显下调。
本研究中成功完成了pLV-miR-125a-3p、pLV-shRNAmiR-125a-3p慢病毒载体的包装和滴度测定以及纯化浓缩。同时,本试验进一步探索研究了miR-125a-3p与轮状病毒感染情况,预先对乳鼠感染携带过表达miR-125a-3p慢病毒pLV-miR-125a-3p后,再感染轮状病毒,观察乳鼠的腹泻情况。试验发现,感染pLV-miR-125a-3p慢病毒的乳鼠再感染轮状病毒后,腹泻情况明显减轻。由此我们推测miR-125a-3p可能对于轮状病毒的复制有一定的抑制作用。但是,由于靶基因调控的不确定性,一个靶基因可能受到多个miRNA的调控, 而miRNA也可能调节下游多个靶基因,要明确miR-125a-3p对轮状病毒增殖过程中具体机制及靶向信号通路还需要进一步深入研究。
[1]BARTEL D P. MicroRNAs: genomics,biogenesis,mechanism,and function[J]. Cell, 2004,116(2):281-297.
[2]YANG J S, PHILLIPS M D, BETEL D, et al. Widespread regulatory activity of vertebrate microRNA species[J]. RNA, 2011, 17(2):312-326.
[3]JOPLING C L, YI M, LANCASTER A M, et al. Modulation of hepatitis C virus RNA abundance by a liver-specific MicroRNA[J]. Science, 2005, 309(5740):1577-1581.
[4]MURAKAMI Y, ALY H H, TAJIMA A, et al. Regulation of the hepatitis C virus genome replication by miR-199a[J]. J Hepatol, 2009, 50(3):453-460.
[5]TRIBOULET R, MARI B, LIN Y L, et al. Suppression of microRNA-silencing pathway by HIV-1 during virus replication [J]. Science, 2007, 315(5818):1579-1582.
[6]PFEFFER S, ZAVOLAN M, GRSSER F A,et al. Identification of virus-encoded microRNAs[J]. Science, 2004, 304(5671):734-736.
[7]GOTTWEIN E, CULLEN B R. Viral and cellular microRNAs as determinants of viral pathogenesis and immunity[J]. Cell Host Microbe, 2008, 3(6):375-387.
[8]POWDRILL M H, DESROCHERS G F, SINGARAVELU R,et al. The role of microRNAs in metabolic interactions between viruses and their hosts[J]. Curr Opin Virol, 2016, 19:71-76.
[9]Potenza N, PAPA U, MOSCA N, et al. Human microRNA hsa-miR-125a-5p interferes with expression of hepatitis B virus surface antigen[J]. Nucleic Acids Res, 2011, 39(12):5157-5163.
[10]ZHOU Y, WU J, GENG P, et al. MicroRNA profile analysis of host cells before and after wild human rotavirus infection[J]. J Med Virol, 2016, 88(9):1497-1510.
[11]TATE J E, BURTON A H, BOSCHI-PINTO C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes:a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012, 12(2):136-141.
[12]BAYIN N S, MODREK A S, DIETRICH A, et al. Selective lentiviral gene delivery to CD133-expressing human glioblastoma stem cells[J]. PLoS One, 2014, 9(12):e116114.
[13]HUTSON T H, FOSTER E, MOON L D, et al. Lentiviral vector-mediated RNA silencing in the central nervous system[J]. Hum Gene Ther Methods, 2014, 25(1):14-32.
[14]CHEN F L, LIN P F, LI X, et al. Construction and expression of lentiviral vectors encoding recombinant mouse CREBZF in NIH 3T3 cells[J]. Plasmid, 2014, 76:24-31.
[15]NALDINI L, BLÖMER U, GALLAY P, et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector[J]. Science, 1996, 272(5259):263-267.
Construction,identification and function of recombinant lentivirus vector for rhesus miR-125a-3p
LIU Ya-lin, ZHOU Yan, GENG Pan-pan, XIE Yu-ping, QIAO Hong-tu, SUN Mao-sheng, LI Hong-jun
(Institute of Medical Biology, Chinese Academy of Medical Sciences, Peking Union Medical College, Yunnan Key Laboratory of Vaccine Research & Development on Severe Infectious Disease, Kunming 650118, China)
To construct miR-125a-3p overexpression and suppression lentivirus shRNA vectors for studying its effect to diarrhea of miR-125a-3p in mice,which laid a foundation of study miR-125a-3p to provide preliminary preparation for the impact of rotavirus proliferation process and to explore the molecular mechanism, the miR-125a-3p precursor sequence and miR-125a-3p reverse complement sequence were designed, and pLVshRNA-EGFP(2A)Puro vector was used to construct recombination lentivirus plasmid. The recombinant plasmid can generate the miR-125a-3p overexpression and suppression lentivirus vectors. Packaged lentivirus particle contained miR-125a-3p overexpression and suppression lentivirus by HEK293Ta. Virus titer was detected after infection of HEK293Ta. Finally we evaluated miR-125a-3p expression after that the virus infected MA104 cell and injected mice, and diarrhea of mice that was infected by rotavirus.It is successfully to construct the miRNA-125-3p overexpression and suppression lentivirus vectors. The recombinant virus successfully infected MA104 cells and mice small intestine. miR-125a-3p overexpression and suppression lentivirus vector were constructed successfully,which provide a stable cell transfection vector for further study of the impact and mechanism of miR-125a-3p to rotavirus and its host.We also found that the miR-125a-3p overexpression lentivirus vector can inhibitor the diarrhea,which was infected by rotavirus.
miR-125a-3p; lentivirus vector; overexpression vector; suppression vector; suckling mice
2016-09-29;
2016-10-26
十二五重大新药创制(2014ZX09102041004);中国医学科学院医学与健康科技创新工程项目(2016-I2M);云南省应用基础研究计划项目(2016FB034);云南省科技计划项目 (2014BC008)
刘雅琳,硕士,研究方向为生物化学与分子生物学相关研究,E-mail: 104421990@qq.com
李鸿钧,研究员,从事病毒疫苗研发、病毒与宿主相互关系及分子生物学相关研究,E-mail: lihj6912@163.com
Q78
A
2095-1736(2017)03-0001-05
doi∶10.3969/j.issn.2095-1736.2017.03.001
