不同温度对哺乳期大绒鼠持续能量摄入的影响
2017-07-18朱万龙蔡金红王政昆
朱万龙, 蔡金红, 王政昆
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室云南师范大学 生命科学学院, 昆明 650500)
不同温度对哺乳期大绒鼠持续能量摄入的影响
朱万龙, 蔡金红, 王政昆
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室云南师范大学 生命科学学院, 昆明 650500)
研究表明哺乳期小型哺乳动物的持续能量摄入(sustained energy intake)可能受到外周限制或者热散失限制。为了了解大绒鼠哺乳期持续能量摄入是受到哪种机制限制的,测定了不同温度条件下(5℃、25℃和30℃)大绒鼠的体重、静止代谢率、食物摄入量、胎仔数和胎仔重。结果表明:5℃驯化可以显著降低大绒鼠的体重,但是显著增加大绒鼠的静止代谢率和食物摄入量。3组动物的胎仔数差异不显著,但是胎仔重在5℃条件下显著低于25℃和30℃。以上结果说明哺乳期的大绒鼠低温条件下会增加食物摄入量来弥补能量支出的需要,而不能供给更多的能量给予其后代,支持外周限制假说。
大绒鼠;持续能量摄入;温度
小型哺乳动物的持续能量摄入对其生存至关重要,这主要是因为持续能量摄入是动物分布、生存和繁殖的可利用能量的上限[1]。已有研究表明持续能量摄入的高低是和能量需求器官密不可分的,即受到外周限制,如运动锻炼条件下肌肉的产热能力、冷驯化条件下褐色脂肪组织和肌肉的产热能力、哺乳期动物的乳腺分泌乳汁的能力等[2-3]。当然,也有研究表明动物持续能量摄入的高低是受到热散失的限制,即能量摄入的多少是受到热量散失的多少来决定的[4]。
哺乳期是小型哺乳动物能量需求最大的时期[5]。小型哺乳动物在低温暴露的条件下往往会增加产热来维持其体温恒定[6]。野外的小型哺乳动物也会经历在低温条件下哺乳,这样就提供了一个很好的模型(即哺乳和低温)来研究动物的最大持续能量摄入[7]。研究表明低温条件下的小鼠在哺乳期会增加食物摄入量,但是和常温组比较,胎仔重差异不显著[8]。相似的,低温条件下普通田鼠和布氏田鼠的繁殖输出和常温组比较,差异是不显著的[7, 9-10]。以上结果支持外周限制假说。但是,MF1小鼠在低温条件下较常温组并没有增加食物摄入量,但是繁殖输出增加,这一结果不支持外周限制假说[11]。MF1小鼠在30℃较8℃和21℃具有较低的食物摄入量和胎仔重[12]。此外,剃毛可以显著增加MF1小鼠的食物摄入量和胎仔重[4]。以上结果说明持续能量摄入的多少取决于热量散失的多少,支持热散失假说[13]。
静止代谢率(resting metabolic rate, RMR)的变化会影响小型哺乳动物的繁殖[14]。具有较高的RMR的动物个体消化吸收能量较强,因此可以在繁殖期贡献更多的能量[10]。RMR还受到低温的影响,动物在低温条件下往往会增加其RMR[15]。大绒鼠(Eothenomysmiletus)为中国特有种,主要分布于横断山区及其附近地区,为横断山区固有种。本研究对哺乳期大绒鼠不同温度条件下的持续能量摄入进行测定,为大绒鼠的生理生态学研究提供一些基础材料。
1 材料和方法
1.1 动物来源
实验所采用大绒鼠(Eothenomysmiletus)为人工饲养种群,置于透明塑料盒内(260 mm×160 mm×150 mm)饲养,单只饲养;每日喂以浸泡过的玉米,自由取水。挑选3~4个月大的成年雌性大绒鼠(n=60),与雄性大绒鼠配对2周,2周后将雄性移出。其中41只雌性怀孕,随机分为3组:5℃组(n=15)、25℃(n=15)组和30℃(n=11)组。大绒鼠分娩后先在25℃环境下饲养7 d,第7天将动物移入25℃组和30℃组。3组动物的幼仔在22 d断奶。
1.2 静止代谢率的测定
在第22天室内进行静止代谢率的测定,在呼吸室内静置30 min左右,进入呼吸室后适应30 min,静止代谢率的具体方法详见文献[16]。
1.3 体重和食物摄入量的测定
从第3天开始至第22天结束,每天测定大绒鼠的体重、胎仔数、胎仔重和食物摄入量,食物摄入量的具体方法详见文献[18]。
1.4 数据分析

2 结果
2.1 体重
在整个哺乳期期间,3组动物的体重均显著降低(5℃组:F=96.54,P<0.01; 25℃组:F=59.54,P<0.01; 30℃组:F=32.61,P<0.01;图1)。温度在哺乳期每天3组动物的体重差异不显著(P>0.05)。相反,大绒鼠体重的变化量在7 d后差异显著(P<0.05),18 d后差异极显著(P<0.05,图2)。
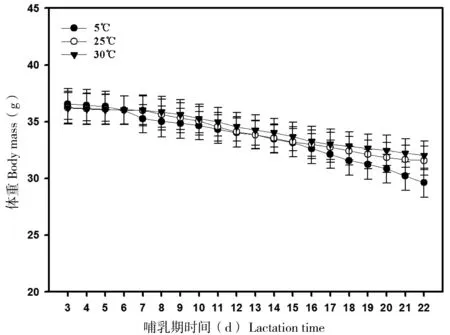
图1 不同温度条件下哺乳期大绒鼠的体重
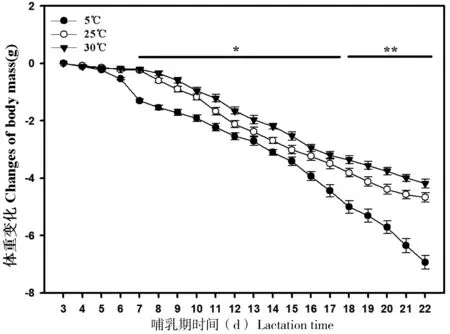
图2 不同温度条件下哺乳期大绒鼠的体重
*P<0.05; **P<0.01
2.2 食物摄入量
哺乳期第3天,3组大绒鼠体重差异不显著(P>0.05)。第8天至第9天,低温组大绒鼠的食物摄入量显著高于其它2组,第10天以后,低温组大绒鼠的食物摄入量极显著高于其它2组(P< 0.01,图3)。
2.3 胎仔数和胎仔重
哺乳第3天,3组动物的胎仔数差异不显著(P>0.05,图4)。3组动物在哺乳第22天后,胎仔数均出现了一定的降低,但是3组动物的胎仔数在整个哺乳期间差异不显著(P>0.05)。平均胎仔重在第3天,3组差异不显著(P>0.05, 图5);随着哺乳期的延长,3组动物幼仔的平均体重逐渐增加。到哺乳期20~22 d,低温组的平均胎仔重显著低于其它2组(F=3.23,P<0.05,图5),25℃组和30℃组平均胎仔重差异不显著(P>0.05)。3组总胎仔重差异极显著,其中低温组的总胎仔重显著低于其它2组(F=3.15,P<0.05,图6),25℃组和30℃组总胎仔重差异不显著(P>0.05)。

图3 不同温度条件下哺乳期大绒鼠食物摄入量的变化
*P<0.05; **P<0.01
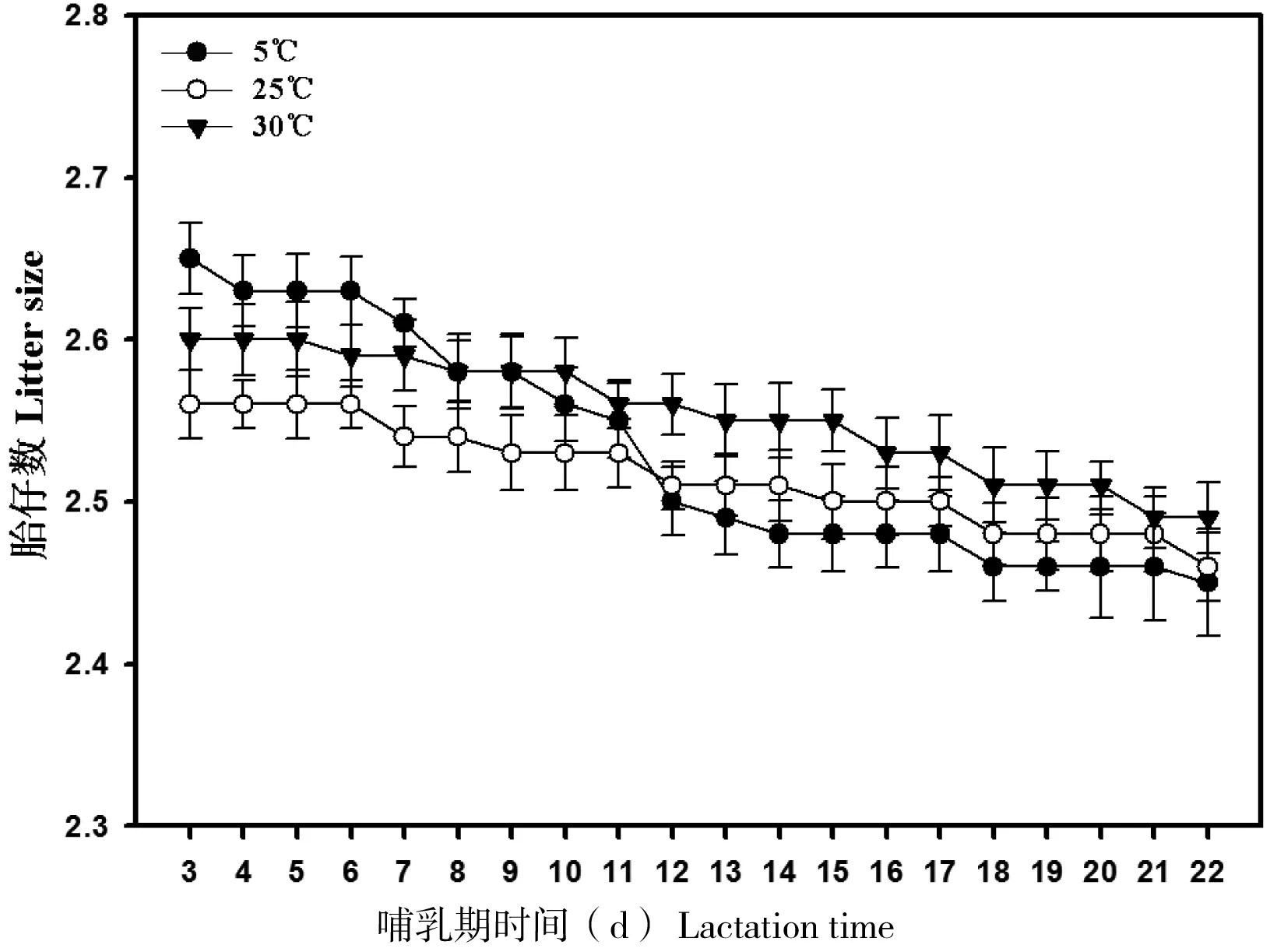
图4 不同温度条件下哺乳期大绒鼠胎仔数的变化
2.4 静止代谢率
低温组大绒鼠的静止代谢率显著高于其它2组(F=3.12,P<0.05, 图7),而25℃组和30℃组静止代谢率差异不显著(P>0.05)。
3 讨论
本研究结果表明哺乳期大绒鼠在5℃条件下体重显著降低,食物摄入量显著增加。5℃组较25℃和30℃组的平均胎仔重和总胎仔重均显著降低。而静止代谢率低温组较其它2组显著增加。

图5 不同温度条件下哺乳期大绒鼠平均胎仔重的变化
*P<0.05

图6 不同温度条件下哺乳期大绒鼠胎仔重的变化
*P<0.05

图7 不同温度条件下哺乳期大绒鼠静止代谢率的变化
*P<0.05
许多研究结果表明小型哺乳动物在哺乳期往往会增加能量需求[8, 15]。本研究的结果表明:3组大绒鼠母体的体重在哺乳期均显著降低,类似的结果在其他啮齿类中也有报道[7, 9]。然而,也有研究表明昆明小鼠在整个哺乳期体重维持稳定[18],MF1小鼠在哺乳期的体重甚至增加[19]。以上研究暗示在哺乳期不同的动物的体重变化模式具有种属特异性。瑞士小鼠和MF1小鼠的研究结果表明它们的持续能量摄入不受到消化道器官的限制,即不支持中央限制假说[18, 20],这两种鼠类可能通过其它途径来增加食物摄入,从而维持体重稳定或者体重增加。对于大绒鼠而言,哺乳期体重下降,可能是动用了体内脂肪含量,来维持高的能量需求,这就意味着增加食物摄入已经不能够弥补后代所需的能量,因此大绒鼠的持续能量摄入可能受到其他因素的影响,不支持中央限制假说。
哺乳期大绒鼠在5℃条件下的食物摄入量较其他2组显著增加,表明温度对于哺乳期大绒鼠的食物摄入有影响,相似的结果在瑞士小鼠[21]和MF1小鼠[10]中均有报道。在低温条件下,哺乳期的动物往往需要更多的能量用于繁殖,本研究结果表明5℃组的胎仔数和其它2组差异不显著,但是5℃组平均胎仔重和总胎仔重均显著低于其他2组。这可能是因为:在低温条件下母体的泌乳能力不能再上调,是受到限制的,支持外周限制假说。还有一个原因就是低温条件下产热增加,母体为了维持生存必须要消耗更多的能量去维持体温恒定,因此,投入到后代中相对较少,最终导致胎仔重较低。此外,25℃组和30℃组幼仔胎仔重差异不显著,这和热散失假说违背,因此本研究结果不支持热散失假说。
综上所述,哺乳期大绒鼠在低温条件下降低体重、增加食物摄入量和静止代谢率,降低胎仔重。而25℃组和30℃组以上指标均差异不显著。以上结果支持外周限制假说,不支持热散失假说。当然,由于本研究没有测定大绒鼠母体的泌乳量,是否在低温条件下母体的泌乳能力受到限制还有待进一步的研究。
[1]SPEAKMAN J R. The cost of living: field metabolic rates of small mammals[J]. Adv Ecol Res, 1999, 30(2): 177-297.
[2]SPEAKMAN J R. The energy cost of reproduction in small rodents[J]. Acta Theriol Sin, 2007, 27(1): 1-13.
[3]SPEAKMAN J R. The physiological cost of reproduction in small mammals[J]. Phil Trans Roy Soc, 2008, 363(1490): 375-398.
[4]KR L E, MURPHY M, SPEAKMAN J R. Limits to sustained energy intake. X. Effects of fur removal on reproductive performance in laboratory mice[J]. J Exp Biol, 2007, 210(Pt23): 4233-4243.
[5]JOHNSON M S, THOMSON S C, SPEAKMAN J R. Limits to sustained energy intake. I. Lactation in the laboratory mouseMusmusculus[J]. J Exp Biol, 2001, 204(Pt11): 1925-1935.
[6]BOZINOVIC F, BACIGALUPE L D, VSQUEZ R A, et al. Cost of living in free-ranging degus (Octodondegus): seasonal dynamics of energy expenditure[J]. Comp Biochem Physiol A Mol Integr Physiol, 2004, 137(3): 597-604.
[7]ZHANG X Y, WANG D H. Thermogenesis, food intake and serum leptin in cold-exposed lactating Brandt′s volesLasiopodomysbrandtii[J]. J Exp Biol, 2007, 210(Pt3): 512-521.
[8]HAMMOND K A, DIAMOND J. Maximum sustained energy budgets in humans and animals[J]. Nature, 1997, 386(6624): 457-462.
[9]ROGOWITZ G L. Limits to milk flow and energy allocation during lactation in the hispid cotton rat (Sigmodonhispidus) [J]. Physiol Zool, 1998, 71(3): 312-320.
[10]JOHNSON M S, SPEAKMAN J R. Limits to sustained energy intake. V. Effect of cold-exposure during lactation in Mus musculus[J]. J Exp Biol, 2001, 204(11): 1967-1977.
[11]KR L E, SPEAKMAN J R. Limits to sustained energy intake. VII. Milk energy output in laboratory mice at thermoneutrality[J]. J Exp Biol, 2003, 206(23): 4267-4281.
[12]KR L E, SPEAKMAN J R. Limits to sustained energy intake. VI. Energetics of lactation in laboratory mice at thermoneutrality[J]. J Exp Biol, 2003, 206(Pt23): 4255-4266.
[13]SPEAKMAN J R, KR L E. Maximal heat dissipation capacity and hyperthermia risk: neglected key factors in the ecology of endotherms[J]. J Anim Ecol, 2010, 79(4): 726-746.
[14]THOMPSON S D, NICOL M E. Basal metabolic rate and energetics of reproduction in therian mammals[J]. Nature, 1986, 321(6071): 690-693.
[15]DAAN S, MASMAN D, GROENEWOLD A. Avian basal metabolic rates their association with body composition and energy expenditure in nature[J]. Am J Physiol, 1990, 259(2): 333-340.
[16]ZHU W L, JIA T, LIAN X, et al. Evaporative water loss and energy metabolic in two small mammals, voles (Eothenomysmiletus) and mice (Apodemuschevrieri) in Hengduan mountains region[J]. Journal of Thermal Biology, 2008, 33(6): 324-331.
[17]ZHU W L, CAI J H, LIAN X, et al. Adaptive character of metabolism inEothenomysmiletusin Hengduan Mountains region during cold acclimation[J]. J Therm Biol, 2010, 35(8): 417-421.
[18]ZHAO Z J, CAO J. Effect of fur removal on the thermal conductance and energy budget in lactating Swiss mice[J]. J Exp Biol, 2009, 212(Pt16): 2541-2549.
[19]JOHNSON M S, THOMSON S C, SPEAKMAN J R. Limits to sustained energy intake. III. Effects of concurrent pregnancy and lactation inMusmusculus[J]. J Exp Biol, 2001, 204(11): 1947-1956.
[20]HAMMOND K A, LLOYD K C K, DIAMOND J. Is mammary output capacity limiting to lactational performance in mice[J]. J Exp Biol, 1996, 199(2): 337-349.
[21]HAMMOND K A, KONARZEWSKI M, TORRES R M, et al. Metabolic ceilings under a combination of peak energy demands[J]. Physiol Zool, 1994, 67(6): 1479-1506.
Effect of different temperature on sustainable energy intake inEothenomysmiletusduring lactation
ZHU Wan-long, CAI Jin-hong, WANG Zheng-kun
(Key Laboratory of Ecological Adaptive Evolution and Conservation on Animals-Plants in Southwest Mountain Ecosystem of Yunnan Province Higher Institutes College, School of Life Sciences, Yunnan Normal University, Kunming 650500, China)
Limits to SusEI during peak lactation may be imposed peripherally by the capacity of mammary glands to produce milk or may be driven by the ability of animals to dissipate body heat. To distinguish between the two mechanisms, body mass change, resting metabolic rate, food intake, litter size and mass were measured inEothenomysmiletuslactating at 5℃, 23℃ and 30℃. The results showed that femaleE.miletuslactating at 5℃ showed significantly lower change in body mass, but it had higher RMR and food intake than females at 23℃ and 30℃. No significant differences in litter size were observed between the three groups, however, litter mass at 5℃ was lower than litter mass at 23℃ and 30℃. These data suggested that females lactating at cold temperatures increased food intake to compensate for additional energy demands for thermogenesis, but they might not be capable of exporting more energy as milk to the pups, indicating a possible consistency with the peripheral hypothesis.
Eothenomysmiletus; sustainable energy intake; temperature
2016-03-03;
2016-03-08
国家自然科学基金项目(No. 31560126;31260097);云南师范大学博士科研启动项目
朱万龙,副教授,研究方向为动物生理生态,E-mail: zwl_8307@163.com
Q955
A
2095-1736(2017)03-0033-04
doi∶10.3969/j.issn.2095-1736.2017.03.033
