枸杞-粉葛酒与枸杞-野葛酒组分及抗氧化性的比较
2017-07-18褚冲牛美灿姚尚杰黄钧吴重德周荣清
褚冲,牛美灿,姚尚杰,黄钧,吴重德,周荣清,2*
(1.四川大学轻纺与食品学院,四川成都610065;2.四川大学制革清洁技术国家工程实验室,四川成都610065)
枸杞-粉葛酒与枸杞-野葛酒组分及抗氧化性的比较
褚冲1,牛美灿1,姚尚杰1,黄钧1,吴重德1,周荣清1,2*
(1.四川大学轻纺与食品学院,四川成都610065;2.四川大学制革清洁技术国家工程实验室,四川成都610065)
分别以粉葛、野葛为原料,酶水解为糖浆后加入枸杞浆液,研制出枸杞-粉葛酒、枸杞-野葛酒,并对二者的理化指标、风味特征以及抗氧化性进行比较分析。结果表明,枸杞-野葛酒的干浸出物、葛根素、总酚含量分别达到37.3 g/L、(7.11±0.12)mg/L、(1 685.3±3.3)mg/L,均高于枸杞-粉葛酒。两种酒中分别鉴定出56种、57种挥发性组分,主要包括醇类、酯类、酸类、醛类、酮类、酚类、呋喃类等,其中酯类、酸类、呋喃类组分含量差异显著(P<0.05)。枸杞-野葛酒中,脂肪酸乙酯含量高(815.72 g/L),己酸(287.84 g/L)、辛酸(2 492.86 g/L)、正癸酸(1 223.46 g/L)、十二烷酸(35.02 g/L)、2-乙酰基吡咯(5.59 g/L)含量较高,赋予枸杞-野葛酒木质芳香,酒香浓郁。枸杞-野葛酒对DPPH、ABTS清除率分别为(64.5±0.3)%、(85.9±1.0)%,其抗氧化性高于枸杞-粉葛酒。
粉葛;野葛;枸杞;枸杞-葛根酒;组分;抗氧化性
枸杞(Lycium barbarumL.)是茄科植物宁夏枸杞的干燥成熟果实。其众多有效成分之一的枸杞多糖(Lycium barbarumpolysaccharides,LBP)具有增强和调节免疫功能,抗肿瘤和抗衰老作用,另外,也具有有效地降血脂、降血糖作用,还具有耐缺氧、耐疲劳等多种保健功能和生理效应[1-2]。粉葛(PuerariathomsoniiBenth.)和野葛(PuerarialobataOhwi.)(也称葛根)分别为豆科植物及的干燥根[3];两者都是药食同源植物,不仅含有大量淀粉[4],也富含维生素和铁、钙、硒、锌、锗、磷、钾等多种人体所必需的微量元素,还含有葛根素、大豆苷元、大豆苷等总黄酮类活性物质,具有调节血液循环系统、增强体质、改善缺血性心肌代谢、抗心律失常等功效,有很大的开发与利用价值[5]。粉葛中的淀粉含量要大于野葛,而野葛的葛根素含量是粉葛的2~8倍,大豆苷元含量相当,淀粉和葛根素、总黄酮等功效组分含量的不同使得野葛与粉葛在实际应用中不能盲目混用和同等应用[3,6]。
亚健康已成为现代生活与工作的隐忧,相关人群不断攀升。随着国家对保健酒良好操作规范(goodmanufacturing practice,GMP)认证的实施,具有抗疲劳和增强免疫力功能的保健酒,正成为酒业的第四势力,具有广阔的市场前景[7]。基于传统酿造工艺开发的发酵型保健酒生产技术,因能有效保留原料中的活性组分、调节人体机能、维持正常生理功能已引起人们的广泛关注。目前,枸杞在保健酒的开发中多以浸泡方式为主,而以枸杞为原料酿造的保健酒一般具有枸杞的典型风味特征,但也存在产品风味单薄的限制,需要作进一步的改良[8];利用单一的粉葛或野葛作为原料酿造的保健酒,也普遍存在入口苦涩,酒体不协调的现象,品质受到限制[9]。原料的复合发酵能较好的将不同原料的优势整合,降低单一原料液态酿造的局限性,枸杞、野葛分别与其他原料酿造保健酒已有相关报道,如枸杞-山楂营养保健酒[2]、香菇猴头菇-枸杞保健酒[7]、黑糯米-葛根酒[10]。目前,在枸杞酒的液态发酵初期酿酒酵母需要消耗大量糖来维持生长代谢,因枸杞中糖含量低必需添加蔗糖以确保一定的起始总糖浓度。粉葛、野葛中主要成分为淀粉,是较好的糖化液来源,利用糖化液为酿酒酵母提供生长来源,同时也能赋予复合保健酒特有的风味和一定的抗氧化性。粉葛或野葛与枸杞作为原料液态发酵酿造出不同风格的复合保健酒目前还鲜有报道。
本研究利用枸杞分别与粉葛、野葛为原料,在最佳工艺基础上酿造出保健酒,并对其理化指标、风味特征、功能组分(枸杞多糖、葛根素、总黄酮和总酚)及抗氧化性进行比较与分析。研究结果可有益于认识酿造过程对功能组分含量变化的影响,也能对基于多种原料开发保健酒的技术有所借鉴。
1 材料与方法
1.1 材料与试剂
葡萄酒酵母(Saccharomyces uvarum)CICC 31551:中国工业微生物菌种保藏管理中心;枸杞、粉葛、野葛、蔗糖:市售;辛酸甲酯、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、没食子酸:美国Sigma-Aldrich公司;葛根素(纯度99%)、芦丁(纯度99%):中国国家标准物质标准样品信息中心;果胶酶(酶活210000U/g):诺维信(中国)生物技术有限公司;液化酶(酶活126000U/g)、糖化酶(酶活240000U/g):千禾味业股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1901型双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;CRA10C-150型板框过滤机:上海信步科技有限公司;Trace GC Ultra DSQ II气-质联用仪(gas chromatography-mass spectrometry,GC-MS):美国Thermo Fisher Scientific公司;HP-INNOWAX毛细管色谱柱:美国J&W公司;50/30 μm DVB/CAR/PDMS固相微萃取头:美国Supelco公司;1260型高效液相色谱仪:美国Agilent公司。
1.3 实验方法
1.3.1 工艺流程

1.3.2 操作要点
相同质量的粉葛、野葛分别粉碎过40目筛,参考野葛糖化工艺[11]使其均在糖化最佳工艺条件下经液化、糖化及灭酶处理得粉葛糖浆和野葛糖浆。
枸杞按料液比1∶10(g∶mL)加入到两种糖浆中,85℃条件下浸泡30 min,打浆,分别按比例2∶10 000(g∶mL)、21∶10 000(g∶mL)、53∶100 000(g∶mL)加入果胶酶、柠檬酸、维生素C,37℃条件下保温1 h,冷却至室温按比例3∶100 000(g∶mL)加入亚硫酸氢钠,加入蔗糖调整起始发酵总糖质量浓度均为150 g/L;接种葡萄酒酵母悬浮液,使得起始酵母浓度为106CFU/mL,于12~16℃条件下发酵,待其总糖含量<10 g/L时,分别按比例1∶10(mL∶mL)、1∶10(g∶mL)补加葡萄酒酵母悬浊液、蔗糖,当发酵至总糖含量<10 g/L时,停止发酵,板框压滤、灭菌分别得枸杞-粉葛酒、枸杞-野葛酒。
1.3.3 理化指标测定
理化指标:总糖、总酸、酒精度、干浸出物测定方法采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》;葛根素含量测定参考药典[3];总黄酮含量测定参考文献[12];总酚含量(以没食子酸当量(gallic acid equivalent,GAE)表示)测定参考文献[13];枸杞多糖含量测定参考文献[14]。
挥发性组分:采用顶空固相微萃取气质联用(headspacesolidphase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)方法并略作修改[13]。取1 mL样品移至20 mL顶空瓶中,加入2 mL去离子水、过量氯化钠、10 μL辛酸甲酯(内标,0.25 μL/mL),60℃恒温水浴预平衡15 min,插入固相微萃取针头萃取30 min,取出于GC-MS进样口解吸3 min,进行挥发性组分分析。
GC-MS条件:程序升温,初始温度为40℃,保持5 min,以4℃/min升至100℃,再以6℃/min升至220℃并保持8min;进样口温度250℃;载气为高纯氦气(He),流速1 mL/min;连接口、离子源温度分别为250℃、230℃;电子电离(electron ionization,EI)源,电子能量为70 eV,质量扫描范围为35~400 amu。
采用保留指数(retentionindex,RI)方法[15]和美国国家标准技术研究所(nationalinstituteofstandardsandtechnology,NIST)2005标准谱库定性分析,当且仅当匹配度>800(最大值为1 000)的鉴定结果才予以报道;采用峰面积归一化法和内标(辛酸甲酯)作半定量分析。
1.3.4 抗氧化性比较
以DPPH、ABTS自由基清除能力来表征果酒抗氧化性,方法参考文献并略作修改[13]。
DPPH自由基清除能力的测定:取20 mg的DPPH溶于50 mL乙醇中,用蒸馏水定容至100 mL,配制成DPPH储备液;再用体积分数50%乙醇溶液稀释,使得OD515nm为0.75~0.80,配制成DPPH工作液,现配先用。1mL稀释酒样与9mL DPPH工作液均匀混合,室温下避光反应30 min,在波长515 nm条件下测定样品吸光度值As;1 mL体积分数50%乙醇与9 mL DPPH空白试剂的吸光度值Ac。以体积分数50%乙醇作空白对照,DPPH自由基清除率计算公式如下:
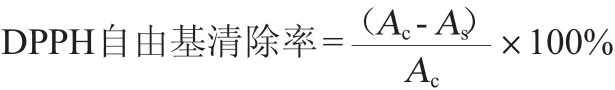
ABTS自由基清除能力的测定:将7 mmol/LABTS溶液与4.9 mmol/L过硫酸钾溶液等体积混合均匀,室温下避光放置12~16 h,配制成ABTS+储备液,用体积分数50%乙醇稀释,使得OD734nm为0.75~0.80,制成ABTS+工作液,现配先用。1 mL稀释酒样与9 mL ABTS+工作液均匀混合,室温下避光反应6 min,在波长734 nm处测定吸光度值As;相同条件下1 mL体积分数50%乙醇与9 mL ABTS+空白试剂的吸光度值As。以体积分数50%乙醇作空白对照,ABTS自由基清除率计算公式如下:

1.3.5 数据处理
所有实验数据重复3次,利用Origin 8.5进行作图和统计,显著性分析采用SPSS 19.0独立样本t检验进行分析。
2 结果与分析
2.1 理化性质比较

表1 两种保健酒理化指标Table 1 Physiochemical indexes of two kinds of healthy wine
两种酒的理化指标检测结果见表1。由表1可知,枸杞-粉葛酒的总糖、总酸、酒精度含量(分别为9.5 g/L、7.0 g/L及11.7%vol),均显著高于枸杞-野葛酒总糖、总酸、酒精度含量(分别为8.2 g/L、5.9 g/L及10.8%vol)(P<0.05);而后者的干浸出物含量(37.3g/L)显著高于前者(34.3g/L)(P<0.05)。干浸出物含量主要来自糊精与蛋白质,与酿造原料有关[16];差异可能与粉葛、野葛组成成分不同有关,有待进一步的研究。发酵原料之一枸杞用量相当,枸杞多糖含量并无显著性差异(P>0.05);枸杞-野葛酒中葛根素含量为7.11mg/L,与孔庆新等[17]的研究结果基本一致,约为枸杞-粉葛酒的4倍。酚类物质主要来自酿造原料,与淀粉、多糖、蛋白质等交联形成复合物[18]。枸杞-野葛酒中总黄酮、总酚含量(分别为693.7 mg/L、1 685.3 mg/L)高于枸杞-粉葛酒的总黄酮、总酚含量(分别为510.9 mg/L、1 300.2 mg/L)。
2.2 挥发性组分比较
枸杞-粉葛酒与枸杞-野葛酒的气相色谱-质谱(GC-MS)分析总离子图见图1,各组分分析鉴定结果见表2。由表2可知,两种酒中分别检出55种和56种组分,将这些组分归类为醇类、酯类、酸类、醛类、酮类、酚类、呋喃类;其中枸杞-野葛酒的酯类、酸类和呋喃类组分含量(分别为1 922.99 μg/L、4142.68μg/L和4.33μg/L)显著高于枸杞-粉葛酒的酯类、酸类和呋喃类组分含量(分别为1 545.70 μg/L、1 918.77 μg/L和2.86 μg/L)(P<0.05)。

图1 枸杞-粉葛酒(A)与枸杞-野葛酒(B)挥发性组分GC-MS分析总离子流色谱图Fig.1 Total ion chromatogram of volatile components in Goji-Pueraria thomsoniiwine(A)and Goji-Pueraria lobatawine(B)analysis by GC-MS
两种酒中各类别组分的相对含量比较结果见图2。由图2可知,枸杞-粉葛酒中醇类组分所占比例(46.0%)比枸杞-野葛酒的醇类组分(32.4%)高,而枸杞-野葛酒中酯类组分和酸类组分比例(分别为20.5%、44.1%)略高于枸杞-粉葛酒中酯类组分和酸类组分比例(分别为17.6%、32.3%),其他组分差异不显著(P>0.05)。
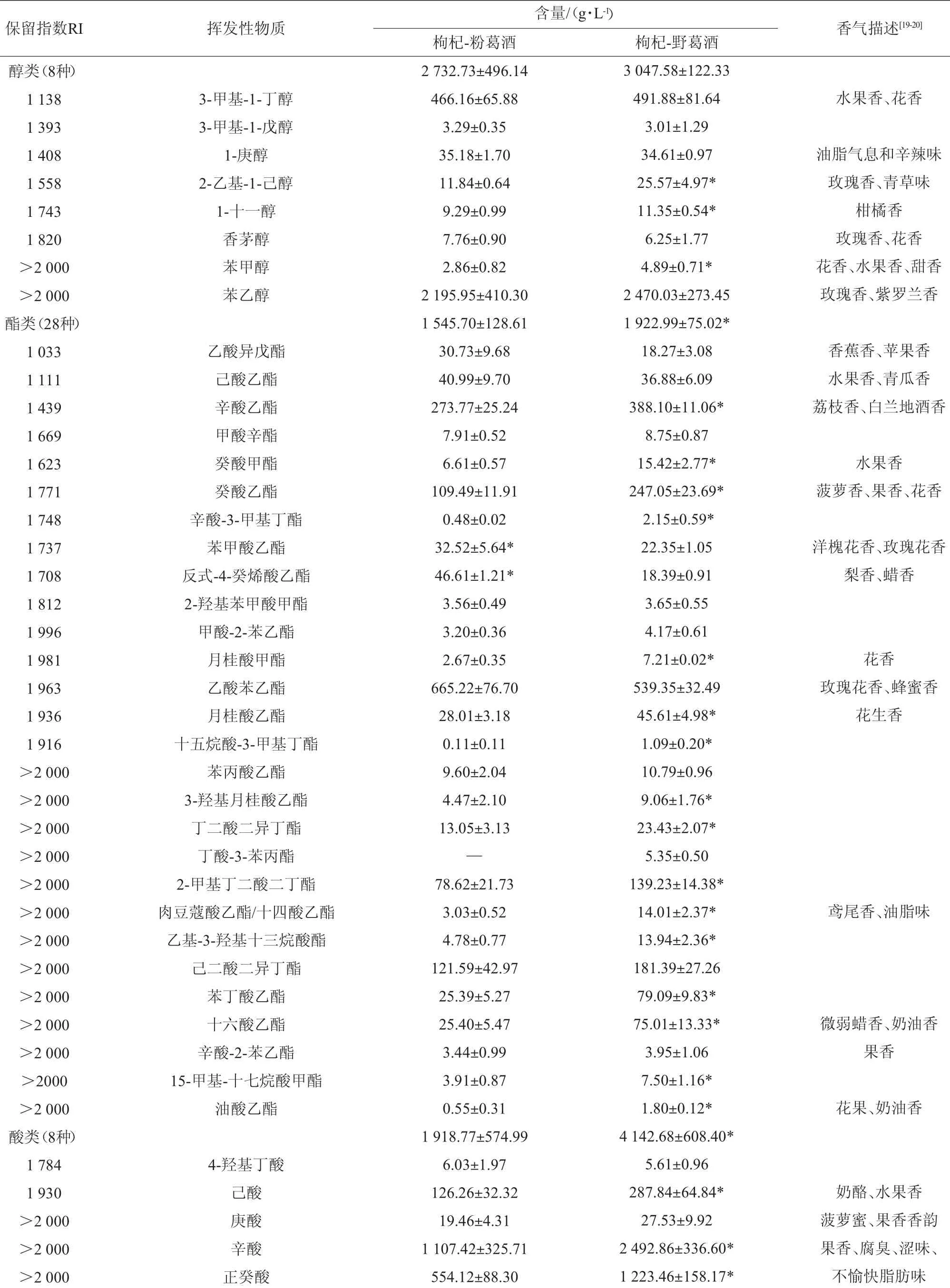
表2 两种酒样挥发性组分检测结果Table 2 Determination results of volatile components in two wines samples

续表

图2 两种酒样中挥发性组分含量比较Fig.2 Comparison of volatile components in two wines samples
高级醇是酵母在乙醇发酵过程中氨基酸或糖代谢的产物,是香气的主要来源,其含量与原料、发酵条件、醪液等有关[19]。发酵起始总糖均来源于蔗糖和糖化醪液,醇类组分总含量并无显著性差异(P>0.05)。在检出的8类醇类组分中,苯乙醇含量均最高;具有青草味的2-乙基-1-己醇在枸杞-野葛酒中含量较高。苯甲醇在枸杞-野葛酒中含量较枸杞-粉葛酒高70.98%,而1-十一醇则高22.17%;但香茅醇含量低19.46%。这些组分在赋予玫瑰香、柑橘香等愉悦香气上具有较大的贡献,保健酒中高级醇主要与原料中氨基酸的发酵有关。
枸杞-粉葛酒和枸杞-野葛酒中分别检出了27种、28种酯类组分。枸杞-野葛酒酯类含量略高于枸杞-粉葛酒,其中乙酸异戊酯等15种酯类组分大多表现为水果香味,大部分具有令人愉悦的香气。枸杞-野葛酒中辛酸乙酯(388.10μg/L)、癸酸甲酯(15.42 μg/L)、癸酸乙酯(247.05 μg/L)、月桂酸乙酯(45.61 μg/L)、2-甲基丁二酸二丁酯(139.23 μg/L)、肉豆蔻酸乙酯(14.01 μg/L)和油酸乙酯(1.80 μg/L)等组分含量较高;而枸杞-粉葛酒中苯甲酸乙酯(32.52 μg/L)、反式-4-癸烯酸乙酯(46.61 μg/L)的含量较高;只在枸杞-野葛酒中检出丁酸-3-苯丙酯(5.35 μg/L)。乙酸苯乙酯、辛酸乙酯、2-甲基丁二酸二丁酯、癸酸乙酯、十六酸乙酯是两者的优势组分。酸类组分生成的酰基辅酶A(coenzyme A,CoA)与乙醇在酯酶催化作用下发生酯化反应生成脂肪酸乙酯[20];相同发酵条件下,枸杞-野葛酒的脂肪酸乙酯组分含量(815.72 μg/L)高于枸杞-粉葛酒的脂肪酸乙酯组分含量(485.16 μg/L),如己酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、3-羟基月桂酸乙酯、肉豆蔻酸乙酯、十六酸乙酯。酒中酯类组分主要来自原料中的酯类和发酵过程中酵母菌代谢所形成的酯类[21]。丁酸-3-苯丙酯来源于野葛;酯类组分与初始发酵液也有关联,两者的糖化液糖含量不同,枸杞-粉葛酒和枸杞-野葛酒的酯类组分有显著差异(P<0.05)。
酸类组分含量差异显著,枸杞-野葛酒中己酸(287.84μg/L)、辛酸(2 492.86 μg/L)、正癸酸(1 223.46 μg/L)、十二烷酸(35.02 μg/L)等组分含量高于枸杞-粉葛酒,这些物质使得枸杞-野葛酒的风味木香醇厚,酒香更浓郁,酸类物质与乙醇结合生成酯类物质,对酒的风味起着积极作用;原料的不同使得大部分酸类物质含量差异显著。
两种酒中均检出4种醛类,癸醛和苯乙醛浓度适量使得酒香气融合、协调,对酒风味贡献很大[22],而枸杞-粉葛酒中带苦杏味的2,4-二甲基苯甲醛(28.91 μg/L)含量较高;酮类组分中,2-乙酰基吡咯是具有特殊木香的香味物质,枸杞-野葛酒中2-乙酰基吡咯(5.59 μg/L)较高,说明野葛中该物质含量较高,赋予核桃香味,枸杞-野葛酒的坚果风味明显、木质芳香;酚类组分中4-甲氧基苯酚含量差异显著。酒中醛类、酮类和酚类组分对风味具有加和作用。酿造原料来源不一,所含风味物质不同,发酵过程中酵母的代谢过程和速率也不完全一致,对应保健酒的风格迥异。
2.3 抗氧化性比较
两种酒对DPPH和ABTS自由基清除率结果见表3。由表3可知,枸杞-野葛酒的DPPH和ABTS自由基清除率(64.5%、85.9%)均大于枸杞-粉葛酒的DPPH和ABTS自由基清除率(62.3%、83.6%),这可能与野葛含有较高的葛根素、总黄酮等有关。抗氧化性主要与酚类有关,黄酮类含酚羟基化学结构也具有一定的抗氧化性[13],原料中酚类等具有抗氧化活性成分在发酵过程中逐渐溶于酒体中,使得枸杞-野葛酒抗氧化性高于枸杞-粉葛酒。

表3 两种保健酒抗氧化性比较Table 3 Comparison of the antioxidant activities in two kinds of healthy wine %
3 结论
枸杞-粉葛酒中总糖、总酸、酒精度含量要高,但干浸出物含量低于枸杞-野葛酒。利用顶空固相微萃取-气相质谱技术(HS-SPME-GC-MS)分析挥发性组分,枸杞-粉葛酒与枸杞-野葛酒中分别鉴定出55、56种挥发性组分,主要包括醇类、酯类、酸类、醛类、酮类、酚类、呋喃类等。枸杞-野葛酒中酯类及酸类组分所占比例要高,酯类、酸类、呋喃类组分含量差异显著。枸杞-野葛酒中脂肪酸含量要高,且较高含量的己酸、辛酸、正癸酸、十二烷酸、2-乙酰基吡咯赋予酒木质芳香、醇厚,酒香浓郁。枸杞-野葛酒中葛根素、总黄酮、总酚含量更高,且枸杞-野葛酒拥有更好的清除DPPH、ABTS自由基能力,其抗氧化能力更强,具有更好的保健功能。
[1]周耀明,杨猛.枸杞银杏保健酒的研发[J].食品研究与开发,2015,36(11):72-75.
[2]王广峰.枸杞、山楂营养保健酒的研制[J].中国酿造,2008,27(15):91-92.
[3]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:289-290.
[4]杜先锋,许时婴,王璋.葛根淀粉生产工艺的研究[J].中国粮油学报,1998,13(5):28-32.
[5]裴香萍,刘亚明,刘计权,等.野葛、粉葛与云南葛中葛根素、大豆苷、大豆苷元、染料木素的含量比较[J].中国药房,2012,23(47):4462-4464.
[6]王新胜,吴艳芳,张延萍,等.伏牛山区野葛与粉葛中葛根素和大豆苷元含量比较[J].中国医院药学杂志,2010,30(1):5-7.
[7]左蕾蕾,曾里,曾凡骏.香菇猴头菇枸杞保健酒的研制[J].食品研究与开发,2012,33(3):95-98.
[8]汤卫华,殷海松,吕春晖,等.枸杞酒发酵菌种的筛选及其香气分析[J].中国酿造,2014,33(4):68-71.
[9]周媛,李亮,潘智.葛根保健酒的研制[J].食品工业科技,2004,25(11):123-124.
[10]梁彬霞,赵文红,陈仕俏,等.黑糯米葛根酒的研制开发[J].酿酒,2008,35(3):74-76.
[11]褚冲,姚尚杰,黄钧,等.中心组合设计优化野葛糖化工艺[J].中国酿造,2016,35(9):145-149.
[12]王琳,张建文,王永泉,等.保健酒中总黄酮的含量测定[J].中国当代医药,2012,19(9):54,56.
[13]XU W,XIE K,ZHUANG H,et al.Volatile flavor compounds,total polyphenolic contents and antioxidant activities of a China gingko wine [J].Food Chem,2015,182:41-46.
[14]刘锐萍,籍保平,李博.三种澄清剂对枸杞酒澄清效果及其对枸杞多糖含量影响的研究[J].食品科学,2005,26(2):151-155.
[15]MAJDAK A,HERJAVEC S,ORLI S,et al.Comparison of wine aroma compounds produced bySaccharomyces paradoxusandSaccharomyces cerevisiaestrain[J].Food Technol Biotechn,2002,40(2):209-216.
[16]刘俊,徐岩,赵光鳌.黄酒非糖固形物成分的研究[J].中国酿造,2009,28(8):24-28.
[17]孔庆新,李思阳.葛根保健酒中葛根素的鉴别和含量测定[J].食品工业,2014(12):284-286.
[18]ZHAO H,DONG J,LU J,et al.Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley(Hordeum vulgareL.)[J].J Agr Food Chem,2006,54(19):7277-7286.
[19]于倩,蒋玉梅,李霁昕,等.霞多丽葡萄、苦水玫瑰及其混合发酵酒的香气比较分析[J].食品工业科技,2012,33(22):172-177.
[20]马腾臻,李颍,张莉,等.油橄榄酒的酿造及香气成分分析[J].食品科学,2014,35(18):161-166.
[21]齐晓琴,刘建花,李金鹏,等.贺兰山东麓马瑟兰干红葡萄酒香气成分的分析[J].中国酿造,2016,35(9):161-167.
[22]刘浩,刘晓杰,任贵兴.基于顶空固相微萃取-气质联用分析燕麦黄酒与藜麦黄酒的挥发性成分[J].食品工业科技,2015,36(4):61-66.
Comparison of components and antioxidant activity of Goji-Pueraria thomsoniiwine and Goji-Pueraria lobatawine
CHU Chong1,NIU Meican1,YAO Shangjie1,HUANG Jun1,WU Chongde1,ZHOU Rongqing1,2*
(1.College of Light Industry,Textile&Food,Sichuan University,Chengdu 610065,China; 2.National Engineering Laboratory for Clean Technology of Leather Production,Chengdu 610065,China)
In present study,usingPueraria thomsonii(PT)andPueraria lobata(PL)as material,saccharifiedPuerariasolutions were achieved,respectively,by enzyme hydrolysis,and then mixed with Goji pulp.Goji-PT wine and Goji-PL wine were developed according to wine fermentation process.The physiochemical properties,volatile components and antioxidant activities were analyzed on two types of wines.The results showed the dry extract contents,puerarin contents and total polyphenols were 37.3 g/L,(7.11±0.12)mg/L and(1 685.3±3.3)mg/L in Goji-PL wine,which were all higher than Goji-PT wine.56 and 57 kinds of volatile components were identified in two kinds of wines respectively,including alcohols,esters,acids, aldehydes,ketones,phenols and furans.The contents of esters,acids and furans showed significant difference(P<0.05).The contents of fatty acid ethyl ester(815.72 g/L),hexanoic acid(287.84 g/L),octanoic acid(2 492.86 g/L),decanoic acid(1 223.46 g/L),dodecanoic acid(35.02 g/L),2-acetylpyrrole(5.59 g/L)were higher,which ensured woody aroma and strong flavor in Goji-PL wine.The DPPH and ABTS free radical scavenging rate of the Goji-PL wine were(64.5±0.3)%and(85.9±1.0)%,respectively,which is higher than that in Goji-PT wine.
Pueraria thomsonii;Pueraria lobata;Goji;Goji-kudzu root wine;component;antioxidant activity
TS262.61
0254-5071(2017)06-0147-06
10.11882/j.issn.0254-5071.2017.06.030
2017-02-16
川大-泸州战略合作项目(2013CDLZ-S03)
褚冲(1991-),男,硕士研究生,研究方向为现代发酵技术。
*通讯作者:周荣清(1960-),男,教授,博士,研究方向为现代发酵技术和酶工程及其应用。
