晚期糖基化终末产物调控平滑肌细胞钙化的机制研究
2017-07-18何虎强孙晓磊王伟明胥雄飞何延政
何虎强,曾 宏,孙晓磊,张 雷,王伟明,胥雄飞,何延政,刘 勇
·论著·
晚期糖基化终末产物调控平滑肌细胞钙化的机制研究
何虎强,曾 宏,孙晓磊,张 雷,王伟明,胥雄飞,何延政,刘 勇*
目的 探讨晚期糖基化终末产物(AGEs)调控其受体促进人股动脉平滑肌细胞钙化的机制。方法 2014年1月—2015年3月,将股动脉中膜平滑肌层剪成1~2 mm组织块培养,选取3~8代平滑肌细胞用于实验。将平滑肌细胞分为4组,A组单纯于DMEM培养基中培养,B组于含10 mmol/L β磷酸甘油钠的DMEM培养基中培养,C、D组分别于含10 mmol/L β磷酸甘油钠的DMEM培养基中加入20、40 mg/L AGEs,各组平滑肌细胞干预培养96 h。合成3对随机AGEs受体(RAGE)siRNA,以50 nmol/L转染C组平滑肌细胞,24 h后进行siRNA沉默效果检测,选取转染效率较高的序列用于实验。分别取转染前后平滑肌细胞,采用Von Kossa染色实验观察平滑肌细胞内钙沉积情况,采用Western blotting法检测RAGE、β-catenin、骨保护素(OPG)表达水平。结果 未转染的平滑肌细胞中,A组无钙化斑块形成,B组可见明显的钙化斑块;C、D组细胞质、细胞核呈现粉红色的数量增加,钙化斑块明显增多。经转染后,C组平滑肌细胞细胞质、细胞核呈现粉红色的数量较未转染细胞减少,钙化斑块形成受到抑制。未转染的各组平滑肌细胞RAGE、β-catenin、OPG表达水平比较,差异均有统计学意义(P<0.05);其中,C组平滑肌细胞RAGE、β-catenin、OPG表达水平高于B组,D组平滑肌细胞RAGE、β-catenin、OPG表达水平高于B、C组(P<0.05)。C组平滑肌细胞转染后RAGE、β-catenin、OPG表达水平均低于转染前(P<0.01)。结论 AGEs通过与其受体结合而介导平滑肌细胞钙化,其机制可能为RAGE激活Wnt/β-catenin信号通路,使β-catenin下游蛋白OPG表达水平升高。
糖尿病;血管钙化;晚期糖基化终末产物;骨保护素
何虎强,曾宏,孙晓磊,等.晚期糖基化终末产物调控平滑肌细胞钙化的机制研究[J].中国全科医学,2017,20(20):2490-2494.[www.chinagp.net]
HE H Q,ZENG H,SUN X L,et al.Mechanism of action of advanced glycation end products in the regulation of smooth muscle cells calcification[J].Chinese General Practice,2017,20(20):2490-2494.
糖尿病(DM)是一种高度流行的代谢性疾病,其发病率在全球范围内呈上升趋势[1]。大血管和外周血管钙化是导致DM发生和患者死亡的主要原因[2]。DM患者体内晚期糖基化终末产物(AGEs)代谢增强,致使AGEs增多[3]。现已证明,人血管平滑肌细胞存在AGEs受体(RAGE),AGEs与RAGE结合,导致的变态反应和氧化应激,是诱发DM患者血管病变的主要原因之一[4]。AGEs通过与RAGE结合,改变细胞内信号表达,使内皮细胞功能发生紊乱,导致多种因子表达发生变化,从而刺激平滑肌细胞迁移、增殖,加快DM患者动脉粥样硬化进一步演变[5]。AGEs在诱导平滑肌细胞向成骨细胞转化,并促进血管钙化的发生过程中具有重要作用[6]。既往研究发现,AGEs诱导活性氧簇(ROS)的产生,并通过脱氢酶辅酶(NADPH)氧化酶促进平滑肌细胞凋亡的同时导致钙沉积。本研究通过对钙化培养的平滑肌细胞采用不同浓度的AGEs干预,并检测相关蛋白表达的差异,探讨AGEs调节动脉平滑肌细胞钙化的可能机制。
1 材料与方法
1.1 主要试剂 DMEM培养基、胎牛血清(美国HyClone公司),DAPI染液(美国Sigma公司),肌动蛋白α(α-SMA)单克隆抗体(美国Bioworld公司),羊抗兔异硫氰酸荧光素(FITC)标记二抗(武汉博士德生物工程有限公司),山羊封闭血清(北京博奥森生物技术有限公司),BCA蛋白定量试剂盒(武汉碧云天生物技术研究所),AGEs(日本Biovision公司),细胞钙离子测定试剂盒(上海杰美基因医药科技有限公司),一抗RAGE、β-catenin、骨保护素(OPG,美国Cell Signaling公司),二抗、上样缓冲液、一抗二抗稀释液(武汉碧云天生物技术研究所),RAGE siRNA(广州锐博生物科技有限公司)。
1.2 人股动脉平滑肌细胞培养与鉴定 2014年1月—2015年3月,取遗体捐献者股动脉(中山大学附属医院惠赠),无菌环境下手术刀片刮除外膜和内膜,将中膜平滑肌层剪成1~2 mm组织块。贴壁培养3周后,在倒置显微镜下观察,有平滑肌细胞从组织块周围爬出。4周时,平滑肌细胞呈典型的“峰谷状”生长。用含10%胎牛血清的DMEM培养基,在37 ℃,5%CO2培养箱中静置培养,随着传代次数的增多,平滑肌细胞生长周期逐渐缩短,5代以后维持在3~5 d,8代以后维持在1~2 d。选取3~8代平滑肌细胞,用DMEM培养液制成细胞悬液,接种于24孔板,完成下述实验。
1.3 实验分组 将平滑肌细胞分为4组,A组单纯于DMEM培养基中培养,B组于含10 mmol/L β磷酸甘油钠的DMEM培养基中培养,C、D组分别于含10 mmol/L β磷酸甘油钠的DMEM培养基中加入20、40 mg/L AGEs,各组细胞干预培养96 h。
1.4 RAGE siRNA转染 根据Gene Bank数据人工合成3对随机RAGE siRNA(广州锐博生物技术有限公司)。siRNA 1靶序列:CCTCTTTCCTGGAGTAAAT,正义链:5′-CCUCUUUCCUGGAGUAAAU dTdT-3′,反义链:5′-AUUUACUCCAGGAAAGAGG dTdT-3′;siRNA 2靶序列:GCACTAATATGTAACTTA,正义链:5′-GCACUAAUAUGUGAACUUA dTdT-3′,反义链:5′-UAAGUUCACAUAUUAGUGC dTdT-3′;siRNA 3靶序列:CACCGGAACCACTCAGTAA,正义链:5′-CACCGGAACCACUCAGUAA dTdT-3′,反义链:5′-UUACUGAGUGGUUCCGGUG dTdT-3′。转染前24 h将C组细胞以1×105个/孔铺于24孔板,使转染时密度能够达到80%。以lipofectamineTM2000转染siRNA于24孔板,转染浓度为50 nmol/L,按照试剂盒说明完成转染步骤。转染完成后24 h进行siRNA沉默效果检测,Cy3标记的RAGE siRNA模拟物转染平滑肌细胞8 h后换液,24 h后荧光显微镜下观察siRNA不同序列转染的细胞中Cy3标记的红色荧光表达量。通过筛选发现,siRNA 2的转染效率较高,Cy3红色荧光标记细胞阳性率接近100%(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章),选用该转染细胞用于实验。
1.5 Von Kossa染色实验 分别取转染前后细胞,采用Von Kossa染色实验(试剂盒购于上海杰美基因医药科技有限公司)观察细胞内钙沉积情况。6孔板中放入盖玻片,让细胞爬到盖玻片上;待细胞在盖玻片上融合度达90%时,用37 ℃磷酸盐缓冲液(PBS)洗3次;加入4%多聚甲醛溶液固定30 min,将固定的盖玻片依次加入100%、95%、80%梯度乙醇溶液后水洗;加入1%硝酸银溶液1 ml,日光照射30 min;移弃硝酸银溶液,加入1 ml 5%硫代硫酸钠溶液放置1 min;核固红复染后,用95%和无水乙醇逐级脱水两次;天然树脂胶封固,光镜观察。在光镜下,核固红复染后若有钙沉积,则细胞质、细胞核均呈现红色或淡粉色。
图1 siRNA 2转染后,荧光显微镜下可见Cy3红色荧光标记细胞阳性率接近100%(×10)
Figure 1 siRNA transfection,under the Fluorescence microscope,Cy3 in cell positive rate close to 100%,Shows that successful transfection
1.6 Western blotting法 分别取转染前后细胞,检测RAGE、β-catenin、OPG表达水平。应用总蛋白提取试剂盒提取细胞总蛋白,稀释一抗经10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳后转聚偏氟乙烯(PVDF)膜,将PVDF膜置于含5%脱脂奶粉的TBST缓冲液中摇床37 ℃,封闭1 h,PVDF膜浸泡于稀释好的一抗RAGE(1∶500)、β-catenin(1∶500)、OPG(1∶500)、GAPDH(1∶500)中,4 ℃孵育过夜;次日复温1 h,TBST缓冲液洗膜5 min,洗3次。二抗孵育后加入预先稀释好的辣根过氧化物酶(1∶3 000)标记,密封,室温孵育1 h,洗膜,TBST缓冲液漂洗5 min,洗3次;暗室中向蛋白条带加ECL发光液,使发光液与条带充分混匀,放入成像仪中拍照。采用Quantity one软件分析蛋白灰度值,以GAPDH作为内参,以目的蛋白吸光度值/GAPDH吸光度值×100%表示其相对表达水平。实验重复3次。

2 结果
2.1VonKossa染色实验 未转染的细胞中,A组无钙化斑块形成,B组可见明显的钙化斑块;C、D组细胞质、细胞核呈现粉红色的数量增加,钙化斑块明显增多(见图2)。经转染后,C组平滑肌细胞细胞质、细胞核呈现粉红色的数量较未转染细胞减少,钙化斑块形成受到抑制(见图3)。

图2 未经转染的各组平滑肌细胞Von Kossa染色实验结果
Figure2ExperimentalresultsofVonKossastainingofsmoothmusclecellsinnontransfectedgroups

图3 转染后的C组平滑肌细胞Von Kossa染色实验结果
Figure 3 Experimental results of Von Kossa staining of the smooth muscle cells of C group after transfection
2.2 未经转染的各组平滑肌细胞RAGE、β-catenin、OPG表达水平比较 未转染的各组平滑肌细胞RAGE、β-catenin、OPG表达水平比较,差异均有统计学意义(P<0.05);其中,C组平滑肌细胞RAGE、β-catenin、OPG表达水平高于B组,D组平滑肌细胞RAGE、β-catenin、OPG表达水平高于B、C组,差异均有统计学意义(P<0.05,见表1)。
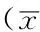
Table 1 Comparison of expression levels of RAGE,β-catenin,OPG among each group before RAGE siRNA interference

组别RAGEβ-cateninOPGB组0.141±0.0051.170±0.0390.269±0.017C组0.489±0.023a1.601±0.009a0.750±0.026aD组1.039±0.041ab1.839±0.082ab1.084±0.048abF值274.69241.176157.166P值<0.001<0.001<0.001
注:RAGE=晚期糖基化终末产物受体,OPG=骨保护素;与B组比较,aP<0.05;与C组比较,bP<0.05
2.3 C组平滑肌细胞转染前后RAGE、β-catenin、OPG表达水平比较 C组平滑肌细胞转染后RAGE、β-catenin、OPG表达水平均低于转染前,差异有统计学意义(P<0.01,见表2)。

Table 2 Comparison of expression levels of RAGE,β-catenin,OPG before and after RAGE siRNA interference in group C

RAGEsiRNARAGEβ-cateninOPG转染前1.419±0.0441.718±0.0382.327±0.037转染后0.810±0.0050.876±0.0281.147±0.019t值13.76017.66528.610P值<0.001<0.001<0.001
3 讨论
3.1 AGEs通过RAGE诱导平滑肌细胞钙化 AGEs是与DM患者血管病变和神经系统并发症相关的信号蛋白,对DM模型小鼠的研究证实,AGEs/RAGE在血管病变的发生及发展中具有重要作用[7]。RAGE作为当前研究最广泛且最成熟的AGEs受体,属于免疫球蛋白超家族成员,由细胞内区、跨膜区和细胞外区组成,其带有高度电荷的细胞内区与细胞内信号传导分子结合,在RAGE信号传导中起核心作用。RAGE可由多种细胞表达,生理条件下低表达,但在某些病理条件下则持续表达,且配体与RAGE表达之间存在正反馈调节机制,在血管系统AGEs配体增多的病变部位常伴随RAGE表达增加,这种正反馈调节诱导并增强RAGE与配体的致病作用。RAGE诱导巨噬细胞通过主动脉平滑肌细胞向成骨细胞分化,导致动脉粥样硬化性血管钙化[8]。YAMAGISHI等[9]研究发现,AGEs能诱导血管平滑肌细胞向成骨细胞转化,并促进血管钙化的发生。CECIL等[10]研究发现,Enpp1-/-小鼠在给予siRAGE或敲除RAGE后,动脉壁钙化明显受到抑制。多项研究也发现,AGEs能促进平滑肌细胞钙化,同时诱导Runx2 mRNA的表达,促进碱性磷酸酶(ALP)活性,提高降钙素水平;阻断RAGE后,能抑制AGEs诱导的血管平滑肌细胞钙化[11-12]。高血糖暴露及AGEs蓄积已被证明有助于DM的发生、发展[13]。AGEs具有诱导细胞分化的能力,从而促进血管钙化的动脉粥样硬化进程,激活的RAGE不仅抑制心肌素依赖的平滑肌细胞基因的表达,而且引起血管平滑肌细胞向成骨细胞分化,从而参与血管钙化[14]。
本研究发现,随着AGEs干预浓度的增加,平滑肌细胞内钙沉积数量增加,同时RAGE表达增强,表明AGEs诱导的平滑肌细胞钙化与RAGE表达有关。单纯钙化培养细胞RAGE表达减弱,进一步验证了AGEs通过与RAGE结合诱导平滑肌细胞钙化。给予RAGE siRNA沉默RAGE基因后,RAGE表达降低,反向证明了AGEs通过与其受体RAGE结合而促进平滑肌细胞钙化。
3.2 HSMCs钙化与Wnt/β-catenin信号通路的激活相关 AGEs-RAGE的相互作用决定了平滑肌细胞的增殖和活化可能与RAGE激活了某些信号通路相关。而Wnt/β-catenin信号通路通过对成骨细胞功能、分化的调节,在骨生长发育、骨量平衡、骨折愈合等过程中发挥举足轻重的作用,Wnt/β-catenin信号的激活促进了Runx2、OPG、OSX、骨形态发生蛋白(BMP)、cyclinD1、基质金属蛋白酶7(MMP-7)等与骨形成有关的蛋白表达。因此,Wnt/β-catenin信号通路被认为是骨形成过程中最关键的信号通路[15]。平滑肌细胞的钙化模型建立后,其细胞表型由收缩型转变为合成分泌型,并最终发展为成骨样细胞表型。KWAN等[16]认为,Wnt/β-catenin信号通路参与成骨细胞形成过程,并且β-catenin在成骨细胞线性分化中起到关键作用。有实验证明,Wnt/β-catenin信号通路参与了血管平滑肌细胞的钙化[17]。CHENG等[18]发现,当Wnt/β-catenin信号通路抑制后,可降低DM模型小鼠主动脉钙化,其下游与骨形成相关的蛋白Col1A1、Runx2、Nox1表达下降。本研究发现,RAGE的表达随着AGEs浓度的增加而增强,同时伴随AGEs浓度的增加,β-catenin的表达相应增加。进一步说明AGEs通过与RAGE结合后促进了人股动脉平滑肌细胞的钙化,同时可能激活了Wnt/β-catenin信号通路,促使下游蛋白β-catenin的表达增强。
OPG表达于成骨细胞和破骨细胞,是β-catenin下游信号蛋白,在骨的形成、发展中扮演重要角色[19]。本研究发现,随着AGEs浓度的增加,β-catenin及其下游蛋白OPG表达升高,提示Wnt/β-catenin信号通路在AGEs促进平滑肌细胞钙化中扮演了重要角色,初步提示可能是由于RAGE的介导作用引起;RAGE siRNA转染后,平滑肌细胞钙化明显受到抑制,同时,β-catenin及其下游蛋白OPG的表达均降低,进一步论证AGEs促进平滑肌细胞钙化可能是通过RAGE介导的Wnt/β-catenin信号通路完成。
近年研究发现,sRAGE作为RAGE的诱饵受体可以抑制AGEs与RAGE结合,从而防止动脉粥样硬化的形成和发展[20]。本研究选用RAGE siRNA干预细胞后,平滑肌细胞钙化受到抑制,RAGE、β-catenin及其下游蛋白OPG表达降低,说明siRNA对β-catenin及其下游蛋白有下调机制。
综上所述,AGEs通过与RAGE结合而介导平滑肌细胞钙化,其机制可能为RAGE激活Wnt/β-catenin信号通路,使β-catenin下游蛋白OPG表达水平升高。另外,本研究发现,单纯钙化培养的平滑肌细胞RAGE、OPG表达水平低于对照,推测钙化引起了平滑肌细胞的程序性死亡,导致细胞数目降低从而使其蛋白表达降低,这也为进一步研究钙化导致的平滑肌细胞凋亡的相关机制建立了基础。
作者贡献:刘勇进行文章的构思与设计,负责文章的质量控制及审校;何虎强进行研究的实施与可行性分析、数据收集,并撰写论文;曾宏进行数据整理;孙晓磊进行统计学处理;张雷进行结果的分析与解释;王伟明、胥雄飞进行论文的修订;何延政对文章整体负责,监督管理。
本文无利益冲突。
[1]HERMAN W H,ZIMMET P.Type 2 diabetes:an epidemic requiring global attention and urgent action[J].Diabetes Care,2012,35(5):943-944.DOI:10.2337/dc12-0298.
[2]CALCUTT N A,COOPER M E,KERN T S,et al.Therapies for hyperglycaemia-induced diabetic complications:from animal models to clinical trials[J].Nat Rev Drug Discov,2009,8(5):417-429.DOI:10.1038/nrd2476.
[3]NENNA A,SPADACCIO C,LUSINI M,et al.Basic and clinical research against advanced glycation end products(AGEs):new compounds to tackle cardiovascular disease and diabetic complications[J].Recent Adv Cardiovasc Drug Discov,2015,10(1):10-33.DOI:10.2174/1574890110666151104120039.
[4]CSISZAR A,UNGVARI Z.Endothelial dysfunction and vascular inflammation in type 2 diabetes:interaction of AGE/RAGE and TNF-alpha signaling[J].Am J Physiol Heart Circ Physiol,2008,295(2):H475-476.DOI:10.1152/ajpheart.00644.2008.
[5]JANDELEIT-DAHM K,WATSON A,SORO-PAAVONEN A.The AGE/RAGE axis in diabetes-accelerated athemsdemsis[J].Clin Exp Pharmacol Physiol,2008,35(3):329-334.DOI:10.1111/j.1440-1681.2007.04875.x.
[6]OTT C,JACOBS K,HAUCKE E,et al.Role of advanced glycation end products in cellular signaling[J].Redox Biol,2014,2:411-429.DOI:10.1016/j.redox.2013.12.016.
[7]WANG Z,JIANG Y,LIU N,et al.Advanced glycation end-product Nε-carboxymethyl-Lysine accelerates progression ofatherosclerotic calcification in diabetes[J].Atherosclerosis,2012,221(2):387-396.DOI:10.1016/j.atherosclerosis.2012.01.019.
[8]COUGHLAN M T,THORBURN D R,PENFOLD S A,et al.RAGE-induced cytosolic ROS promote mitochondrial superoxide generation in diabetes[J].J Am Soc Nephrol,2009,20(4):742-752.DOI:10.1681/ASN.2008050514.
[9]YAMAGISHI S,INAGAKI Y,OKAMOTO T,et al.Advanced glycation end product-induced apoptosis and overexpression of vascular endothelial growth factor and monocyte chemoattractant protein-1 in human-cultured mesangial cells[J].J Biol Chem,2002,277(23):20309-20315.DOI:10.1074/jbc.M202634200.
[10]CECIL D L,TERKELTAUB R A.Arterial calcification is driven by RAGE in Enpp1-/-mice[J].J Vasc Res,2011,48(3):227-235.DOI:10.1159/000318805.
[11]TANIKAWA T,OKADA Y,TANIKAWA R,et al.Advanced glycation end products induce calcification of vascular smooth muscle cells through RAGE/p38 MAPK[J].J Vasc Res,2009,46(6):572-580.DOI:10.1159/000226225.
[12]REN X,SHAO H,WEI Q,et al.Advanced glycation end-products enhance calcification in vascular smooth muscle cells[J].J Int Med Res,2009,37(3):847-854.
[13]YAMAGISHI S,MATSUI T,FUKAMI K.Role of receptor for advanced glycation end products(RAGE) and its ligands in cancer risk[J].Rejuvenation Res,2015,18(1):48-56.DOI:10.1089/rej.2014.1625.
[14]SUGA T,ISO T,SHIMIZU T,et al.Activation of receptor for advanced glycation end products induces osteogenic differentiation of vascular smooth muscle cells[J].J Atheroscler Thromb,2011,18(8):670-683.
[15]LI G,XU J,LI Z.Receptor for advanced glycation end products inhibits proliferation in osteoblast through suppression of Wnt,PI3K and ERK signaling[J].Biochem Biophys Res Commun,2012,423(4):684-686.DOI:10.1016/j.bbrc.2012.06.015.
[16]KWAN TAT S,AMIABLE N,PELLETIER J P,et al.Modulation of OPG,RANK and RANKL by human ehondrecytes and their implication during osteoarthritis[J].Rheumatology(Oxford),2009,48(12):1482-1490.DOI:10.1093/rheumatology/kep300.
[17]BEAZLEY K E,DEASEY S,LIMA F,et al.Transglutaminase 2-mediated activation of β-catenin signaling has a critical role in warfarin-induced vascular calcification[J].Arterioscler Thromb Vasc Biol,2012,32(1):123-130.DOI:10.1161/ATVBAHA.111.237834.
[18]CHENG S L,SHAO J S,HALSTEAD L R,et al.Activation of vascular smooth muscle parathyroid hormone receptor inhibits Wnt/beta-catenin signaling and aortic fibrosis in diabetic arteriosclerosis[J].Circ Res,2010,107(2):271-282.DOI:10.1161/CIRCRESAHA.110.219899.
[19]VAN TUYL L H,VOSKUYL A E,BOERS M,et al.Baseline RANKL:OPG ratio and marker of bone and cartilage degradation predict annual radiological progression over 11 years in rheumatoid arthritis[J].Ann Rheum Dis,2010,69(9):1623-1628.DOI:10.1136/ard.2009.121764.
[20]NENNA A,SPADACCIO C,LUSINI M,et al.Basic and clinical research against advanced glycation end products(AGEs):new compounds to tackle cardiovascular disease and diabetic complications[J].Recent Adv Cardiovasc Drug Discovery,2015,10(1):10-33.DOI:10.2174/1574890110666151104120039.
(本文编辑:吴立波)
Mechanism of Action of Advanced Glycation End Products in the Regulation of Smooth Muscle Cells Calcification
HEHu-qiang,ZENGHong,SUNXiao-lei,ZHANGLei,WANGWei-ming,XUXiong-fei,HEYan-zheng,LIUYong*
DepartmentofVascularSurgery,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China
*Correspondingauthor:LIUYong,Chiefphysician;E-mail:lyong74@163.com
Objective To investigate the mechanism of action of advanced glycation end products(AGEs) in regulating the receptor of AGEs(RAGE) for promoting calcification of human femoral arterial smooth muscle cells.Methods This study was carried out between January 2014 and March 2015.The tunica media of femoral artery was cut into tissue blocks of 1-2 mm in length for adherent culture.We selected the cultured smooth muscle cells of 3-8 generation for the experiment and divided them into 4 groups for further culture,group A with DMEM culture medium;group B using DMEM+10 mmol/L β-sodium phosphate;group C using DMEM+10 mmol/L β-sodium phosphate+AGEs 20 mg/L;and group D with DMEM+10 mmol/L β-sodium phosphate+AGEs 40 mg/L.Cells in each group were intervened for 96 hours.Three pairs of random RAGE siRNA were synthesized,and used to transfect the smooth muscle cells of group C with a concentration of 50 nmol/L.The efficacy of siRNA was measured 24 h later.The sequences with high transfection efficiency were selected for experiment.The calcium deposition in smooth muscle cells were observed by Von Kossa staining before and after RAGE-specific siRNA transfection.The expression levels of RAGE,β-catenin,and osteoprotegerin(OPG) were detected by Western blotting.Results In the non-transfected cells,there was no calcified plaque in group A,while group B showed obvious calcification plaques;in groups C and D,the number of cytoplasm and nucleus of the smooth muscle cells in red increased and calcified plaques increased significantly.After RAGE-specific siRNA transfection,the number of cytoplasm and nucleus of the smooth muscle cells in red in group C was decreased compared with that before transfection,and the formation of calcified plaque was inhibited.Before RAGE-specific siRNA transfection,the expression levels of RAGE,β-catenin,and OPG in smooth muscle cells differed significantly among the groups(P<0.05),specifically,the expression levels of RAGE,β-catenin,and OPG in smooth muscle cells were higher in group C than in group B,and they were higher in group D than in groups B and C(P<0.05).The expressions of RAGE,β-catenin,and OPG in smooth muscle cells in group C were lower after RAGE-specific siRNA transfection compared with those before transfection(P<0.01).Conclusion AGEs mediate smooth muscle cells calcification by regulating RAGE,the mechanism may be that RAGE activates the Wnt/ β-catenin signaling pathway and by which the expression level of β-catenin downstream protein OPG is increased.
Diabetes mellitus;Vascular calcification;Advanced glycation end products;Osteoprotegerin
国家自然科学基金面上项目(81270358)
R 587.1
A
10.3969/j.issn.1007-9572.2017.06.y03
2016-08-12;
2017-02-08)
646000四川省泸州市,西南医科大学附属医院血管外科
*通信作者:刘勇,主任医师;E-mail:lyong74@163.com
