糖尿病相关脑微血管病变研究进展
2017-07-13李媛曾克武王学美
李媛+曾克武+王学美

[摘要] 糖尿病是一种慢性代谢障碍性疾病,随着发病率的逐年增高,已成为人类健康的主要威胁之一。脑微血管病变是糖尿病的特征性病理改变,是糖尿病脑部慢性并发症的病理基础,主要见于阿尔茨海默症和腔隙性脑梗死患者,是导致糖尿病患者致死致残的主要原因之一。其致病机制复杂,涉及多元醇代谢异常、糖化反应亢进、氧化应激、β淀粉样蛋白跨血脑屏障的异常转运、蛋白激酶C激活等多个方面,以发病机制为靶点的治疗可能会为预防和延缓糖尿病脑微血管病变的发生发展带来新的希望。目前,对糖尿病脑微血管病变的机制、诊断和治疗方法的研究较为广泛,已成为医学研究的一大热点。该文拟对糖尿病诱发的脑微血管病变的发病机制,临床诊断与治疗策略方面的研究进行综述,以期为糖尿病脑微血管病变的预防和治疗提供新的思路。
[关键词] 糖尿病; 脑微血管病变; 发病机制; 诊断; 治疗方法
[Abstract] Diabetes mellitus, a kind of chronic metabolic disease, has become one of major threats to human health with an increasing incidence. As a basic pathology of chronic complications related to diabetes mellitus, cerebral microangiopathy is mainly found in patients with Alzheimer′s disease and lacunar infarction, and becomes one of the main reasons of death and disability in diabetic patients. The pathogenesis of cerebral microangiopathy is complicated, involving such signal pathways as metabolic abnormalities of polyol, saccharification hyperactivity, oxidative stress, abnormal transport of amyloid-β across blood-brain barrier and protein kinase C activation. Treatment targeting at related pathogenesis may bring a new hope to prevention and delay of the occurrence and development of cerebral microangiopathy of diabetes mellitus. Currently, pathogenesis, diagnosis and therapies for cerebral microangiopathy of diabetes mellitus have become hot topics in medical studies. This article reviews pathogenesis, clinical diagnosis and treatment for cerebral microangiopathy of diabetes mellitus, in order to provide new ideas for the prevention and treatment of cerebral microangiopathy of diabetes mellitus.
[Key words] diabetes mellitus; cerebral microangiopathy; pathogenesis; diagnosis; therapy
糖尿病是一组由胰岛素分泌绝对或相对不足引起的,以糖、脂肪和蛋白质等一系列营养物质代谢紊乱为特征的慢性代谢性障碍疾病。随着糖尿病的发病率逐年增高,已成为继癌症、心血管疾病后的第三大威胁人类健康的疾病。据世界卫生组织预计,到2025年,全球成人糖尿病患者人数将增至3亿,而我国糖尿病患者人数将超过4 000万。脑微血管和大血管病变是糖尿病常见的并发症。糖尿病大血管病变是指中等以上动脉的粥样硬化,主要有高血压、冠心病、脑血管病变和下肢血管病变。微血管是指微小动脉和微小静脉之间,管腔直径在100 μm以下的毛细血管网。微血管病变是糖尿病特有的慢性血管并发症,由于交换营养物质、代谢产物的需要,微血管内血液流速慢,与大血管相比,更易受到各种因素的影响,故病变出现较早,较广泛,为糖尿病各种并发症的发生基础[1-3],糖尿病对脑的损害研究主要集中在脑微血管病变上[4]。对有微血管并发症与大血管并发症的T2DM患者认知功能的比较则进一步显示T2DM并发微血管并发症患者的注意力、心理活动的灵活性、抽象概括能力、短时记忆以及瞬时记忆能力显著差于T2DM并发大血管并發症患者[5-6]。本文拟对近年来糖尿病诱发脑微血管病变的机制,临床诊断及治疗策略进行总结。
1 发病机制
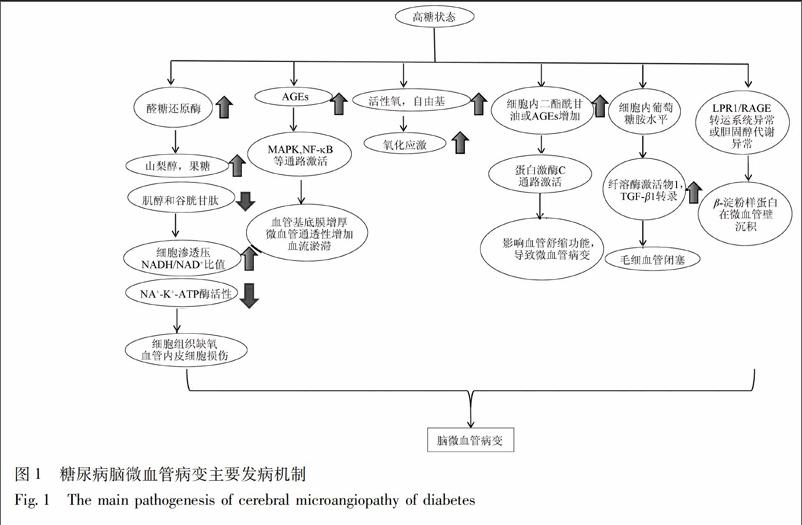
糖尿病脑微血管病变大多以微血管血流动力学异常为首发环节,逐渐导致微血管栓塞至闭塞[7]。目前普遍认为糖尿病脑微血管病变具有以下发病机制,见图1。
1.1 高血糖相关葡萄糖毒性产物的形成及影响
1.1.1 多元醇通路活跃 多元醇通路由一系列酶系统构成,其中醛糖还原酶(aldose reductase,AR)是多元醇通路的关键酶。AR催化葡萄糖转变为山梨醇,山梨醇在果糖还原酶的作用下转化为果糖。糖尿病患者体内血糖水平升高,导致AR活性增强,多元醇代谢通路激活,使细胞内山梨醇、果糖过度堆积,细胞内渗透压升高,细胞水肿,同时胞内肌醇和谷胱甘肽水平下降,NADH/NAD+比值增高,Na+-K+-ATP酶活性下降,细胞、组织缺氧,内皮细胞受损,促使脑微血管病变的发生[8]。研究发现多元醇通路在糖尿病患者毛细血管基底膜增厚病变中发挥着重要的作用, AR活性的变化可能导致糖尿病微血管疾病的发展[9]。
1.1.2 糖基化反应亢进 高血糖情况下,各种组织蛋白均可发生非酶糖基化反应,形成终末糖化产物(AGEs),AGEs与细胞膜上的AGE受体(RAGE)结合后,通过激活蛋白激酶(MAPK)及核因子(NF-κB)信号通路(细胞增殖与炎症)、Ras通路(应激和细胞凋亡)、Rac/Cdc通路(细胞生长和运动)以及Jak/Stat通路(基因表达调控)等,最终导致细胞外基质扩张、血管基底膜增厚、微血管通透性增加、血流淤滞、甚至微血管闭塞等糖尿病微血管病变[10-11]。在对培养人微血管内皮细胞的研究中发现,AGEs的加速形成和积累可以诱导多元醇通路的激活,引起AR在mRNA、蛋白水平上表达增多和在微血管内皮细胞的活性增加,最终导致糖尿病微血管功能障碍[12]。
1.1.3 氧化应激反应增强 高糖状态下,众多因素可促进氧化应激,如反应性活性氧、自由基增加,糖基化产物和糖氧化产物形成增加,抗氧化应激机制减弱等。高糖促使线粒体电子传递链产生过多的活性氧,抑制三磷酸甘油醛脱氢酶(GAPDH)活性,激活几乎所有已知的与糖尿病微血管并发症发生发展有关的信号传导通道,包括PKC通路,多元醇通路,己糖胺通路以及AGEs形成[13]。研究发现,以高膳食结合链脲佐菌素注射制作2型糖尿病(T2DM)模型大鼠的脑微血管和脑组织病理形态学改变明显,脑组织和血清中醛糖还原酶、O-·2活性显著高于正常对照组,超氧化物歧化酶活性显著低于正常对照组,表明T2DM鼠组织出现的病理变化与脑组织和血液中氧化物与抗氧化物异常改变有关,即高血糖引发的氧化应激增强在脑微血管病变中起重要作用[14]。与此结论相一致,另一研究发现糖尿病所致的氧化应激增强可使血管脂质沉着和发生炎症,大脑持续暴露于高浓度的自由基环境中可导致神经损伤甚至脑细胞死亡[15]。
1.1.4 蛋白激酶C(protein kinase C,PKC)信号通路激活 高血糖可使组织细胞内二酯酰甘油(DAG)增多,激活PKC;AGE与AGE受体(RAGE)相互作用可激活PKC[16];多元通路活跃使NADH /NAD+比值升高,有利于DAG形成从而激活PKC;氧化应激增加和游离脂肪酸增加均可导致PKC激活[13]。目前认为,PKC激活是糖尿病微血管损伤的共同通路。PKC激活进而影响血管舒缩功能、血管通透性,刺激血小板聚集,通过增加转化生长因子β1(TGF-β1)、纤维粘连素和Ⅳ型胶原的表达,增加微血管基质蛋白的积聚,引起微血管基底膜增厚[17]。
1.1.5 己糖胺途径激活 己糖胺通路(hexosamine biosynthesis pathway,HBP)是細胞糖代谢的途径之一。 正常情况下只有1%~3%的葡萄糖进入HBP,高糖状态下,己糖胺通路激活,导致细胞内葡萄糖胺水平增加,最终促进纤溶酶激活物1和TGF-β1的转录,从而造成毛细血管闭塞[18]。研究发现,在糖尿病状态下,高糖可以激活多种组织中的NF-κB,引起氧化应激损伤,而HBP是高糖活化NF-κB的途径之一[19]。
1.2 β淀粉样蛋白转运异常
β淀粉样蛋白(amyloid beta,Aβ)在脑微血管壁上沉积是诱发糖尿病脑微血管病的重要因素之一[20]。晚期糖基化终产物受体(RAGE)和低密度脂蛋白受体相关蛋白-1(Lrp-1)是分别介导脑组织内Aβ入、出脑的主要受体蛋白[21],既往研究显示,Lrp-1介导的转运清除障碍对糖尿病脑内Aβ1-40的沉积起着重要作用[22-23]。在采用链脲霉素诱导的糖尿病大鼠血脑屏障中,RAGE水平显著升高,并引起Aβ内流的增加[24]。
1.3 内皮细胞功能紊乱
内皮细胞能产生多种血管活性物质,如一氧化氮、前列环素和血管紧张素等,生理状态下,这些活性物质的分泌在人体内保持平衡,维持血管正常的收缩和舒张。当内皮功能异常,分泌的活性物质失衡时,就可能导致微血管功能异常。在体外培养条件下,观察高浓度葡萄糖对脑微血管内皮细胞活力和内皮素-1(ET-1)表达的影响,发现高浓度葡萄糖可使内皮细胞超微结构损伤,细胞活力降低,ET-1升高在糖尿病微血管病变早期可能起主要作用[25]。体内外研究显示,高糖可下调脑微血管内皮细胞一氧化氮合酶的表达,进而导致NO的分泌减少,从而诱发糖尿病脑微血管病变[26-27]。
1.4 脂质代谢紊乱
糖尿病患者常伴有血脂代谢异常,主要表现为高密度脂蛋白明显降低,总胆固醇、甘油三酯、极低密度脂蛋白、低密度脂蛋白明显升高。流行病学及体内外实验均表明,T2DM 状态下胆固醇代谢异常可以通过增加Aβ的生成,Aβ在脑微血管壁上沉积而损失脑微血管[28]。
1.5 血液流变性障碍
一方面,在高糖状态下,红细胞膜Na+-K+-ATP酶活性降低,胞内Na+增多,同时胞内多元醇通路激活,山梨醇积累,使得细胞内高渗,水分进入细胞,红细胞球形化[29]。另一方面,糖尿病患者的红细胞膜蛋白在长期高糖作用下,发生非酶糖基化,糖基化的膜蛋白与血管内皮细胞膜上的糖基化蛋白受体相互用,产生黏连,损害微血管功能,进而造成组织损害[30]。将病程长达1年的糖尿病大鼠红细胞分离出来后输给正常大鼠,发现输入的标记红细胞可黏附于正常大鼠脑微血管内皮细胞,并造成脑组织丙二醛和亚硝盐含量升高[31]。另外,糖尿病患者血管性血友病因子生成增多,血栓素A2及B2合成及释放均增多以及纤维蛋白溶解活力的降低,血小板的黏附性增强,易于发生血管痉挛、狭窄、血栓形成等[32-33]。研究表明,糖尿病微血管病的发生,发展与血小板聚集功能异常增高有关[34]。
1.6 其他
此外,研究发现许多细胞因子、生长因子、黏附分子、E选择素、高同型半胱氨酸血症等与糖尿病脑微血管病变的发生发展密切相关[35-37]。
2 临床诊断
糖尿病脑微血管病变是导致脑部各类并发症的病理基础,及早发现和诊断糖尿病脑微血管病变,对延缓疾病进程,延长寿命及提高患者生活质量具有重要意义。糖尿病微血管病变的诊断应首先在确诊有糖尿病的基础上,并排除其他可能因素所致的微血管病变相应表现的情况下进行诊断。
2.1 临床症状
前期症状主要包括头晕、头疼、记忆力减退、易疲乏、语言不流利。发作时可表现为头痛剧烈,或意识丧失,或有抽搐,肢体活动不利或偏瘫等[38]。
2.2 體征检查
采用CT、核磁共振(MRI)、数字减影血管造影(DSA)、经颅多普勒超声(TCD),正电子发射脑断层扫描(PET)、单光子发射断层扫描(SPECT)等对脑部进行检测。临床研究发现,糖尿病脑微血管并发症组颈内动脉颅外起始段(ICA)、大脑中动脉(MCA)的脉动指数(PI)显著高于无并发症组,表明ICA,MCA的PI值异常增高可作为糖尿病脑部微血管病变的一项指标[39]。
2.3 血清学检测
糖化血红蛋白(HbAlc)为目前已经公认的判断糖尿病控制症状的金标准,同时在对糖尿病患者微血管病变的早期诊断亦有重要价值[40]。此外,血清同型半胱氨酸(Hcy)水平的异常增高[41],血小板参数[42]等被认为是糖尿病微血管病变的重要指标。
3 治疗策略
3.1 血糖的监测和控制
血糖的过高或过低,或者血糖急性波动,均可影响糖尿病脑微血管病的恢复和预后[43]。研究表明,将血糖控制在正常水平,可显著降低糖尿病微血管并发症[44]。因而,建议采用运动、饮食控制或药物进行降糖,并对血糖水平进行定期监测。在中药方面,具有降血糖活性作用的单味药有人参、黄芪、山药、黄连、麦冬、知母等,就其中有效成分而论,主要集中在多糖、生物碱、皂苷、黄酮、萜类等[45]。
3.2 控制血脂
调节血脂紊乱,对于防治糖尿病脑微血管病变具有较好的效果[7]。目前用于纠正糖尿病微血管病变患者的脂质代谢紊乱的药物主要包括3类:3-羟-3甲戊二酰辅酶A还原酶(HMG-CoA还原酶)抑制剂(如辛伐他汀)、苯氧酸类(如非诺贝特)和烟酸类(如烟酸)以及胆酸结合树脂类(如考来烯胺)。中药降脂作用以降低血清胆固醇者居多,常用的有葛根、泽泻、大黄、绞股蓝、山楂、女贞子、香菇、决明子、何首乌等,已上市的中药复方制剂有降脂宁、桂枝茯苓丸、小柴胡汤等[46]。
3.3 控制血压
目前抗高压的药物的种类较多,包括血管紧张素转换酶抑制剂(如卡托普利),血管紧张素受体拮抗剂(如缬沙坦)、利尿剂(如氢氯噻嗪)、钙通道拮抗剂(如硝苯地平)等。美国心脏预后预防评估研究(heart outcomes prerention evaluation,HOPE)发现,与其他降压药相比,ACEI通过强化控制血压而降低卒中风险的作用最强。降压中成药主要集中在活血化瘀类,平肝熄风类,如复方丹参滴丸,牛黄降压丸等。
3.4 抗氧化治疗
L-丙酰肉毒碱、α-硫酸锌、过氧化物酶增殖体激活受体(PPARs)激动剂(如罗格列酮)、他汀类药物(如洛伐他汀)及肾素-血管紧张素系统(RAS)阻滞剂(如厄贝沙坦)均具有抗氧化作用[47-48]。其中α-硫酸锌是唯一的一种具有自我再生能力的线粒体抗氧化物质,可有效清除羟自由基,次氯酸和过氧化亚硝酸盐。基础及临床研究均显示该物质可通过缓解糖尿病患者的氧化应激状态,恢复受损的内皮功能[48]。研究证实,中药姜黄有效成分姜黄素可以降低高糖条件下氧自由基的产生,对高糖诱导的蛋白质糖基化和脂质过氧化有预防作用[49]。白藜芦醇通过抑制NADPH氧化酶活性,在糖尿病脑微血管病变中发挥抗氧化作用[50]。此外,研究证明,桑叶总黄酮[51],玉米须总黄酮[52],北五味子油[52],桑精胶囊[52],地骨皮提取液[53]均可以通过提高SOD水平或活性,改善氧化应激状态。
3.5 AR抑制剂
目前已报道的AR抑制剂已达100多种,按结构主要分为羧酸类(如托瑞司他)和海因类(如索比尼尔)[54]。此外,已有较多关于中药提取物及有效成分对醛糖还原酶具有抑制作用。在中草药方面,醛糖还原酶抑制剂主要集中在黄酮类化合物、萜类、生物碱及酚类衍生物。体内外研究表明,密花远志有效成分(5-甲酰基呋喃-2-基)甲基4-羟基-2-甲基丁酸酯通过抑制AR性,进而抑制磷脂酶C/蛋白激酶C信号通路的活性,其进一步导致IκB激酶/IκB/核因子-κB(NF-κB)炎症途径的失活,从而发挥抗神经炎的作用[55]。通过腹腔注射链脲佐菌素(STZ) 60 mg·kg-1建立糖尿病大鼠模型,观察密蒙花正丁醇提取物对模型大鼠血糖和AR活性的影响,发现密蒙花正丁醇提取物可降低糖尿病大鼠血糖水平且短期内具有抗AR活性[56]。动物实验证明黄芩苷对糖尿病大鼠AR的抑制作用与依帕司他相似[57]。
3.6 AGEs抑制剂
AGEs抑制剂主要有氨基胍、焦磷酸硫胺素和吡哆胺、替尼西坦、AGEs断裂剂ALT-711等。另外,某些中药有效成分和复方也被证明具有抑制AGEs的形成的作用,能够在一定程度上改善糖尿病性脑微血管病变。黄芩苷可以下调蛋白非酶糖基化引起的凋亡蛋白Bax表达的增加,增加抑制基因Bcl-2的表达[58]。体外研究发现,五味子、山茱萸、山楂、葛根提取物均能明显减少体外AGEs产物的生成[59]。
3.7 PKC抑制剂
在对人血管平滑肌培养细胞研究中发现,PKC抑制剂可以减弱高糖诱导的血管通透性因子的表达[60]。PKC抑制剂灯盏花对谷氨酸致原代培养的大鼠脑微血管内皮细胞(rBMECs)损伤具有明显的保护作用[61]。采用小鼠主动脉内皮细胞,应用高糖及高同型半胱氨酸体外诱导模拟糖尿病的内环境,给予大蒜素干预,与模型组相比,大蒜素组内皮细胞损伤明显减少,细胞内的PKC活性明显降低[62]。
3.8 改善Aβ转运异常的药物
研究发现,二甲双胍、优降糖、甘精胰岛素能降低RAGE的表达,并显著减少Aβ经血脑屏障的内流,其中甘精胰岛素还可通过增加LRP-1的表达增加Aβ的外流,此外,这些药物能够明显抑制海马中Aβ1-40和Aβ1-42的含量,减少神经元凋亡,从而改善脑微血管病变及其引起的认知损伤[63]。银杏叶提取物 EGb761可降低大脑微血管内皮细胞中RAGE的表达,使Aβ不能通过血脑屏障,从而减少脑内Aβ的沉积[64]。采用中药复方益智汤对APP转基因小鼠血脑屏障RAGE与LRP-1表达量进行干预,与模型组相比,给药组小鼠脑血脑屏障RAGE的表达降低,LRP-1的表达增加[65]。
3.9 其他治疗
除上述治疗策略外,对糖尿病脑微血管病变患者还可以采用扩容和血液稀释剂、抗血小板凝集药如阿司匹林等、促进脑细胞代谢的药物如脑活素、胞二磷胆碱等、针灸、耳针等疗法来改善和调整脑微血管的功能。体内外研究表明,耳迷走神经分区穴位电针对糖尿病大鼠海马区微血管基底膜水肿具有显著改善作用,并可抑制糖尿病血管并发症炎性反应及细胞黏附[66-67]。
糖尿病脑微血管病变治疗策略总结见表1。
4 小结与展望
糖尿病脑微血管病变是糖尿病,尤其是2型糖尿病的常见并发症,可进一步引起认知障碍、脑梗死、无症状性卒中等,极大地影响糖尿病患者的生存质量,并成为糖尿病患者的主要死因之一。目前,關于糖尿病诱发脑微血管病变的机制已有了许多新的进展,然而,对于信号变更的发生顺序和一个单独的信号改变对全局的影响还不是十分清楚。因而需要对其机制的进一步深入研究,为有效预防和治疗糖尿病性脑微血管病变提供更多途径和方法。在诊断和治疗方面,早诊断、早治疗对于控制糖尿病脑微血管并发症是至关重要的。由于病因病机的多样性,诊断方法的局限性,加之患者及家属的易忽略性,常常导致预防和治疗的延误。应当要结合中西医的优势,及时对患者进行预防和治疗,以提高生活质量,延长寿命。
[参考文献]
[1] Zetter B R. The endothelial cells of large and small blood vessels[J]. Diabetes, 1981, 30(Suppl2): 24.
[2] 黄艳,吴兴临,张建中,等.糖尿病大鼠脑内微血管细胞外信号调节激酶磷酸化的研究[J].宁夏医科大学学报,2012,34(9):881.
[3] 李芸,柳弥,吴碧华,等.胰高血糖素样肽-1受体与紧密连接相关蛋白5在糖尿病大鼠脑微血管内皮的表达变化[J].中华脑科疾病与康复杂志:电子版,2014,4(3):21.
[4] 王悦.糖尿病脑病研究进展[J].中华现代内科学杂志,2008,5(5):415.
[5] 姚蔚,张倩,方琦,等. 2型糖尿病血管并发症与早期认知障碍临床相关性研究[J].中国全科医学, 2011,14(35):4045.
[6] 左玲俊,徐俊冕,季建林,等.并发微血管病变的2型糖尿病患者的认知功能研究[J].中国临床心理学杂志,2001,9(2):102.
[7] 周厚广,董强,胡仁明.糖尿病性脑血管病的研究进展[J].中国脑血管病杂志,2009,6(1):49.
[8] Chandra D, Ramana K V, Friedrich B, et al. Role of aldose reductase in TNF-α-induced apoptosis of vascular endothelial cells [J]. Chem Biol Interact, 2003, 143: 605.
[9] Hamada Y, Hammon K, Raskin P. Correlation between erythrocyte aldose reductase activity and the width of skeletal-muscle capillary basement membrane in insulin-dependent diabetes mellitus [J]. J Diabetes Complicat, 1992, 6(4): 242.
[10] Hudson B I, Schmidt A M. RAGE: a novel target for drug intervention in diabetic vascular disease [J]. Pharm Res-Dordr, 2004, 21(7): 1079.
[11] krha J. Pathogenesis of angiopathy in diabetes[J]. Acta Diabetol, 2003, 40(2): s324.
[12] 常在,陆茵.糖尿病微血管病变及治疗药物的研究进展[J].南京中医药大学学报:自然科学版,2003,2(2):123.
[13] Tuttle K, Anderberg R,Meek R. Oxidative stress mediates protein kinase C activation and advanced glycation end product formation in a mesangial cell model of diabetes and high protein diet[J]. Am J Nephrol, 2009, 29(3): 171.
[14] 杨红英,李树清,王卓,等.实验性糖尿病鼠脑微血管病变与氧化应激反应的研究[J].中国微循环,2009,13(4):250.
[15] ktem F, Ozguner F, Yilmaz H R, et al. Melatonin reduces urinary excretion of N-acetyl-beta-D-glucosaminidase, albumin and renal oxidative markers in diabetic rats[J]. Clin Exp Pharmacol P, 2006, 33(1/2): 95.
[16] Thallasbonke V, Thorpe S R, Coughlan M T, et al. Inhibition of NADPH oxidase prevents advanced glycation end product-mediated damage in diabetic nephropathy through a protein kinase C-alpha-dependent pathway[J]. Diabetes, 2008, 57(2): 460.
[17] Koya D, King G L. Protein kinase C activation and the development of diabetic complications[J]. Diabetes, 1998, 47(6): 859.
[18] 朱加明,刘志红.己糖胺通路与糖尿病及其并发症[J].肾脏病与透析肾移植杂志,2002,11(5):458.
[19] James L R, Tang D, Ingram A, et al. Flux through the hexosamine pathway is a determinant of nuclear factor κB-dependent promoter activation [J]. Diabetes, 2002, 51(4): 1146.
[20] 胥文娟,朱梅佳,赵张宁,等.罗格列酮经LRP-1途径降低糖尿病大鼠脑微/小血管中β-淀粉样蛋白含量的研究[J].山东大学学报:医学版,2012,50(6):5.
[21] Deane R, Wu Z, Zlokovic B V. RAGE (Yin) versus LRP (Yang) balance regulates Alzheimer amyloid β-peptide clearance through transport across the blood-brain barrier [J]. Stroke, 2004, 35(11 suppl 1): 2628.
[22] Hong H, Liu L P, Liao J M, et al. Downregulation of LRP1 [correction of LPR1]at the blood-brain barrier in streptozotocin-induced diabetic mice [J]. Neuropharmacology, 2009, 56(6/7): 1054.
[23] 王苗,朱梅佳,赵张宁.不同年龄糖尿病大鼠脑组织LRP-1表达与Aβ1-40的相关性[J].山东大学学报:医学版,2010,3(3):19.
[24] Li P L, Hao H, Jian M L, et al. Upregulation of RAGE at the blood-brain barrier in streptozotocin-induced diabetic mice [J]. Synapse, 2009, 63(8): 636.
[25] 胡怀东,陈莉芬,胡长林.高糖对脑微血管内皮细胞活力和内皮素-1的影响[J].重庆医科大学学报,2007,31(6):801.
[26] Yang J, Nan W, Yu Z, et al. Roles of SIRT1 in high glucose-induced endothelial impairment: association with diabetic atherosclerosis [J]. Arch Med Res,2011,42(5):354.
[27] 李雪梅. eNOS与糖尿病脑微血管病变机制及干预研究[D].南充:川北医学院,2013.
[28] Ghribi O, Larsen B, Schrag M, et al. High cholesterol content in neurons increases BACE, β-amyloid, and phosphorylated tau levels in rabbit hippocampus [J]. Exp Neurol, 2006, 200(2): 460.
[29] 王小林,张舜.糖尿病微血管病变分析[J].中国疗养医学,2011,20(11):1009.
[30] Schmidt A M, Hori O, Brett J, et al. Cellular receptors for advanced glycation end products. Implications for induction of oxidant stress and cellular dysfunction in the pathogenesis of vascular lesions [J]. Arterioscl Throm Vas, 1994, 14(10): 1521.
[31] 鄭世荣,刘凤英,田牛,等.糖尿病大鼠红细胞对脑组织损伤的影响[J].微循环学杂志, 1999,3(3):5.
[32] 付享征,金玲,沈洁.急性脑梗死与糖尿病临床关系探讨[J].中国临床保健杂志,2005,8(4):359.
[33] 王乃东,阎胜利.糖尿病与脑梗死的关系研究进展[J].药品评价,2011,8(1):137.
[34] 贾安奎. 2型糖尿病患者微血管病变与血小板活化关系的研究[J].中国误诊学杂志,2006,6(21):4105.
[35] Biswas S, Zhao Y A, Gardner T, et al. PDGF- and insulin/IGF-1-specific distinct modes of class IA PI 3-kinase activation in normal rat retinas and RGC-5 retinal ganglion cells [J]. Invest Ophth Vis Sci, 2008, 49(8): 3687.
[36] 岳红,柳洁.高同型半胱氨酸血症与糖尿病及其微血管并发症的研究进展[J].中国基层医药,2006,13(5):869.
[37] 庄妍,林来祥.胰岛素样生长因子-1与糖尿病微血管并发症[J].国际内分泌代谢杂志,2009,29(2):123.
[38] 倪青.糖尿病脑血管病的中西医结合诊断与治疗[J].实用糖尿病杂志,2012(1):58.
[39] 沈洁,薛耀明,张云昆,等.经颅多普勒检测糖尿病大血管和微血管病变的应用价值[J].中华内科杂志,2002,41(3):172.
[40] 冯利得.糖化血红蛋白检测对糖尿病微血管病变评估的价值[J].中国现代药物应用, 2012,18(2):54.
[41] 王志华,苏荣.同型半胱氨酸与糖尿病周围神经病变的关系的研究进展[J].实用糖尿病杂志,2013(3):9.
[42] 夏世念.血小板参数在2型糖尿病微血管病变中的变化及意义[J].内蒙古中医药,2012,31(11):94.
[43] 兰丽珍,弓军胜,谭芳,等.急性血糖波动加剧氧化应激引起糖尿病微血管并发症的研究[J].中西医结合心脑血管病杂志,2013,11(6):678.
[44] Sacco R L, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline [J]. Circulation, 2006, 113(10): e409.
[45] 刘朋.中药降糖有效成分及其药理作用的研究[J].河北医药,2011,33(24):3790.
[46] 郭东杰,袁肖寒,蔡曼,等.降血脂西药与中药研究现状与展望[J].黑龙江医药,2014,27(1):31.
[47] Felix C, Gillis M, Driedzic W R, et al. Effects of propionyl-L-carnitine on isolated mitochondrial function in the reperfused diabetic rat heart [J].Diabetes Res Clin Pr,2001, 53(1): 17.
[48] 李红.糖尿病微血管病变发病机制和治疗靶点[J].浙江大学学报:医学版,2006,35(3):233.
[49] Jain S K, Rains J, Jones K. Effect of curcumin on protein glycosylation, lipid peroxidation, and oxygen radical generation in human red blood cells exposed to high glucose levels [J]. Free Radical Bio Med, 2006, 41(1): 92.
[50] 趙瑛,陈峰.白藜芦醇对高糖下脑微血管内皮细胞NADPH氧化酶的影响及干预机制[J].成都:中华医学会第十三次全国神经病学学术会议,2010.
[51] 俞灵莺.桑叶总黄酮对糖尿病大鼠抗氧化作用[J].现代中西医结合杂志,2007,16(35):5245.
[52] 景怡,景荣琴,胡天惠,等.玉米须总黄酮对糖尿病高脂血症大鼠血脂、血糖水平的影响及抗氧化作用[J].中药药理与临床,2011,27(2):85.
[53] 叶真,倪海祥,黄琦,等.地骨皮提取液对糖尿病肥胖大鼠血清炎症因子及抗氧化功能的影响[J].中华临床医师杂志:电子版,2007,1(5):52.
[54] 杨哲.醛糖还原酶抑制剂和糖尿病并发症[J].国际药学研究杂志,1999(4):217.
[55] Zeng K W, Li J, Dong X, et al. Anti-neuroinflammatory efficacy of the aldose reductase inhibitor FMHM via phospholipase C/protein kinase C-dependent NF-κB and MAPK pathways [J]. Toxical Appl Pharm, 2013, 273(1): 159.
[56] 李海岛,冯苏秀,叶儒,等.密蒙花正丁醇提取物对糖尿病大鼠血糖和醛糖还原酶的影响[J].中草药,2008, 39(1):87.
[57] 王秀军,明义,孙丽萍,等.黄芩苷对糖尿病大鼠组织醛糖还原酶活性及肾脏细胞凋亡的影响[J].中国老年学杂志,2007,27(23):2278.
[58] 刘长山,王秀军,柳林,等.氨基胍、黄芩苷对糖尿病大鼠组织非酶糖化及视网膜细胞凋亡的影响[J]. 中国现代医药杂志,2009,11(6):33.
[59] 许惠琴,朱荃,李祥,等.7味中药对体外非酶糖化终产物生成的抑制作用[J].中草药, 2002,32(2):145.
[60] 邹梦晨,薛耀明.蛋白激酶C抑制剂对高糖致血管内皮细胞高通透性的保护作用[J].南方医科大学学报,2012,32(12):1787.
[61] 叶立,李建宇,李月鹏,等.灯盏花素对大鼠脑微血管内皮细胞损伤的保护作用[J].中草药,2011,42(5):955.
[62] 王淑丽.大蒜素对糖尿病大血管病变的保护机制研究[D].济南:山东大学,2015.
[63] Chen F, Dong R R, Zhong K L, et al. Antidiabetic drugs restore abnormal transport of amyloid-β across the blood-brain barrier and memory impairment in db/db mice [J]. Neuropharmacology, 2015, 101:123.
[64] 丛潇,王友政,张文生.晚期糖基化终末产物受体与阿尔茨海默病[J].中国老年学,2010,30(12):1759.
[65] 张忠,薛卫国,白丽敏,等.益智汤对APP695转基因小鼠行为学及脑组织LRP-1和RAGE表达的影响[J].中华中医药杂志,2012,27(10):2696.
[66] 曾永保,梅志刚,王明智,等.耳针对糖尿病大鼠脑微血管炎症损伤保护作用机制研究[J].时珍国医国药,2012,23(11):2886.
[67] 梅志刚, 曾永保, 王明智,等.电针耳甲区对糖尿病大鼠脑微血管内皮细胞肿瘤坏死因子-α mRNA、细胞黏附因子-1和血管间黏附分子-1蛋白表达的影响[J].针刺研究,2012,37(6):440.
[68] Amarenco P, Bogousslavsky J, Rd C A, et al. High-dose atorvastatin after stroke or transient ischemic attack [J]. N Engl J Med, 2006, 355(6): 549.
[69] Ronda Turner, R Holman, Irene M Stratton, et al. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: Ukpds 38 [J].BMJ, 1998,317:703.
[70] 时乐,黎蕾.糖尿病血管并发症线粒体氧化损伤机制及药物治疗进展[J].中华老年医学杂志,2006,25(3):228.
[71] Forbes J T V, Mc T, Hw F, et al. The breakdown of pre-existing advanced glycation end products is associated with reduced renal fibrosis in experimental diabetes [J]. FASEB J, 2003, 17(10): 1762.
[72] Thallasbonke V, Lindschau C, Rizkalla B, et al. Attenuation of extracellular matrix accumulation in diabetic nephropathy by the advanced glycation end product cross-link breaker ALT-711 via a pProtein kinase C-α-dependent pathway[J]. Diabetes, 2004, 53(11): 2921.
[73] Degenhardt T P, Alderson N L, Arrington D D, et al. Pyridoxamine inhibits early renal disease and dyslipidemia in the streptozotocin-diabetic rat [J]. Kidney Int, 2002, 61(3): 939.
[74] 陳勇,朱禧星,钟学礼.醛糖还原酶抑制剂与糖尿病慢性并发症[J].国际内科学杂志,1992(9):389.
[75] Tuttle K R, Bakris G L, Toto R D, et al. The effect of ruboxistaurin on nephropathy in type 2 diabetes [J].Diabetes Care, 2005, 28(11): 2686.
[76] Tamaki C, Ohtsuki S, Terasaki T. Insulin facilitates the hepatic clearance of plasma amyloid beta-peptide (1-40) by intracellular translocation of low-density lipoprotein receptor-related protein 1(LRP-1) to the plasma membrane in hepatocytes [J]. Mol Pharmacol, 2007, 72(4): 850.
[责任编辑 张宁宁]
