动物类中药质量控制的生物评价研究
2017-07-13王玄欧阳罗丹代春美马莉肖小河
王玄+欧阳罗丹+代春美+马莉+肖小河

[摘要] 动物类中药是中药中极具特色的一部分,其药性峻猛,药效成分不明确。现行动物类中药的质量控制和评价方法无法有效地控制其有效性及安全性,严重制约了动物类中药的发展。生物评价不拘泥于个别成分的作用,以生物效应直接关联药效和安全性。随着生物技术的发展,生物芯片、高内涵分析等新技术的涌现,从相关靶点、通路或关键生化因子入手,拓展了生物评价方法的领域。生物评价具有药效相关、整体可控等优势,符合中医药质量控制的特点,将成为动物类中药质量标准化的重要发展方向之一。
[关键词] 中药; 动物类中药; 质量控制; 生物评价
[Abstract] Animal medicine is a unique part of traditional Chinese medicine. They have strong effects, but their effective compounds are not entirely known. The efficiency and safety of animal medicines can′t be effectively controlled by current quality assurance system and evaluation method, which has deeply influenced the development of animal medicines. Biological assay does not focus on efficacy of single component, but directly reflects the pharmacodynamics and safety of animal medicines by biological effect. With the development of biotechnology, many new technologies have emerged, such as biochip and high content analysis. Based on the related targets, pathways and key biochemical factors, the field of biological assay has been expanded. With advantages of pharmacology andoverall controllability, as well as the characteristics of in line with the quality control of Chinese Medicine, biological assay will become one of the important development directionsfor quality standardization of animal medicines.
[Key words] traditional Chinese medicine; animal medicine; biological assay; quality control
动物类中药(简称为动物药),又称为虫类药。即来源于动物整体、器官、生理或病理产物等供药用的中药材。动物药使用历史悠久,早在战国时期,中医始有运用动物药的文献记载。《神农本草经》中有动物药67种,占18.4%。《本草纲目》中有动物药461 种,占24.4%。近年调查我国中药有12 807种,其中动物药1 581种,占12.3%[1]。动物药大多成分复杂,药效物质基础研究不明确,且功效与成分难以关联。随着野生资源逐渐匮乏,伪劣品不断出现,这对现行动物药的质量控制体系提出挑战。生物评价具有药效相关、整体可控等技术优势,随着新技术的不断涌现,动物药质量生物评价实施的条件已日趋成熟。本文拟从动物药的特点及质量控制现状进行分析,阐述生物评价在动物药质量控制中的优势,应用与发展。
1 动物药的特点
1.1 成分复杂,药效物质基础不明确
目前从动物药中分离得到的活性成分主要有蛋白质、多肽、氨基酸类及其他小分子物质。动物药成分复杂,药效物质基础不明确。以动物药水蛭为例,水蛭素是目前已知的作用最强的凝血酶特异性抑制剂,一般从水蛭唾液腺中获得[2]。中医临床多以动物全体入药,经高温炮制后入药仍具有较强的活性,水蛭真正发挥临床疗效是水蛭素还是其它成分,目前尚无定论。
1.2 功效多,成分与药效难以关联
动物药大多具有多种功效。美洲大蠊古称蜚蠊,《神农本草经》记载:“主血瘀,寒热,破积聚,喉咽痹,内寒,无子。”《别录》:“通利血脉”。现代药理作用包括促进创面愈合,抗炎、镇痛、消肿,抑制肿瘤细胞的增殖活性,提高机体免疫功能,抗氧化等作用。目前研究表明其含有蛋白质、多肽、氨基酸、脂肪和脂肪酸、信息素、糖类、酶及丰富的矿物质和微量元素等成分[3]。眾多的成分与众多的功效如何对应?不同的功效是否对应着不同的活性成分?各药效成分之间是否存在协同增效的可能?动物药组成复杂,单以成分为指标,难以实现动物药质量控制的突破。
1.3 药性峻猛,大多有毒
动物药药性峻猛,大多有毒。虫类药多含有异体蛋白,现代医学认为,异体蛋白易引起人体过敏反应,以其致敏性损伤机体[4-5]。目前动物药不良反应、毒性特征不完全清楚,毒性物质基础和中毒机制暂不明确。在历代本草专著和现行《中国药典》中,动物药仅有有毒无毒的记载及毒力强弱的分级(如大毒、有毒和小毒),尚缺乏客观的判断标准。因此,动物药的安全性评价也需要加强。
1.4 来源复杂,资源紧缺
动物药的来源十分复杂。尤其一部分来源于动物的分泌物、排泄物及生理病理产物,如麝香、五灵脂、蝉蜕、牛黄等,或为动物的加工品,如阿胶、血余炭等。再加上饮片加工炮制等原因,很多原有性状特征无法鉴别。而且《野生动物保护法》将许多动物药列入保护动物,而现有人工养殖技术还有待提高,导致目前许多动物药资源紧缺。在供不应求的市场上,伪品、劣品、混淆品和习用品泛滥,这使在动物药的真伪优劣的质量把控上有更大的难度。
2 动物药质量控制的现状与挑战
目前动物药质量控制主要有以下几种控制模式。
2.1 找成分,测成分
现行动物药质量评价与控制的模式大部分是依据指标性成分定性检测与定量测定而制定的,但这些指标性成分大多是为了检测而检测,其不一定是专属性成分,也不一定是有效成分;即使既是专属性成分也是有效成分,其谱效关系、量效关系、毒效关系目前尚不清楚。以胶类药材为例,在2015年版《中国药典》中,龟甲胶、阿胶和鹿角胶3种药材均以L-羟脯氨酸、甘氨酸、丙氨酸、 L-脯氨酸这4种氨基酸作为质控成分。虽同为胶类药材,均有滋阴补血之效,但龟甲胶偏于养阴清虚热,阿胶偏于滋补阴血,鹿角胶则偏于温阳补肾。由此可见,这4种氨基酸专属性不强,不能很好地解释胶类药材各自功效的特点。又如冬虫夏草以腺苷为检测指标。冬虫夏草的常见混淆品和伪品中腺苷含量虽然略低于冬虫夏草的腺苷含量,可是均高于药典标准[6]。如果仅以腺苷含量为依据,这几种药材皆可以等同于冬虫夏草入药,可这显然有悖于实际应用。随着技术手段的进步,如液质联用技术,使可检测的成分越来越多,检测指标也由单一成分转向多指标同步测定。例如除了腺苷以外,核苷、麦角甾醇、糖类以及氨基酸等也均被作为指标性成分进行虫草的质量控制[7-10]。但这仍没有解决动物药质量控制与功效未很好关联的问题。
2.2 基于主要成分或一类成分的质量控制模式
作为动物药的主要成分,蛋白质及多肽的研究也越来越多。童芯锌等[11]使用双向电泳筛选得到虫草特有的21种蛋白质,为有效物质的确立奠定基础。张晗星等[12]采用iTRAQ 技术从蛋白质组的水平上对虫草有效成分进行更深入的鉴定,为质量标准提供科学参考。程显隆等[13]利用蛋白质酶切技术和液质联用技术分析其蛋白质及多肽的分子质量及其分布规律,得到胶原蛋白特征肽段,以用来鉴别胶类药材。
指纹图谱在动物药质量控制的研究也日益增多。用于动物药指纹图谱研究的方法分为光谱法和色谱法2类,以色谱法居多。光谱法例如那丽丹等[14]采用1H-NMR 代谢组学法得到不同厂家阿胶经酸水解后的1H-NMR 图谱,并进行化学成分差异性分析,为质量控制提供了新方法和新思路。陈罡等[15]建立了冬虫夏草核磁特征指纹图谱。 赵建国[16]、周健等[17]则采用傅里叶变换红外光谱法 (FTIR) 得到僵蚕、麝香的红外光谱指纹图谱,可直观有效地鉴别正品和伪品,以此为生药鉴定与品质评价提供参考。而色谱法例如通过HPLC指纹图谱对冬虫夏草、海龙的品种真伪进行有效鉴别[18-19]。高效毛细管电泳技术(HPCE) 因具有分析核酸、多肽和蛋白質生物大分子的优势,在动物药的指纹图谱中研究很多。目前已报道建立了土鳖虫、僵蚕、蛤蚧、蕲蛇、乌梢蛇、金钱白花蛇、菲牛蛭等的HPCE指纹图谱,以此作为其品种鉴定与质量控制方法[20-26]。但是由于动物药成分极其复杂,虽然反映了整体化学信息,但所检测的特征指纹有可能并不完全包含其有效成分,“谱-效”关系不能得到体现,所以控制一类成分也只能是一种过渡性质量控制方法。
2.3 基于核酸分子鉴定技术的动物药来源真实性考察
如采用基于聚合酶链式反应(PCR)分子鉴定技术[27-28]及环介导等温扩增法(LAMP)鉴定技术[29]和基于 ITS序列的条形码技术[30]等对冬虫夏草进行真伪鉴定。Kumeta等[31]以细胞色素b基因作为引物,成功地鉴别出阿胶的动物基源以及掺假与否。 Yuan G等[32]通过建立RAPD-HPCE法能快速鉴别鹿茸真伪。近年来,DNA条形码技术成为动物药材鉴定的新工具。鄢丹等[33]利用COⅠ 序列可以对羚羊角、鹿角等传统角类药材及其伪品进行很好地鉴别。张辉等[34]利用DNA 条形码可以对《中国药典》45种动物药材及其混伪品进行相互区分。2014年,石林春等[35]构建了中国动物药材 DNA 条形码数据库。
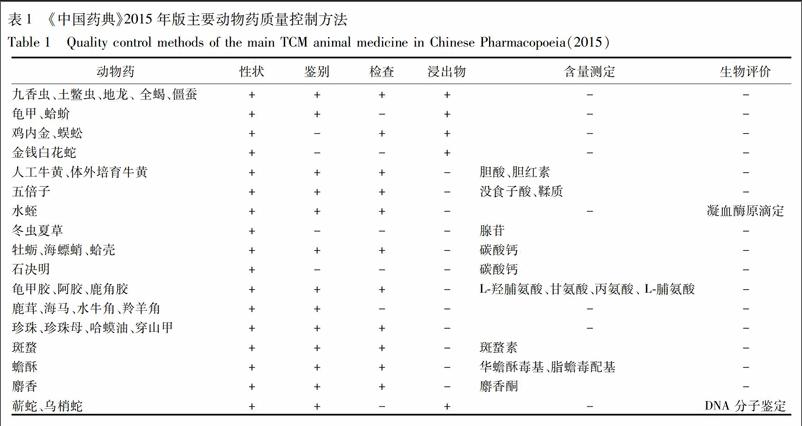
目前动物药研究重点主要关注其来源的真实性及个别成分或某一类成分的变化规律,见表1,并未重点关注动物药的生物药效。其优劣等级如何区分,人工养殖品与野生品之间的临床功效差异几何?对于动物药这种多成分复杂体系,单以成分为指标,难以实现动物药质量控制的突破,亟待探索新的研究方法。
3 动物药的生物评价研究
生物评价(biological assay),是指在特定的试验条件下,评价供试药物作用于生物体系所表达出的特定生物效应的方法,用于定性或定量评价供试药物的质量。生物评价研究建立的方法须具备定量药理学与药检分析的双重属性和要求。即以药理实验研究为基础,例如解热、抗炎、活血等实验,建立基于生物效应的动物药评价模式,然后用生物统计的方法筛选出比较适宜的生物效价检测方法。理论上说,多数药理方法通过数理统计均可用作生物测定方法,但由于药品检验工作对生物测定的要求有其特殊性,以及多数中药量效关系不明显,因此一般的药理方法有时并不适合直接作为生物评价方法,故应对生物评价方法进行优化和选择。总而言之,动物药质量生物评价与控制并非常规药效试验的定量化,而是在生物检定思想的基础上,切合中药的自身特点,在满足药物质量控制操作可行性的前提下,最大程度地表征动物药的内在质量,达到质量评价与控制的目的。
现有方法多是关联功效或毒性的生物活性检测(包括效价、生物活性限值和毒价测定等),主要用于动物药质量的优劣、毒性大小等的评价。近年来,又发展起了生物芯片、组学技术、生物自显影薄层色谱和高内涵分析等新技术从相关细胞、靶点、通路或关键生化因子入手,建立起关联机制的动物药的生物评价。
3.1 关联功效或毒性的动物药生物活性检测
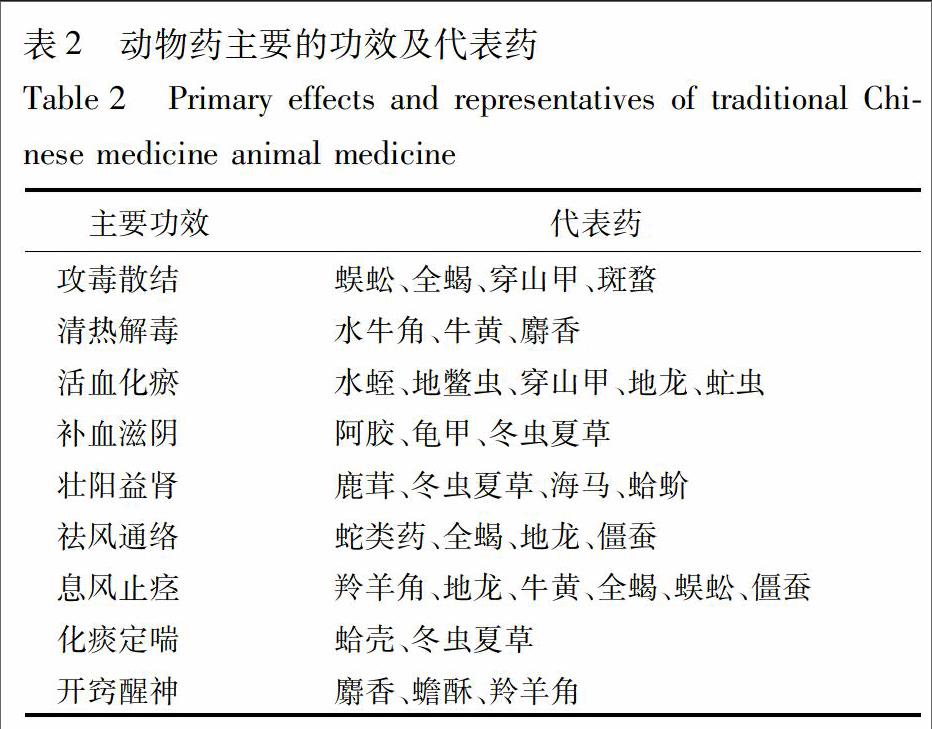
关联功效或毒性的生物活性检测可以定量表征动物药的功效、活性或生物学效应。生物评价具有关联功效的优势,尤其适用于组成复杂、理化方法难以测定,而且理化测定也不能反映其临床功效的动物药。根据常用动物药的主要功效,对其药理作用和相应生物活性评价方法进行了概述,见表2。
3.1.1 攻毒散结类动物药 攻毒散结类动物药可治疗浊痰、瘀血等结聚而形成的疮疡肿毒瘰疬结核诸证。现多用于抗肿瘤治疗。主要通过直接抑制肿瘤增生,促进细胞凋亡,阻止肿瘤细胞向周围组织浸润而起作用。以其功效构建生物评价的方法,从动物药对癌细胞生长抑制作用[36-37],对RNA和蛋白质合成的抑制作用,以及诱导细胞凋亡[38],抑制鸡胚血管生成[39]等进行生物评价。例如王晶娟等[40-41]以改良MTT法、流式细胞法研究全蝎蛋白药效组分对Bel7402细胞和HepG 2细胞毒和细胞周期抑制的作用,来评价全蝎的抗肿瘤活性。
3.1.2 清热解毒类动物药 清热解毒类动物药多用于里热证,即现代医学的多种急性传染病、感染性疾病及其他如肿瘤等。以其生物学效应构建方法,见表3。
以临床广泛用于治疗疮疡肿毒、咽喉肿痛、跌打损伤等症的麝香为例,罗云等[43]采用酶免疫 (EIA) 法,测定人工麝香对环氧合酶Ⅱ (COX-2) 的抑制率,构建人工麝香对COX-2 抑制作用的量效关系,为建立人工麝香的体外抗炎效价测定方法提供基础。此外,罗云等[44]采用微量热法,测定人工麝香对其抑制作用过程的热效应变化,并获得其相应的热动力学参数,从而对人工麝香对金黄色葡萄球菌抑制作用强度进行定性定量的评价。
3.1.3 活血化瘀类动物药 活血化瘀类动物药以疏通血脉、消散瘀血为主要作用,临床常用于各种血瘀证的治疗。同时,活血化瘀药因能改善机体的高黏状态,影响肿瘤细胞的血行扩散与转移,抑制新生血管生成而具有抗肿瘤作用[45]。以其生物学效应构建方法,见表4。
例如角甲类药物,基于其活血通络的作用,Luo等[53]采用血浆复钙实验,凝血酶时间,凝血酶滴定实验以及体外血栓法和全血凝块法分别对羚羊角,山羊角,水牛角,穿山甲,鳖甲,龟甲,鹿角等角甲类药的抗凝血、抗血栓活性进行了生物评价。并且根据生物评价结果对珍稀濒危物种寻找替代品提供借鉴依据。
3.1.4 补血滋阴类动物药 补血滋阴类动物药可以补益人体气血不足,提高机体免疫力,延缓衰老等。在抗肿瘤治疗中也发挥着扶正驱邪的作用。以其生物学效应构建方法,见表5。
Wu等[56]建立由5-FU和γ射线导致的血虚证模型,选择外周血象,骨髓和脾造血祖细胞,超氧化物歧化酶(SOD)、GSH-Px、ROS、脾表面集落形成单位(CFU-S)等功能指标对阿胶提取物进行增强造血作用评价。周丹蕾等[57]采用MTT比色法,通过其对刀豆蛋白A诱导的小鼠脾淋巴细胞增殖作用的影响来进行免疫活性生物评价,发现天然虫草和人工虫草均能增强免疫,但不同产地、品种和规格的虫草在增强免疫的作用上存在差异,这为以人工虫草替代天然虫草的可行性提供了参考依据。王东亮等[58]建立D-半乳糖致小鼠衰老模型,通过检测其血清、脑、肝中SOD,CAT,GSH-Px活性和MDA含量,以及采用Western blot法檢测p16和p21的表达等方法来评价阿胶的抗衰老活性。
3.1.5 壮阳益肾类动物药 部分虫类药甘咸性温,或为血肉有情之品,能温补肾阳,强筋健骨。主治肾阳不足的畏寒肢冷、腰膝酸软、阳痿不举、宫冷不孕等。以其生物学效应构建方法,见表6。
龚伟等[61]通过比较不同规格鹿茸饮片对去势骨质疏松症模型大鼠的影响,并进行聚类分析,建立起鹿茸饮片强筋健骨的生物学评价,从而为其饮片质量进行分级。毛翠平等[62]则用体外培养的成骨细胞,建立了抗骨质疏松中药作用于骨形成的药效学评价方法。
3.1.6 祛风通络类动物药 爬行虫类性善走窜,长于治风,有祛风通络,解毒止痛之功。是临床治疗风湿病的要药。以其生物学效应构建方法,见表7。
3.1.7 其他 动物药如麝香、蟾酥等具有开窍醒神的功效,主要用于各种窍闭神昏证。可从对中枢神经系统的影响,脑保护及抗炎作用等进行开窍活性评价。
3.2 生物新技术在动物药质量评价中的应用
随着现代科学的发展,许多新技术如生物芯片技术,组学生物标志物,高内涵分析技术以及生物自显影技术等逐渐被应用到动物药的生物评价中,这也是目前生物评价发展的方向。
3.2.1 生物芯片 生物芯片可以将中药研究与基因组学、蛋白质组学等系统生物学内容联系起来,在基因、蛋白质等分子水平阐明中药的作用靶点和机制,通过高通量检测及表达谱形式表征中药药效,在中药质量评价和控制研究领域的应用已日益增多。武丽斐等[64]应用大鼠全基因表达谱芯片,通过差异表达基因发现冬虫夏草主要通过抗炎、抗凋亡、抗氧化等途径对缺血性神经元起到保护作用,并通过神经再生等作用对缺血部位的脑组织进行修复等。郑重等[65]通过基质金属蛋白酶(MMPs)功能基因芯片检测筛选差异表达基因,结果表明康复新液能明显抑制 MMP-3,MMP-13的表达,这为其改善急性大鼠实验性结肠炎的作用机制提供了依据。
此外,利用表达谱对比研究动物药或其提取物作用于机体前后,特定细胞中相关物质表达的异常变化,可提示该动物药在研究剂量下是否具有毒性,并能阐明其作用机制并控制其安全性[66]。杨爱文等[67]以蟾酥为研究对象,通过表达谱芯片筛查大鼠在灌胃给予蟾酥高、低剂量的基因表达差异,然后进行Ontology和Pathway富集分析,解释蟾酥心脏毒性的作用机制及其剂量依赖性。
3.2.2 组学生物标志物 生物标志物是一种能客观测量并评价正常生物过程、病理过程或对药物干预反应的指示物,是生物体受到干预时的重要指示指标,涉及细胞分子结构和功能的变化,生化代谢过程的变化,生理活动的异常表现,个体、群体或整个生态系统的异常变化等。在动物药质量评价领域,生物标志物可以灵敏、综合地反映中药的生物效应,为药效的定量表征提供依据。
耿潇等[68]运用双向凝胶电泳结合 MALDI-TOF-MS 技术,比较分析脑心通胶囊给药前后的蛋白表达变化,发现潜在的生物标志物,探讨脑心通胶囊防治心脑血管疾病的可能作用机制。张凤霞等[69]基于UFLC/MS-IT-TOF技术的代谢组学方法并结合多元统计学来研究通心络干预下的抑郁-动脉粥样硬化大鼠的血浆代谢谱,发现色氨酸、苯丙氨酸代谢及某些胆汁酸等标志物,从而为药效的定量表征提供依据。梁晓萍等[70]运用UPLC/TOF-MS方法,比较空白组和蟾酥给药组之间的代谢差异,找到潜在的生物标志物,发现蟾酥导致心脏损伤的途径可能是通过阻碍自由脂肪酸再酰化或激活蛋白激酶通路干扰了脂质代谢,从代谢组学的角度为阐述蟾酥毒性作用机理提供了新思路。
3.2.3 高内涵分析技术 高内涵分析技术是一种基于细胞表型分析的高效筛选技术,能够在保持细胞结构和功能完整的前提下,同时检测待测样品对细胞形态、生长、周期、迁移、凋亡、代谢途径及信号传导等方面的影响,从单一试验中获取大量有关信息,从而确定化合物的生物活性以及潜在毒性,从而以更直观、动态、定量的方式反映中药质量及药效[71]。具有动态、活体、多个指标同步检测综合性强的特点,可以全面生动的反映细胞组学的整体变化进程。
3.2.4 生物自显影技术 生物自显影薄层色谱是一种将薄层色谱分离和生物活性测定相结合的活性筛选方法。薄层色谱-生物自显影技术可使活性成分在薄层色谱板上直接显现肉眼可见的活性斑点,在中药检验中可直观地对药物活性成分作定性鉴别,实现了传统薄层鉴别目的,且也可用于定量,能反映中药的活性强弱。目前,应用较广的是对抗菌作用[72]、胆碱酶抑制作用[73]和抗氧化作用的评价[74-75]。
4 动物药生物评价方法构建
对于生物评价常规方法与技术的整体框架,见图1。
5 总结
2015 年,美国 FDA 于发布《植物药研发行业指南(草案)》,明确指出将生物评价作为植物药在美国新药注册评审的重要内容,其中就包括质量控制。将生物评价方法引入动物药质量控制和评价体系,通过选择合理的指标,尽可能多地反映其“功能主治”,以弥补目前动物药质量控制的缺陷。充分利用快速发展的科学技术,构建更多、更好、更系统的生物评价方法,以评价药效,观察毒副作用,更好地保障动物药的质量,推动它的现代化、产业化和国际化发展。
[参考文献]
[1] 李连达.《野生动物保护法》与中药动物药的关系[J].中国中药杂志,2016,41(10):1763.
[2] 万明,汪蜜,陈科力,等.宽体金线蛭抗凝血活性物质的提取方法[J].中国医院药学杂志,2012,32(6):414.
[3] 李旸,王芳,杨明,等. 美洲大蠊化学成分研究[J].中药材,2015,38(10):2038.
[4] 胡玉静,金珊珊,何韶衡,等.美洲大蠊Per a 9的抗原表位特征及三维结构建模[J].生物学杂志,2011,28(5):1.
[5] 胡玉静.湖南烙铁头蛇毒主要过敏原蛋白的鉴定[D].南京:南京医科大学,2012.
[6] 林津晶,李溪.冬虫夏草与混淆品、伪品中核苷含量的测定[J].福建中医药大学学报,2011,21(3):42.
[7] 肖远灿,胡风祖,董琦,等.青海玉树不同产地冬虫夏草中 15 种核苷类成分比较研究[J].中国药学杂志,2014,49(22):1983.
[8] 张薇薇,龚韬,战嘉怡,等.人工虫草与冬虫夏草成分的比较研究[J].北京中医药,2016(1):87.
[9] Guan J, Li S P. Discrimination of polysaccharides from traditional Chinese medicines using saccharide mapping enzymatic digestion followed by chromatographic analysis[J].J Pharm Biomed Anal,2010,51(3): 590.
[10] 汪家春,杨睿倩,陈雅琳,等.天然冬虫夏草冬虫夏草菌丝及发酵液游离氨基酸的种类及含量测定[J].解放军药学学报,2014(3):249.
[11] 童芯锌,王藝璇,国锦琳,等.双向电泳技术筛选鉴定冬虫夏草中指标性蛋白质研究[J].中国现代中药,2017,19(1):26.
[12] 张晗星,钱正明,董彩虹,等.冬虫夏草不同发育时期蛋白质组iTRAQ质谱分析[J].菌物学报,2016,35(4):411.
[13] 程显隆,陈佳,马双成,等.特征肽段检测技术用于胶类药材专属性鉴别方法研究[J].中国药学杂志,2015,50(2):104.
[14] 那丽丹,陈建丽,田俊生,等.基于1H-NMR代谢组学的阿胶化学成分差异性分析方法初探[J].中草药,2015,46 (17):2573.
[15] 陈罡,黄亮,刘国柱,等.冬虫夏草核磁特征指纹图谱建立及鉴别研究[J].世界科学技术——中医药现代化,2014(11):2371.
[16] 赵建国,曲伟红,余敬谋,等. 10批市售僵蚕商品药材质量评价[J]. 中国药房,2017(10):1399.
[17] 周健,金城,罗云,等.应用红外光谱技术鉴别中药麝香的真伪[J].光谱学与光谱分析,2010,30(9):2368.
[18] 王冰,李宁,詹华强,等.冬虫夏草中核苷类成分含量测定及HPLC指纹图谱研究[J].中药材,2015,38(5):952.
[19] 王梦月,韦静斐,史海明,等.海龙药材及其伪品的HPLC指纹图谱研究[J].中国药学杂志,2009,44(24):1847.
[20] 李峰,沈红薇,王成芳,等.僵蚕 HPCE 指纹图谱研究[J].辽宁中医杂志,2012,39(1):1.
[21] 李峰,王成芳,包永睿.土鳖虫药材高效毛细管电泳指纹图谱鉴别研究[J].中国中药杂志,2011,36(11):1471.
[22] 王成芳,包永睿,李峰,等.蛤蚧药材高效毛细管电泳指纹图谱研究[J].中药材,2010(3):337.
[23] 王成芳,包永睿,李峰,等.蕲蛇药材高效毛细管电泳指纹图谱的研究[J].辽宁中医杂志,2010(5):893.
[24] 李峰,张阳,张振秋,等.乌梢蛇药材的高效毛细管电泳指纹图谱研究[J].辽宁中医杂志,2015(10):1953.
[25] 许靖,王成芳,李峰,等.金钱白花蛇商品药材的高效毛细管电泳指纹图谱研究[J]. 中成药,2014(3):563.
[26] 姜新刚,孟作环,贾继明.广西菲牛蛭药材的高效毛细管电泳指纹图谱研究[J]. 中国中药杂志,2012,37(4):495.
[27] Wong Y L,Wong K L,Haw P C.Rapid authentication of Cordyceps by lateral flow dipstick[J].J Pharm Biomed Anal,2015,111:306.
[28] Lam K Y,Chan G K,Xin G Z,et al.Authentication of Cordyceps sinensis by DNA analyses: comparison of ITS sequence analysis and RAPD-derived molecular markers[J].Molecules,2015,20(12):22454.
[29] 李奎,李琦,袁媛,等.环介导等温扩增法鉴定检测冬虫夏草[J].中草药,2011,42(8):1605.
[30] Li X,Song J Y,Xin T Y, et al.DNA barcoding the commercial Chinese caterpillar fungus[J].Fems Microbiol Lett,2013,347(2):156.
[31] Kumeta Y,Maruyama T,Asama H,et al.Species identification of Asini Corii Collas (donkey glue) by PCR amplification of cytochrome b gene [J].J Nat Med,2014,68(1):181.
[32] Yuan G,Sun J,Li H,et al.Identification of velvet antler by random amplified polymorphism DNA combined with non-gel sieving capillary electrophoresis[J].Mitochondrial DNA,2016,27(2):1.
[33] Yan D,Luo J Y,Han Y M,et al.Forensic DNA barcoding and bio-response studies of animal horn products used in traditional medicine[J].PLoS ONE,2013,8(2):e55854.
[34] 張辉,姚辉,崔丽娜,等.基于COⅠ条形码序列的《中国药典》动物药材鉴定研究[J].世界科学技术——中医药现代化,2013,15(3):371.
[35] 石林春,姚辉,陈士林,等.中国动物药材DNA条形码数据库[J].中国中药杂志,2014,39(12):2155.
[36] 曾瑶波,刘晓玲,李创军,等. 斑蝥化学成分及体外抗肿瘤活性研究[J].中国中药杂志,2016,41(5):859.
[37] Sun L, Zhang J, Zhang Z, et al. Chromatographic fingerprint-bioactivity relationships of the antitumor properties of Bufo bufo gargarizans skin extracts[J].Anal Sci,2016,32(9):969.
[38] Hu F,Han J,Zhai B,et al.Blocking autophagy enhances the apoptosis effect of bufalin on human hepatocellular carcinoma cells through endoplasmic reticulumstress and JNK activation[J].Apoptosis,2014,19(1):210.
[39] Wang P L,She G M,Yang Y N,et al,Synthesis and biological evaluation of new ligustrazine derivatives as anti-tumor agents[J].Molecules,2012,17(5):4972.
[40] 王晶娟,张贵君,吴明侠.全蝎蛋白药效组分对HepG2细胞的体外抑制作用[J].药物分析杂志,2011(1):71.
[41] 王晶娟,张贵君,吴明侠,等.全蝎蛋白药效组分对Bel7402肿瘤细胞凋亡的影响[J].中国实验方剂学杂志,2010,16(12):112.
[42] Shi Z,Liu Z,Liu C,et al.Spectrum-effect relationships between chemical fingerprints and antibacterial effects of Lonicerae Japonicae Flos and Lonicerae Flos base on UPLC and microcalorimetry[J].Front Pharmacol,2016,7:12.
[43] 罗云,金城,肖小河,等.基于环氧合酶抑制作用的人工麝香质量评价方法研究[J].药学学报,2011(4):438.
[44] 罗云,金城,肖小河,等.基于微量热法和化学计量学的人工麝香抗金黄色葡萄球菌作用研究[J].中国药学杂志,2011,46(17):1312.
[45] 齐元富,刘歆,李慧杰. 活血化瘀方药治疗大肠癌及其肿瘤转移的理论探讨[J].中华中医药学刊,2014(8):1802.
[46] 韩冰,毛鑫,游云,等.基于抑制血小板聚集活性检测的血栓通胶囊质量控制研究[J].中国中药杂志, 2015, 40(23):4597.
[47] 金家金,王志斌,苏斌,等.水蛭体外抗凝血实验研究及其生物活性测定方法反应体系的筛选[J].中国药学杂志,2014,49(22):1997.
[48] 苏斌,王志斌,郭玉东,等.纤维蛋白原-凝血酶时间法用于水蛭质量控制方法的研究[J].药物分析杂志,2014,34(10):1802.
[49] 肖凌,徐小玲,陈科力,等.生物检定技术应用于水蛭抗凝血活性测定的研究[J].中国药学杂志,2015,50(3):258.
[50] 阮晓岚.血液病合并弥散性血管内凝血的诊断研究[D].武汉:华中科技大学,2014.
[51] 吴宁,张伟.D-二聚体和血浆硫酸鱼精蛋白副凝固试验检测继发性纤溶的对比研究[J].现代检验医学杂志,2007,22(5):82.
[52] 李润生,李大勇,陈文娜,等.桃红四物汤调节血管内皮细胞功能及治疗动脉硬化闭塞症的实验研究[J].中国中西医结合杂志,2014,34(2):191.
[53] Luo J Y, Yan D, Zhang D, et al.Substitutes for endangered medicinal animal horns and shells exposed by antithrombotic and anticoagulation effects [J].J Ethnopharmacol,2011,136(1):210.
[54] Liu X K, Wang L, Zhang C M, et al. Structure characterization and antitumor activity of a polysaccharide from the alkaline extract of king oyster mushroom[J].Carbohydr Polym,2015,118:101.
[55] Liu Q M, Xu S S,Li T, et al. In vitro and in vivo immunomodulatory activity of sulfated polysaccharide from Porphyra haitanensis[J].Carbohydr Polym,2017,165:189.
[56] Wu H Z, Ren C Y, Yang F.Extraction and identification of collagen-derived peptides with hematopoietic activity from Colla Corii Asini[J].J Ethnopharmacol,2016,182:129.
[57] 周丹蕾,武彥舒,肖小河,等. 天然虫草和人工虫草体外免疫活性的初步评价[J].中药材,2009,32(4):586.
[58] Wang D L,Liu M X,Cao J C,et al.Effect of Colla Corii Asini (E′jiao) on D-galactose induced aging mice[J].Biol Pharm Bull,2012,35(12):2128.
[59] Tseng S H,Sung C H, Chen L G,et al. Comparison of chemical compositions and osteoprotective effects of different sections of velvet antler[J].J Ethnopharmacol,2014,151(1):352.
[60] 李敏,张冰,刘小青.仙茅对类虚寒大鼠物质代谢及内分泌水平影响的实验研究[J].中成药,2012,34(6):1011.
[61] 龚伟,李峰.以鹿茸对去卵巢骨质疏松症模型大鼠的影响对不同规格鹿茸进行质量评价[J].中国中药杂志,2014,39(12):2326.
[62] 毛翠平,张云,郑筱祥,等.从细胞水平研究龟鹿二仙含药血清在治疗骨质疏松中的作用[J].生物医学工程学杂志,2008,25(4):897.
[63] Rachchh R P,Galani V J. Evaluation of antinociceptive and antirheumatic activity of Grangea maderaspatana (L.) Poir.using experimental models[J].Ayu,2015,36(4):425.
[64] 武丽斐.利用基因芯片技术研究冬虫夏草对缺血性中风机制的探讨[D].北京:北京中医药大学,2014.
[65] 郑重,陈维雄,何相宜,等.康复新液对急性大鼠实验性结肠炎作用机制的研究[J].胃肠病学,2008,13(1):31.
[66] 练雪萍,艾妮,范骁辉,等.毒理基因组学及其在中药安全性研究中的应用进展[J].中国中药杂志,2015,40(14):2690.
[67] 杨爱文,范雪梅,罗国安,等.基因芯片研究蟾酥急性毒性及配伍减毒机制[J].高等学校化学学报,2011,32(5):1058.
[68] 耿潇,陈璐,王虹,等.基于血清蛋白组学初步探讨脑心通胶囊防治心脑血管疾病的作用机制[J].中国中药杂志,2016,41(15):2864.
[69] 张凤霞,贾振华,许国旺,等. 中药通心络对抑郁-动脉粥样硬化大鼠干预作用的血浆代谢组学研究[J].中国科学:化学,2010(6):725.
[70] 梁曉萍,张政,罗国安,等.蟾酥急性毒性的代谢组学研究[J].高等学校化学学报,2011,32(1):38.
[71] Zock J M.Applications of high content screening in life science research[J].Comb Chem High Throughput Screen,2009,12(9):870.
[72] Chintaluri A K, Komarraju A L, Chintaluri V K. Comparative study of antimicrobial activity of essential oils of selected plants of Rutaceae and TLC bioautographic studies for detection of bioactive compounds[J].J Essent Oil Res,2015,27(1):9.
[73] Zheng X Y,Zhang Z J,Cheng X M,et al.Identification of acetylcholinesterase inhibitors from seeds of plants of genus Peganum by thin-layer chromatography-bioautography[J].J Planar Chromat,2011,24(6):470.
[74] Wang J, Yue Y D, Tang F, et al.TLC screening for antioxidant activity of extracts from fifteen bamboo species and identification of antioxidant flavone glycosides from leaves of Bambusa Textilis McClure[J].Molecules,2012,17(10):12297.
[75] Zhang X J, Liu L J, Yang X H, et al. An approach based on antioxidant fingerprint-efficacy relationship and TLC bioautography assay to quality evaluation of Rubia cordifolia from various sources[J].J Nat Med,2014,68(2):448.
[责任编辑 孔晶晶]
