干滤纸血片制备环境的理化因素对实验结果的影响*
2017-07-07方可欣尚世强杨建滨张婷胡真真汤薇薇吴鼎文
方可欣,尚世强,杨建滨,张婷,胡真真,汤薇薇,吴鼎文
(浙江大学医学院附属儿童医院新生儿遗传代谢病筛查实验室,杭州 310052)
·临床检验技术研究·
干滤纸血片制备环境的理化因素对实验结果的影响*
方可欣,尚世强,杨建滨,张婷,胡真真,汤薇薇,吴鼎文
(浙江大学医学院附属儿童医院新生儿遗传代谢病筛查实验室,杭州 310052)
目的 观察新生儿疾病筛查干滤纸血片(dried blood spots)制备环境中显著影响实验结果的理化因素。方法 研究组1:收集正常标本60例、阳性标本120例,于对照条件及10种特定环境下制备干滤纸血片。研究组2:另收集正常标本30例、阳性标本80例,于对照条件及7种甲醛浓度环境下制备干滤纸血片。用荧光法或时间分辨荧光免疫分析法检测标本中苯丙氨酸(Phe)、葡萄糖-6-磷酸脱氢酶(G6PD)、促甲状腺激素(TSH)、17α-羟孕酮(17α-OHP)水平。用SPSS 22.0软件进行统计学分析。结果 10种环境下制备的干滤纸血片Phe检测结果与对照组差异无统计学意义(P>0.05),甲醛敏感阈为4.62~6.95 ppm/18 h; 37 ℃烘箱、潮湿、紫外线照射、新装修环境、乙醇、冰醋酸、甲醛等环境下制备的干滤纸血片G6PD检测结果低于对照组(P<0.05),甲醛敏感阈为0.30~0.38 ppm/4 h及0.21~0.24 ppm/18 h;潮湿、紫外线照射、甲醛环境下制备的干滤纸血片TSH检测结果低于对照组(P<0.05),甲醛敏感阈为0.32~0.52 ppm/4 h及0.38~0.45 ppm/18 h;潮湿、紫外线照射、甲醛环境下制备的干滤纸血片17α-OHP检测结果低于对照组(P<0.05),甲醛敏感阈为4.37~4.62 ppm/4 h及0.38~0.45 ppm/18 h。冷风快速吹干与2~8 ℃冷库环境下制备干滤纸血片4项检测结果与对照组差异均无统计学意义(P均>0.05)。结论 干滤纸血片制备环境的理化因素与新生儿疾病筛查的准确性密切相关,甲醛、乙醇、冰醋酸、紫外线照射、高温、潮湿及装修污染等是干滤纸血片制备环境的必要管控因素;冷风快速吹干与2~8℃冷库过夜可作为新生儿筛查干滤纸血片制备的备选方法。
新生儿筛查;干滤纸血片;环境;因素;甲醛
新生儿疾病筛查(neonatal screening)是指在新生儿期筛查先天性或遗传性代谢病,在临床症状尚未表现之前发现患儿,通过早期诊断和治疗降低患儿的发病率和死亡率[1-2]。鉴于干滤纸血片的制备“安全、简便、稳定性好,标本易于储存”的特性[3],早在20世纪60年代已用于新生儿疾病筛查。研究表明,干滤纸血片制备或保存不当会严重影响实验结果[4-7]。干滤纸血片采集与制备多在接产单位完成,而各接产单位基础条件不一,其环境难以均一化。本研究模拟采血单位可能出现的特殊理化环境,分析各环境下制备的干滤纸血片在新生儿疾病筛查不同检测项目间的差异,旨在明确干滤纸血片制备环境的必要管控因素,为采血单位制备高质量的新生儿疾病筛查标本提供参考。
1 材料和方法
1.1 标本来源 收集肝素抗凝静脉血2.0 mL,研究组1入选60例正常标本(新生儿30例,儿童30例),苯丙氨酸(Phe)、葡萄糖-6-磷酸脱氢酶(G6PD)、新生儿促甲状腺素(TSH)、新生儿17α-羟孕酮(17α-OHP)检测阳性样本各30例(新生儿各10例,儿童各20例)。研究组2入选30例正常标本(均为儿童)和上述4项指标阳性标本各20例(均为儿童)。血液混匀后取50 μL滴于Schleicher&Schuell 903特种滤纸上,每个血斑直径大于8 mm,正反面渗透均匀,每例在不同环境下均制备3个血斑(每个血斑50 μL血液)。
1.2 试剂与仪器 新生儿Phe试剂盒(批号:642984)、G6PD测定试剂盒(批号:653008)、TSH测定试剂盒(批号:645363)、17α-OHP测定试剂盒(批号:642984)及1235 AutoDELFIA全自动时间分辨荧光免疫分析仪、Panthera-PuncherTM 9打孔仪均购自芬兰珀金埃尔默公司,1420多功能分析仪、1296-003型振荡器购自芬兰Wallac公司,紫外灯,Schleicher&Schuell 903滤纸,HTV-M型甲醛检测仪(购自英国PPM公司)。
1.3 实验方法 研究组1:分别暴露在对照条件(自然通风,环境温度25 ℃,湿度45%,水平晾干4 h)及10种特定环境:冷风快速吹干(距离血片10 cm处来回吹冷风约6 min,血斑颜色由鲜红变暗红,温湿度与对照组相同)、冷库过夜(温度2~8 ℃,湿度60%)、37 ℃烘箱(4 h,湿度34%)、潮湿(将干净滤纸片置于70 ℃热水上空15~20 cm保持20 min,让水蒸气使干净滤纸片充分受潮,冷却后滴片并自然晾干4 h)、紫外线照射1 h(照射距离约20 cm,温湿度同对照组)、紫外线照射2 h(照射距离约20 cm,温湿度同对照组)、新装修房间(温湿度与对照组相同)及乙醇、冰醋酸、甲醛环境。挥发性化学品实验环境的预备:分别将100 mL乙醇、冰醋酸、甲醛溶液放置于有透气小孔的纸箱中平衡15 min,形成相对稳定的化学品挥发环境,温湿度同对照组,晾干4 h。
研究组2:分别暴露在对照条件(同前)及7种不同甲醛浓度(包括:未稀释、1∶10、1∶25、1∶50、1∶100、1∶200、1∶400稀释)环境中4、18 h,甲醛挥发环境的预备同前。所有制备好的标本均放入密封袋中于4 ℃保存。
1.4 检测方法 用荧光分析法检测Phe和G6PD的浓度或酶活性,用时间分辨荧光法检测TSH、17α-OHP的浓度,操作步骤严格按照试剂盒说明书,用甲醛测量仪测定实验环境的甲醛浓度。
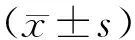
2 结果
2.1 血片制备环境对Phe、G6PD、TSH、17α-OHP检测结果的影响 见表1。11种环境下制备的血片Phe检测结果差异无统计学意义(P>0.05),G6PD、TSH、17α-OHP检测结果差异均有统计学意义(P均<0.05)。潮湿、紫外线照射和甲醛环境下制备的血片G6PD、TSH、17α-OHP检测结果均低于对照组(P均<0.05)。37 ℃烘箱、新装修房间、乙醇、冰醋酸环境下制备的血片G6PD检测结果均低于对照组(P均<0.05)。冷风吹干和2~8 ℃冷库过夜环境下制备的血片检测结果与对照组比较,差异无统计学意义(P>0.05)。
2.2 不同稀释比例甲醛放置15 min、4 h、18 h后环境中甲醛析出水平 甲醛析出浓度与稀释比例呈负相关(r=-0.986,P<0.05)。甲醛析出水平见表2。
2.3 不同甲醛浓度环境对Phe、G6PD、TSH、17α-OHP检测结果的影响 4项检测结果与甲醛浓度及暴露时间呈负相关(Phe,r=-0.821,P<0.05;G6PD,r=-0.851,P<0.05;TSH,r=-0.957,P<0.05;17α-OHP,r=-0.848,P<0.05)。不同浓度甲醛环境下所制备的干滤纸血片4项检测结果差异均有统计学意义(P均<0.05)。不同时间检测Phe结果差异无统计学意义(P>0.05),且甲醛浓度与检测时间不存在交互作用(P>0.05)。不同时间检测G6PD、TSH、17α-OHP结果差异有统计学意义(P<0.05),对于G6PD与TSH,甲醛浓度与检测时间存在交互作用(P<0.05),对于17α-OHP,甲醛浓度与检测时间不存在交互作用(P>0.05)。新鲜干滤纸血片暴露在不同甲醛环境中4、18 h后检测结果见图1。
表1 11种环境下制备的血片中Phe、G6PD、TSH、17α-OHP的检测和统计学结果
注:*,与对照组比较,P<0.05。
表2 不同稀释比例的甲醛放置15 min、4 h、18 h后环境中甲醛浓度(ppm)
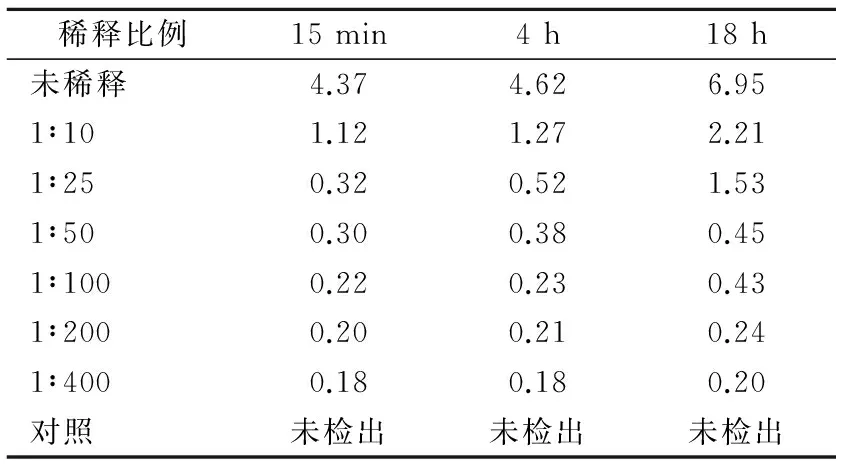
稀释比例15min4h18h未稀释4.374.626.951∶101.121.272.211∶250.320.521.531∶500.300.380.451∶1000.220.230.431∶2000.200.210.241∶4000.180.180.20对照未检出未检出未检出
3 讨论
我国当前采用传统生化方法筛查新生儿疾病的项目主要包括Phe、G6PD、TSH和17α-OHP[8-9]。研究表明,干滤纸血片的制备环境与检测指标的稳定性显著相关[4-5]。Golbahar等[6]报道,Phe对高温、高湿环境不敏感,而本研究显示Phe对纳入实验的所有理化因素均不敏感,只有标本长时间暴露在高浓度甲醛环境下才产生影响,说明Phe性质较稳定,不易受标本制备环境的理化因素影响。对于G6PD,既往研究多集中于环境温度、湿度与酶活性的关系[7-10]。本研究显示,G6PD活性除对温湿度敏感外,还受甲醛等多个因素影响,说明G6PD活性极不稳定,需要严格控制标本采集与制备环境。TSH与17α-OHP检测原理的本质均基于抗原抗体反应,但对环境因素的耐受性不完全一致。实验观察到二者虽然均受甲醛、紫外线照射、湿度的影响,但TSH较17α-OHP更敏感。分析原因可能为17α-OHP是一种酮类物质,分子量较小,而TSH是一种大分子糖蛋白,对不良因素的耐受性更低。李明训等[11]报道太阳暴晒会使TSH变性并吸附在滤纸上,导致洗脱不全而影响检出,这也是甲醛环境下制备干滤纸血片的TSH与17α-OHP检测值显著降低的主要原因。在基于TSH的研究中,有学者认为潮湿会造成血液稀释而导致检测结果偏低[11]。本研究显示,潮湿仅对G6PD、TSH和17α-OHP产生显著影响,而Phe未发生明显变化,“血液稀释”的观点不足以解释。其原因可能是潮湿会破坏蛋白的稳定性,导致酶活性或抗原抗体结合效率下降而使检测值降低。
在本次观察的理化指标中,甲醛是导致G6PD、TSH与17α-OHP检测值降低的最显著因素。众所周知,甲醛是新装修环境析出的主要污染物之一,且不同材料中的甲醛析出浓度不一。对于血片制备环境中甲醛析出的安全浓度,尚未见相关报道。本研究表明,当血片制备环境的甲醛浓度达0.30~0.38 ppm时,仅暴露4 h或0.21~0.24 ppm甲醛环境中暴露18 h,就显著影响G6PD酶活性,提示必须严格管控血片制备环境的甲醛析出浓度并减少血片在污染环境的暴露时间。因此,建议血片制备环境的甲醛析出浓度应控制在0.2 ppm以下。另外,冷风快速吹干或在2~8 ℃冷库过夜制备的血片检测结果与对照组差异无统计学意义,提示当遇到不能用标准方法制备血片的特殊情况时,可采用上述两种方式作为新生儿疾病筛查标本制备的备选方法。
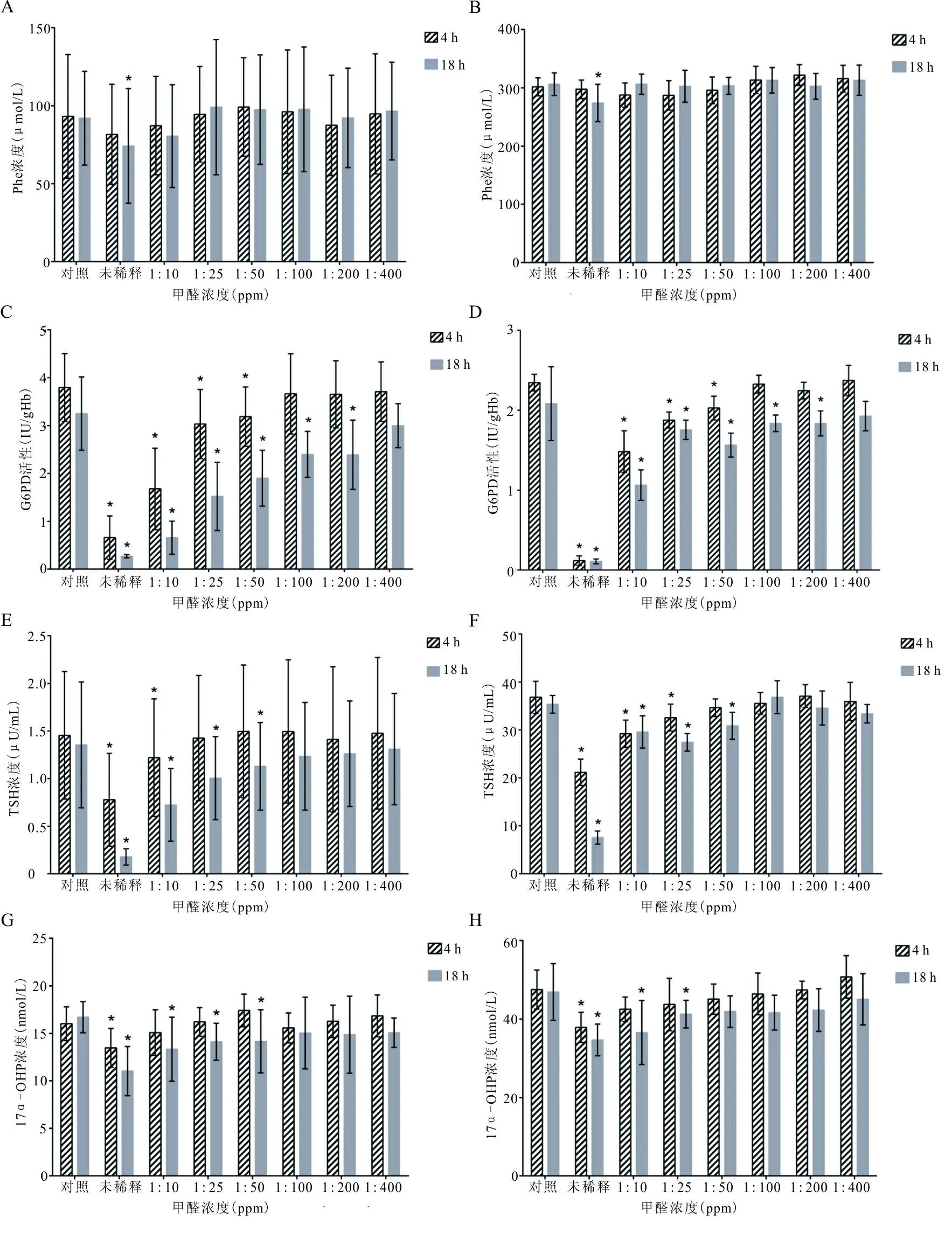
注:A、C、E、G,正常标本;B、D、F、H,阳性标本;*,与对照组比较,P<0.05。
图1 不同甲醛浓度环境下制备的新鲜干滤纸血片Phe、G6PD、TSH、17α-OHP检测结果
[1]El-Hattab AW. Inborn errors of metabolism[J]. Clin Perinatol,2015,42(2):413-439.
[2]García-Cazorla A, Wolf NI, Serrano M,etal. Mental retardation and inborn errors of metabolism[J]. J Inhert Metab Dis,2009,32(5):597-608.
[3]段义飞,崔亚利,江咏梅.干血斑用于新生儿遗传代谢病筛查的方法学进展[J].中华检验医学杂志,2015,38(4):220-222.
[4]Elbin CS, Olivova P, Marashio C A,etal. The effect of preparation, storage and shipping of dried blood spots on the activity of five lysosomal enzymes[J]. Clin Chim Acta,2011,412(13-14):1207-1212.
[5]Adam BW, Orsini JJ, Martin M,etal. The preparation and storage of dried-blood spot quality control materials for lysosomal storage disease screening tests[J]. Clin Biochem,2011,44(8-9):704-710.
[6]Golbahar J, Altayab DD, Carreon E. Short-term stability of amino acids and acylcarnitines in the dried blood spots used to screen newborns for metabolic disorders[J]. J Med Screen,2014,21(1):5-9.
[7]章印红,朱宝生,王瑞红,等. 存储温度和时间对滤纸片干血斑标本葡萄糖-6-磷酸脱氢酶活性的影响[J]. 中华妇幼临床医学杂志,2008,4(6):563-566.
[8]梁晓威,杨冰,孙亦骏,等. 时间分辨荧光免疫分析法检测干血滤纸片17α-羟孕酮的影响因素分析[J]. 临床检验杂志,2013,31(1):9-10.
[9]章晓燕,王薇,赵海建,等. 我国2015年新生儿遗传代谢病筛查指标切值的调查[J]. 临床检验杂志,2016,34(9):706-709.
[10]Freer DE. Observations on heat/humidity denaturation of enzymes in filter-paper blood spots from newborns[J]. Clin Chem,2005,51(6):1060-1062.
[11]李明训,陈西贵,李文杰,等. 新生儿筛查滤纸干血样测定的影响因素探讨[J]. 中华检验医学杂志,2001,24(6):339-341.
(本文编辑:王海燕)
Effects of physical and chemical factors in environment for dried blood spot preparation of neonatal screening assay
FANGKe-xin,SHANGShi-qiang,YANGJian-bin,ZHANGTing,HUZhen-zhen,TANGWei-wei,WUDing-wen
(CentralLaboratoryofNeonatalInheritedMetabolicDiseasesScreening,Children′sHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310052,Zhejiang,China)
Objective To investigate the effects of physical and chemical factors in the environment for dried blood sample (DBS) preparation of neonatal screening assay. Methods A total of 60 normal and 120 positive DBS were prepared under control and 10 different conditions. Another 30 normal and 80 positive DBS were prepared under control and 7 different concentration gradients of formaldehyde. The levels of phenylalanine (Phe), glucose-6-phosphate dehydrogenease (G6PD), thyroid stimulating hormone (TSH) and 17α-hydoxyprogesterone (17α-OHP) were tested by time-resolved fluorescence immunoassay or fluorescence assay. Statistical analysis was performed using SPSS 22.0 software. Results Compared with the control group, the results of Phe were not significantly different (P>0.05) when the samples were dried under the formaldehyde sensitive threshold (4.62 to 6.95 ppm for 18 hours). G6PD levels were significantly lowered when the samples were dried under all the conditions except for fast cold drying (2 to 8 ℃ overnight and formaldehyde condition, 0.30 to 0.38 ppm for 4 hours or 0.21 to 0.24 ppm for 18 hours). TSH and 17α-OHP levels were lowered obviously when the samples were dried under the conditions of humidity, UV and formaldehyde condition (TSH: 0.32 to 0.52 ppm for 4 hours, 0.38 to 0.45 ppm for 18 hours, 17α-OHP: 4.37 to 4.62 ppm for 4 hours, 0.38 to 0.45 ppm for 18 hours). The results of Phe, G6PD, TSH and 17α-OHP were not statistically different with the control group when the samples were dried under the fast cold drying and 2 to 8 ℃ overnight. Conclusion The physical and chemical factors in the environment of DBS preparation should be related to the accuracy of neonatal disease screening closely. The necessary control factors including formaldehyde, ethanol, glacial acetic acid, ultraviolet irradiation, heat, humidity and decoration pollution may exhibit significant effects on the preparation of DBS. Fast cold drying and overnight at 2 to 8 ℃ could be available for DBS preparation.
neonatal screening; dried blood spots; environment; factor; formaldehyde
浙江省医药卫生科技计划(2015KYA118)。
方可欣,1986年生,女,技师,硕士研究生,主要从事新生儿遗传代谢病筛查的实验室检测工作。
吴鼎文,E-mail:dingwenwu1@aliyun.com。
10.13602/j.cnki.jcls.2017.06.09
R446
A
2016-08-10)
