紫米营养功能成分及其游离态与结合态组成的HPLC/LC-MS分析
2017-07-05熊思慧何静仁李书艺金伟平祝振洲
杨 宁 熊思慧 - 何静仁 - 蔡 杰 李书艺 - 何 毅 金伟平 - 祝振洲 -
(武汉轻工大学食品科学与工程学院,湖北 武汉 430070)
紫米营养功能成分及其游离态与结合态组成的HPLC/LC-MS分析
杨 宁YANGNing熊思慧XIONGSi-hui何静仁HEJing-ren蔡 杰CAIJie李书艺LIShu-yi何 毅HEYi金伟平JINWEI-ping祝振洲ZHUZhen-zhou
(武汉轻工大学食品科学与工程学院,湖北 武汉 430070)
以墨江紫米为研究对象,采用CIE Lab、HPLC和LC-MS等分析技术并结合GB/T 5009.3—2010、5009.4—2010和5009.9—2008标准检测方法,全面地分析了紫米中基本营养成分和功能活性物质,并研究其呈色特征,同时对紫米多酚酸、黄酮和花色苷类物质的游离态与结合态组成进行鉴定和定量分析。结果表明:在基本营养成分方面,紫米与普通白米相比含量差异较大。紫米的蛋白质含量较白米高23%、灰分含量较白米高31%,而淀粉含量低于白米约15%。测色仪的色泽表征表明紫米和白米在色度、透明度等外观品质方面有极大的色差。紫米总花色苷和游离态与结合态总多酚、总黄酮的含量均高于白米,且以游离态的多酚和黄酮为主。HPLC、LC-MS分析结果表明,紫米酚酸黄酮类物质主要包括原儿茶酸、绿原酸、香草酸、咖啡酸、表儿茶素、p-香豆素、芦丁和阿魏酸等;花色苷主要为矢车菊素-3-葡萄糖苷、锦葵-3-葡萄糖苷和芍药-3-葡萄糖苷。研究结果可为墨江紫米品质评价与鉴定,以及后续营养功能性紫米食品的开发提供方法学参考和科学依据。
紫米;营养功能成分;多酚;黄酮;花色苷
稻谷在中国传统膳食中占有重要地位。随着人民生活水平提高,高营养、高附加值稻米品种愈受消费者青睐,有色稻米的潜在价值也备受重视。有色稻米不仅作为食材,也可作为新型营养功能性食品的一种重要原材料。紫米是一种天然“功能型”“营养型”“效益型”的珍稀谷类[1-2],是中国消费量最大的功能型稻米。明代李时珍《本草纲目》中早已记载食用,紫米具有“滋阴补肾、健脾暖肝、明目活血”等功效,其外观呈紫黑色,粒大而饱满,俗称“紫珍珠”[3]。
紫米中含有丰富的蛋白质以及花色苷、黄酮和酚酸类等生物活性物质,是一种功能型植物蛋白资源食品[4]。目前有关紫米的营养和功能性成分研究主要集中在其花青素类组成[5-6]及其生物活性方面[7-9],现已发现的黑米花色苷类物质以矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷为主,其他类含量相对较少[10]。然而,对其基本营养成分与功能成分的全面分析,尤其是对游离态和结合态多酚、黄酮类物质和花色苷组分全面分析研究鲜有报道[11-13]。Shen等[12]和叶玲旭等[13]发现黑色和红色糙米中游离酚含量和抗氧化能力高于普通糙米,且游离酚含量与米粒颜色相关,但其研究对象主要为稻米、糙米,且未对紫米主要营养成分进行测定,对其花色苷类物质也未进行组成和结构表征分析。本研究拟全面分析紫米中主要营养功能性成分及其组成,并采用高效液相色谱及色谱-串联质谱方法进一步分析游离态与结合态的酚酸、黄酮类物质及花色苷的组成,同时比较紫米与普通白米间呈色特征及营养功能性组分差异,为墨江紫米的品质评价及相关食品的深度开发利用提供科学参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
墨江紫米:墨紫1号,云南回归优质农特产品经贸有限公司;
普通白米:武汉常青农产品市场;
没食子酸、绿原酸、香草酸、咖啡酸、原儿茶酸标准品:纯度>98%,阿拉丁公司;
表儿茶素、芦丁、阿魏酸、白藜芦丁、p-香豆素:纯度>98%,美国Sigma公司;
乙腈、冰醋酸、甲酸、甲醇等:色谱纯,美国Fisher公司;
乙酸乙酯、正己烷:分析纯,国药集团化学有限公司。
1.1.2 主要仪器设备
高速万能粉碎机:FW80 微型,郑州科丰仪器有限公司;
台式分光测色仪:UItraScan VIS型,美国HunterLab公司;
超声波清洗机:SB-2500 DTN型,宁波新芝生物科技股份有限公司;
旋转蒸发仪:R-3型,瑞士Buchi公司;
液相色谱-质谱联用仪:LTQ XL型,美国赛默飞世尔科技有限公司;
凯氏定氮仪:UDK 159型,北京盈盛恒泰科技有限责任公司。
1.2 试验方法
1.2.1 样品前处理方法 将紫米样品粉碎,过40目筛,得到紫米米粉,置于干燥器中备用(-20 ℃冰箱备用)。
1.2.2 总花色苷的提取 准确称量紫米粉5 g,用50 mL 70%的乙醇(pH=2)溶液50 ℃水浴浸提,重复提取2次,合并有机相,过G2砂芯漏斗,真空旋转蒸发后定容。
1.2.3 游离态酚酸的提取 根据文献[14]修改如下:取10 g紫米粉加入100 mL正己烷置于锥形瓶中超声脱脂3次,每次20 min,脱脂后紫米粉在通风橱放置12 h以除掉残余正已烷,取3 g脱脂紫米粉加入30 mL 80%甲醇溶液30 ℃超声提取3次,每次1 h,合并上清液,减压浓缩至20 mL,浓缩液用等体积的乙酸乙酯振荡萃取5次,合并有机相,减压干燥后用80%甲醇定容至10 mL,置于-20 ℃冰箱待测。
1.2.4 结合态酚酸的提取 根据文献[15]修改如下:收集1.2.3中由80%甲醇溶液提取后所余沉淀部分,用40 mL 2 mol/L NaOH溶液在室温下充氮搅拌4 h,用6 mol/L HCl酸化至pH=2,用乙酸乙酯重复萃取5次,合并有机相,减压蒸发至干,用80%甲醇定容至10 mL,置于-20 ℃冰箱待测。
1.2.5 一般指标测定
(1) 水分含量:按GB/T 5009.3—2010执行。
(2) 灰分含量:按GB/T 5009.4—2010执行。
(3) 总淀粉含量:按GB/T 5009.9—2008的酶水解法执行。
1.2.6 总蛋白含量的测定 精密称量0.2 g样品放入消化管,加入0.2 g硫酸铜,6 g硫酸钾及15 mL浓硫酸,在40 ℃ 10 min、270 ℃ 1.5 h、480 ℃ 2 h 条件下于VELP自动消化炉中消化。待消化管冷却置至室温,装入VELP全自动凯式定氮仪,使用33% NaOH溶液、4%硼酸溶液蒸馏及接受氮气,用0.1 mol/L 标定的HCl溶液滴定,试验中蛋白质的转换系数为6.25,试验结果由仪器自动计算。
1.2.7 颜色的表征 根据文献[16]修改如下:普通大米、紫米磨粉,过100目筛,充分混均,用色差仪测定紫米的L*、a*、b*等值并分析数据,L*代表亮度, +a*和-a*分别表示红色、绿色,+b*和-b*分别表示黄色、蓝色。
1.2.8 紫米总花色苷含量的测定 根据文献[17]修改如下:采用pH示差法测量紫米花色苷的含量,首先取紫米花色苷提取液在波长为400~700 nm范围内进行紫外全扫描,确定紫米花色苷提取液的最大吸收波长为λmax。然后将1 mL的紫米浓缩液分别用pH 1.0缓冲液(0.2 mol/L HCl∶0.2 mol/L KCl∶H2O,体积比25∶67∶8)和pH 4.5的缓冲液稀(CH3COOH∶CH3COONa∶H2O,体积比0.98∶1.80∶97.22)定容到10 mL,室温下平衡20 min,分别测定两种样品稀释液在λmax和700 nm处的吸光值。总花色苷含量按式(1)计算:

(1)
式中:
C——总花色苷含量,mg Cy-3-glc/g;
A——吸光度;
V——提取液总体积,mL ;
n——稀释倍数;
M——矢车菊-3-葡萄糖苷(Cy-3-glc)的相对分子质量,449.4;
ε——Cy-3-glc消光系数,26 900;
m——样品质量,g。
1.2.9 HPLC-MS分析 将花色苷提取液用等体积的乙酸乙酯振荡萃取3次,合并水相层,过AB-8大孔吸附树脂纯化处理,用70%乙醇溶液洗脱,收集洗脱液减压浓缩并定容至5 mL,过0.22 μm微孔滤膜,待HPLC-MS测定。
流动相条件见表1。色谱柱:Thermo Fisher反相C18色谱柱(100 mm×2.1 mm,1.9 μm),柱温 25 ℃,检测器使用DAD,进样体积10 μL,流速150 μL/min,检测波长520 nm。
MS参数:采用ESI正离子扫描模式,毛细管温度350 ℃;毛细管电压26 V;N2流速20 L/min。

表1 梯度洗脱方法†Table 1 Gradient elution programme
† 流动相A为0.3%甲酸水溶液,流动相B为体积比0.3∶30∶69.7的甲酸—乙腈—水溶液。
1.2.10 黄酮含量测定 以芦丁做对照,采用Al(NO3)3-NaNO2-NaOH比色法分别对紫米中游离态和结合态酚类物质提取物进行总黄酮含量测定,以浓度C(μg/mL)为横坐标,吸光度A为纵坐标绘制标准曲线[18]。
1.2.11 总酚含量的测定 以没食子酸作对照,采用Folinlin-Ciocalteu法分别对紫米中游离态和结合态酚类物质提取物进行总酚含量测定,以浓度C(μg/mL)为横坐标,吸光度A为纵坐标绘制标准曲线[19]。
1.2.12 酚类物质HPLC分析 标准曲线建立:用80%甲醇溶液配置10种多酚类物质标准品混合溶液(没食子酸、绿原酸、香草酸、咖啡酸、原儿茶酸、表儿茶素、芦丁、阿魏酸、白藜芦丁、p-香豆素),分别考察其峰面积和浓度之间的线性回归关系,建立标准曲线。
HPLC条件:Alltima C18色谱柱(250 mm×4.6 mm,5 μm)。柱温:30 ℃。检测波长:280 nm与320nm。流速:0.8 mL/min。流动相:A为水∶乙酸(体积比99.5∶0.5),B为乙腈∶水(体积比50∶50),见表2。

表2 梯度洗脱方法Table 2 Gradient elution programme
2 结果与分析
2.1 基本营养成分分析
由表3可知:紫米与普通白米水分含量基本一致;紫米中蛋白质含量较白米高23%、灰分含量较白米高31%,而总淀粉含量低于白米约15%,因此,在基本营养成分方面,紫米与普通白米含量差异较大。

表3 紫米和白米的基本成分含量Table 3 The basic composition of purple rice %
2.2 颜色表征
由表4可知:白米的透明度L*远高于紫米;紫米红色值a*>白米a*;紫米的黄色值b*>白米b*;c*值越高表明颜色越鲜艳,紫米粉c*<白米c*,表示紫米的颜色较白米黯淡;紫米色调h与白米h有明显的差异;△E*为色泽的总体变化差值,紫米△E*大于白米△E*,表明紫米和白米有较大的色泽差。
紫米和白米颜色表征结果能有效反映两类稻米的物理特性——颜色差异,可为稻米外观品质差异化评价提供有效的参考依据。
2.3 主要功能性成分及其组成鉴定的分析
2.3.1 总花色苷、总酚和总黄酮含量分析 由表5可知:紫米中花色苷、总酚和总黄酮含量均高于白米。白米中基本不含花色苷,紫米中总花色苷的含量为2.51 mg Cy-3-glc /g;紫米中游离态多酚含量高于结合态3倍,游离态黄酮含量高于结合态9倍,结果与Shen等[12-13]对有色稻米中游离态多酚和黄酮研究结果相近;与李青等[20]对稻谷壳中游离和结合态多酚、黄酮类物质研究比较,谷壳中结合态酚类和黄酮类比例较高,可能与稻谷品种以及多酚、黄酮分布有关。紫米游离态多酚和黄酮含量分别为5.44 mg GAE/g和2.93 mg RE/g,显著高于白米游离态多酚和黄酮含量0.37 mg GAE/g和0.18 mg RE/g;紫米结合态多酚和黄酮含量1.98 mg GAE/g和0.33 mg RE/g,也明显高于白米结合态多酚和黄酮含量0.31 mg GAE/g和0.20 mg RE/g。紫米中功能性物质具有较强的氧自由基清除能力、抗氧化活性和降血脂功效[21-22],试验所测墨江紫米中3种主要功能性物质含量不仅高于普通白米,其总酚含量也远高于其他三大主粮作物(小麦、玉米、马铃薯)[23-26],且与其他有色农产品相比,紫米总花色苷含量也相对较高[27]。
†L*为透明度;a*为红色值,b*为黄色值,c*为颜色纯度,h为色调值,△L*为明度差异,△E*为色差值。

表5 紫米主要功能性物质的含量Table 5 Concentration of functional active substances from purple rice
2.3.2 紫米酚酸黄酮类成分的组成分析 采用1.2.9 HPLC法同时测定样品中10种酚酸黄酮类物质,混合标准品色谱图见图1,10种酚酸黄酮类物质色谱峰分离度较好。
分别对紫米中游离态和结合态酚酸黄酮类物质进行分析,结果表明,紫米中原儿茶酸、香草酸、绿原酸、咖啡酸、表儿茶素、p-香豆素、芦丁和阿魏酸在游离态和结合态中均有检出。游离态多酚类物质中含量最高的是原儿茶酸(14.48 mg/100 g),其次是香草酸(6.59 mg/100 g)和阿魏酸(2.41 mg/100 g),在结合态酚类物质中含量最高的分别是阿魏酸(30.21 mg/100 g)、香草酸(4.53 mg/100 g)和绿原酸(2.38 mg/100 g)。
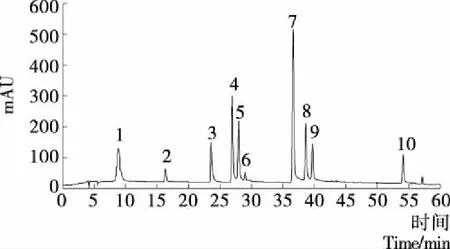
1. 没食子酸 2. 原儿茶酸 3. 绿原酸 4. 香草酸 5. 咖啡酸 6. 表儿茶素 7.p-香豆素 8. 芦丁 9. 阿魏酸 10. 白藜芦醇
图1 10种酚酸黄酮类混合标准品的HPLC
色谱图(280 nm)Figure 1 HPLC chromatograms of a standard mixture of phenolics andflavonoids(280 nm)
由表6可知,墨江紫米所含酚酸黄酮类物质较为丰富,在所测得8种酚酸黄酮类物质中,咖啡酸、表儿茶素和p-香豆素游离态含量与其结合态含量基本一致,而其他组分游离态和结合态含量具有较大差异,特别是结合态阿魏酸含量较其游离态高15倍。稻谷中酚酸种类繁多,主要由对羟基苯甲酸和对羟基肉桂酸衍生物组成,种类随着分子结构中苯环上羟基数量和取代位置的不同而变化[20],试验结果与叶玲旭等[13]对有色糙米中酚类组分分析结果比较发现,墨江紫米中含有表儿茶素,但没有测出没食子酸;其他酚类组成基本一致,但各组分含量略有不同,可能是与稻米品种和生长环境有关。

表6 紫米中酚酸黄酮类物质的含量Table 6 The content of phenolics andflavonoids in purple rice mg/100 g
2.3.3 紫米中花色苷类物质的组成分析 对紫米中花色苷类物质进行HPLC-MS分析,所得色谱图见图2,通过对主要3个色谱峰进行一级和二级质谱扫描,结果见图3~5。
色谱峰1(Rt=6.94 min),分子离子m/z为449,二级质谱显示分子离子m/z为449失去一分子葡萄糖 [M-162]+得碎片离子m/z287,质谱信息可知m/z287是矢车菊素,可推断峰1是矢车菊素-3-葡萄糖苷。
色谱峰2(Rt=10.05 min),分子离子m/z为463,二级质谱显示分子离子m/z为463失去一分子葡萄糖 [M-162]+得碎片离子m/z301,质谱信息可知m/z301是芍药素。因此,峰2是芍药素-3-葡萄糖苷。
色谱峰3(Rt=11.88 min),分子离子m/z为493,二级质谱显示分子离子m/z为493失去一分子葡萄糖 [M-162]+得碎片离子m/z331,质谱信息可知m/z331是锦葵花色素。因此,推断峰3是锦葵-3-葡萄糖苷。
由图2可知,试验所测墨江紫米中3种花色苷成分以矢车菊素-3-葡萄糖苷为主,与张名位等[6]报道结果一致,但未测出天竺葵-3,5-二葡萄糖苷等其他种类花色苷,可能是墨江紫米品种及生长环境差异。

1. 矢车菊素-3-葡萄糖苷 2. 芍药-3-葡萄糖苷 3. 锦葵-3-葡萄糖苷图2 紫米花色苷的HPLC图谱Figure 2 HPLC chromatograms of the anthocyanin extracts from purple rice
3 结论
(1) 紫米与普通白米水分含量基本一致,但灰分、总蛋白质和总淀粉含量差异较大:紫米中蛋白质含量较白米高23%、灰分含量较白米高31%,而总淀粉含量明显低于白米约15%;测色仪的色泽表征表明紫米和白米在色度、透明度等外观品质方面有极大的色差。
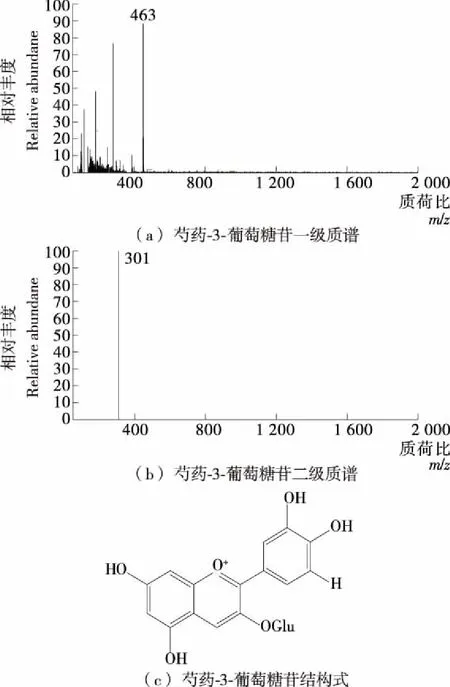
图4 峰2的一级、二级质谱图及芍药素-3-葡萄糖苷结构式Figure 4 Mass spectrum of peak 2 structure of Peonidin-3-O-glucoside

图5 峰3的一级、二级质谱图及锦葵-3-葡萄糖苷结构式Figure 5 Mass spectrum of peak 3 structure of Mallow 3-glucoside
(2) 紫米中花色苷、总酚和总黄酮含量均高于白米:紫米中总花色苷的含量为2.51 mg Cy-3-glc /g,而白米中基本不含花色苷;紫米中多酚和黄酮类物质主要以游离态形式为主,紫米游离态多酚含量为5.44 mg GAE/g,显著高于白米中游离酚含量0.37 mg GAE/g;紫米游离酚提取物中黄酮含量2.93 mg RE/g,也明显高于白米中黄酮含量0.33 mg RE/g。
(3) 紫米酚酸及黄酮类物质主要包括原儿茶酸、绿原酸、香草酸、咖啡酸、表儿茶素、p-香豆素、芦丁和阿魏酸等;花色苷主要由矢车菊素-3-葡萄糖苷、锦葵-3-葡萄糖苷和芍药-3-葡萄糖苷组成。
[1] 曹桂琼. 墨江紫米产业发展思考[J]. 云南农业, 2015(4): 51-53.
[2] 杨志生. 浅谈墨江紫米黄酒生产工艺[J]. 科技致富向导, 2011(23): 147-148.
[3] 李丽君, 刘传光, 陈友订, 等. 有色稻米的保健功能及研究现状[J]. 广东农业科学, 2012(21): 11-17.
[4] 梁征, 熊思慧, 何静仁, 等. 紫米蛋白-多酚复合物的结构组成及分子形貌[J]. 食品科学, 2016, 37(21): 85-90.
[5] PARK, YOUNG S, CHANG Hyo-Ihl. Isolation of anthocyanin from black rice(Heugjinjubyeo) and screening of its antioxidant activities[J]. Korean Joumal of Micmbiology and Biotechnology, 2008, 36(1): 55-60.
[6] 张名位, 郭宝江, 张瑞芬. 黑米抗氧化活性成分的分离纯化和结构鉴定[J]. 中国农业科学, 2006, 39(1): 153-160.
[7] YANG Yan, ANDREWS M C, HU Yan, et al. Anthocyanin extract from black rice significantly ameliorates platelet hyperactivity and hypertriglyceridemia in dyslipidemic rats induced by high fat diets[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 6 759-6 764.
[8] THUMMAYOT S, TOCHARUS C, PINKAEW D, et al. Neuroprotective effect of purple rice extract and its constituent against amyloid beta-induced neuronal cell death in SK-N-SH cells[J]. Neurotoxicology, 2014, 45: 149-158.
[9] TANAKA J, NAKANISHI T, SHIMODA H, et al. Purple rice extract and its constituents suppress endoplasmic reticulum stress-induced retinal damage in vitro and in vivo[J]. Life Sciences, 2013, 92(1): 17-25.
[10] 杨加珍, 曾亚文, 杜娟, 等. 紫黑米种质功能成分综合研究与利用[J]. 生物技术进展, 2015(1): 47-53.
[11] MIN B, GU Li-wei, MCCLUNG A M, et a1. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (Oryza sativa L.) of different bran colollrs[J]. Food Chemistry, 2012, 133(3): 715-722.
[12] SHEN Yun, JIN Liang, XIAO Peng, et a1. Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J]. Journal of Cereal Science, 2009, 49(1): 106-111.
[13] 叶玲旭, 刘兴训, 马晓军, 等. 不同颜色糙米的酚类物质组成及抗氧化活性分析[J]. 食品与发酵工业, 2016, 42(9): 75-80.
[14] HUANG Shao-hua,LEAN T N. Quantification of polyphenolic content and bioactive constituents of some commercial rice varieties in Taiwan[J]. Journal of Food Composition & Analysis, 2012, 26(1/2): 122-127.
[15] ZHANG Ming-wei, ZHANG Rui-Feng, ZHANG Fang-xuan, et al. Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural & Food Chemistry, 2010, 58(13): 7 580-7 587.
[16] 张晴, 陈勇, 李衫, 等. 黑米色素的吸收光谱及色差分析研究[J]. 食品科学, 1999(7): 12-17.
[17] LEE J, DURST R W, WROLSTAD R E, Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study[J]. Journal of AOAC International, 2005, 88(5): 1 269-1 278.
[18] 张清安, 史芳芳, 王袭, 等. 超声波处理对黑米酒中酚类物质、颜色及抗氧化性的影响[J]. 食品与机械, 2016, 32(12): 1-6.
[19] BONOLI M, MARCONI E, CABONI M F. Free and bound phenolic compounds in barley ( Hordeum vulgare, L) flours: Evaluation of the extraction capability of different solvent mixtures and pressurized liquid methods by micellar electrokinetic chromatography and spectrophotometry[J]. Journal of Chromatography A, 2004, 1 057(1/2): 1-12.
[20] 李青, 张名位, 张瑞芬, 等. 5种籼稻品种谷壳中游离态和结合态酚类物质含量及其抗氧化活性比较[J]. 中国农业科学, 2012, 45(6): 1 150-1 158.
[21] 张名位, 张瑞芬, 郭宝江, 等. 黑米皮提取物的抗氧化与降血脂作用及其成分分析[J]. 中国农业科学, 2006, 39(11): 2 368-2 373.
[22] 何婷. 黑米花青苷抗氧化活性研究进展[J]. 安徽体育科技, 2015, 36(4): 36-38.
[23] 邹红梅. 特殊粒色小麦种子籽粒营养成分分析与评价[D]. 雅安: 四川农业大学, 2015: 19-31.
[24] 王利珍, 赵嫦玲, 闫静, 等. 马铃薯皮总黄酮的提取及纯化[J]. 太原理工大学学报, 2011, 42(6): 598-602.
[25] 丁璇子, 王岸娜, 吴立根. 响应面法优化小麦麸皮中总酚含量的测定[J]. 粮食与油脂, 2016, 29(9): 37-41.
[26] 陈智毅, 徐玉娟, 尹艳, 等. 甜玉米多酚类成分的测定[J]. 食品科学, 2010, 31(10), 235-238.
[27] 蔡湛, 兰余, 赵淑娟, 等. 紫薯的抗氧化及活性成分研究[J]. 粮食与油脂, 2015, 28(1): 43-48.
Nutritional and functional components in purple rice and free and bond state compositions analyzed by HPLC/LC-MS
(SchoolofFoodScienceandEngineering,WuhanPolytechnicUniversity,Wuhan,Hubei430023,China)
CIE Lab, HPLC-DAD and LC-MS techniques, combined with the national standards methods were applied to determine the basic nutrient and functional compounds of purple rice, and compared with the white rice. HPLC-DAD was used to quantitative analyze the contents of phenolics and flavonoids, and the main kinds of anthocyanins were identified with LC-MS. As a result, there is a big difference on the content of basic nutritional compound: purple rice protein content is 23% higher than white rice, and ash content is 31% higher, but starch content is 15% lower than white rice. And great differences on color value, luminance and chromatic aberration have also been found by color spectrophotometer. On the other hand, purple rice has higher content of anthocyanin, total phenols and flavonoids than white rice, and mainly existed on free states. Based on HPLC and HPLC-MS method, the phenolic acids and flavonoids were analyzed, mainly including protocatechuic acid, chlorogenic acid, vanillic acid, caffeic acid, epicatechin,p-coumarin, rutin and ferulic acid, and anthocyanins are mainly knapweed-3-glucoside, mallow-3-glucoside and peony-3-glucoside. This study may provide experimental basis for further quality evaluation method and development research on functional active substances in the purple rice.
purple rice; nutritional and functional compositions; phenolics; flavonoids; anthocyanin
10.13652/j.issn.1003-5788.2017.04.006
