杏鲍菇多肽提取工艺优化及其抗氧化活性研究
2017-07-05孙亚男李文香胡欣蕾
孙亚男 - 李文香,2 -,2 胡欣蕾 - 李 铭 于 戈 张 欣
(1. 青岛农业大学食品科学与工程学院,山东 青岛 266109;2. 山东省应用真菌重点实验室,山东 青岛 266109)
杏鲍菇多肽提取工艺优化及其抗氧化活性研究
孙亚男1SUNYa-nan1李文香1,2LIWen-xiang1,2胡欣蕾1HUXin-lei1李 铭1LIMing1于 戈1YUGe1张 欣1ZHANGXin1
(1. 青岛农业大学食品科学与工程学院,山东 青岛 266109;2. 山东省应用真菌重点实验室,山东 青岛 266109)
杏鲍菇;菌丝;多肽;抗氧化

1 材料与方法
1.1 材料与试剂
杏鲍菇菌丝体:山东省应用真菌重点实验室培养;
Sephadex-50葡聚糖凝胶:北京Solarbio公司;
磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯化铁、邻二氮菲、H2O2溶液、邻苯三酚、三氯乙酸、盐酸、无水乙醇、2,2-二苯基-1-苦基苯肼(DPPH)等:均为分析纯。
1.2 仪器与设备
旋转蒸发仪:RE-2000A型,上海亚荣精华有限公司;
电子天平:EP114C型,上海精科天平有限公司;
离心机:TD4K-Z型,德国Eppendorf公司;
恒温水浴锅:XMTD-8222型,上海精宏有限公司;
分光光度计:424 UV1101型,日本岛津公司;
超净工作台:SW-CJ-2D型,苏州净化设备有限公司;
冷冻干燥机:LJG-10型,德国Christ公司。
1.3 试验方法
1.3.1 单因素试验
(1) pH值对杏鲍菇菌丝体多肽提取率的影响:配置pH分别为7.0,7.5,8.0,8.5,9.0的100 mmol/L磷酸盐缓冲液,以料液比1∶10 (g/mL),于4 ℃下浸提4 h,得到的粗提液测定蛋白含量,确定最佳提取pH。
(2) 提取时间对杏鲍菇菌丝体多肽提取率的影响:配置pH为6.5的100 mmol/L磷酸盐缓冲液,以料液比1∶10 (g/mL),于4 ℃下分别浸提2,4,6,8,10 h,得到的粗提液测定蛋白含量,确定最佳提取时间。
(3) 料液比杏鲍菇菌丝体多肽提取率的影响:配置pH为6.5的100 mmol/L磷酸盐缓冲液,分别以料液比1∶8,1∶10,1∶12,1∶14,1∶16 (g/mL),于4 ℃下浸提4 h,得到的粗提液测定蛋白含量,确定最佳提取料液比。
1.3.2 多因素综合模拟试验 以杏鲍菇菌丝体为原料,pH、提取时间和液料比为自变量,多肽提取率为响应值设计。
1.3.3 杏鲍菇菌丝体多肽的纯化 将上述所得杏鲍菇菌丝体提取液,用硫酸铵分级沉淀(30%,75%,100%),于4 ℃下,3 000 r/min离心20 min,得到蛋白沉淀,用去离子水溶解沉淀,将其于30 kDa透析膜进行透析,收集透析液,得到分子质量小于30 kDa纯净多肽。
1.3.4 杏鲍菇菌丝体多肽的分离 用Sephadex-50葡聚糖凝胶进行纯化。洗脱流速:每5 min 4~5 mL。
1.3.5 多肽抗氧化活性研究
(1) 多肽相对还原力的测定:在10 mL试管中加入不同浓度的多肽溶液各1.0 mL,然后加入磷酸盐缓冲液(0.2 mol/L, pH=6.6)3 mL和K3[Fe(CN)6](1%)溶液3 mL,水浴温度保持在50 ℃,反应20 min。反应结束后冷却,再加入10%三氯乙酸溶液2.5 mL混匀,3 000 r/min离心10 min。离心完毕后,试管中依次加入2.5 mL上清液、2.5 mL蒸馏水和0.5 mL 0.1% FeCl3溶液,反应10 min(条件为室温),然后测吸光度(波长为700 nm)[7],以抗坏血酸和BHT作对照。

(1)
式中:
H——清除率,%;
A1——邻苯三酚自氧化速率;
A2——加多肽液后邻苯三酚的自氧化速率。
(3) 多肽对·OH的清除能力测定:取不同浓度的多肽溶液1.0 mL,加入浓度9 mmol/L FeSO4溶液和浓度9 mmol/L水杨酸-乙醇溶液各1.0 mL,混匀后加入1.0 mL 8.8 mmol/L H2O2启动反应,37 ℃水浴30 min,于510 nm处测定吸光值。空白对照为蒸馏水代替水杨酸[9],以抗坏血酸和BHT作对照。清除率按式(2)计算:

(2)
式中:
S——清除率,%;
A0——空白对照液的吸光度;
A1——加入多肽溶液后的吸光度;
A2——无显色剂时多肽的自身吸收值。
(4) 多肽对DPPH自由基的清除能力测定:1.0 mL多肽溶液和4.0 mL DPPH混合为反应体系,1.0 mL 50%乙醇溶液和4.0 mL多肽溶液混合为空白组,1.0 mL 50%乙醇溶液和4.0 mL DPPH混合为对照组[9],将各组静置室温暗处,反应30 min,测吸光值(517 nm),以抗坏血酸和BHT作对照。清除率按式(3)计算:

(3)
式中:
F——清除率,%;
A1——多肽溶液吸光值;
A2——空白组吸光值;
A3——对照组吸光值。
1.3.6 数据分析 所有试验进行3次重复。试验数据采用Origin 8.0和SPSS 17.0软件进行处理和差异显著性分析,以平均值±标准差(x±s)表示,P<0.05表示具有统计学意义[10]。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 pH对多肽提取率的影响 由图1可知,随着缓冲液pH值的增大,杏鲍菇菌丝体多肽的提取率先增大后减小,在pH值为8.5时,提取率最大,pH值大于8.5后提取率逐渐下降,可能是碱性增强会使蛋白变性。所以,提取pH值为8.5时较为合适。
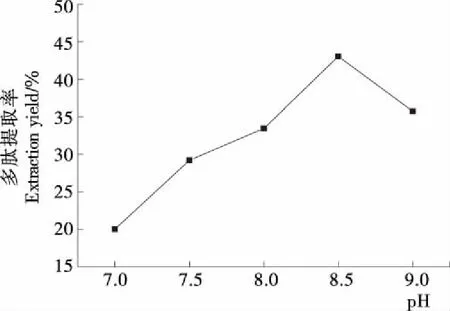
图1 pH值对多肽提取率的影响Figure 1 Effect of pH on extraction yield of polypeptide
2.1.2 提取时间对多肽提取率的影响 由图2可知,提取时间对杏鲍菇菌丝体多肽的提取率有一定的影响。随着提取时间的延长,多肽的提取率先增加后减小,提取4 h时多肽提取率达到最大值,4 h后多肽提取率逐渐下降,这是因为随着提取时间的延长杏鲍菇菌丝体粉末内的蛋白质充分溶出,在提取4 h后多肽提取率随时间延长而减少,可能是长时间的浸提造成部分多肽链断裂损失,从而影响蛋白提取率,所以提取4 h较为合适。

图2 提取时间对多肽提取率的影响Figure 2 Effect of extract time on extraction yield of polypeptide
2.1.3 料液比对多肽提取率的影响 料液比是影响杏鲍菇菌丝体多肽提取率的另一重要因素。由图3可知,随着料液比的增加,多肽的提取率先增加后减小,当料液比为1∶12 (g/mL)时多肽提取率达到最大值,随后多肽提取率逐渐下降,这是因为溶剂较少时,蛋白扩散阻力较大,溶出率小,随着溶剂用量的增加,蛋白更容易溶入溶剂中,提取率随之增加,当溶剂用量过大时,部分溶质会残留在水相中造成损失,而且不利于后续的减压浓缩,增加提取成本,这与罗璇等[10]的研究结果相一致,综合考虑,提取料液比为1∶12 (g/mL)较为合适。

图3 料液比对多肽提取率的影响Figure 3 Effect of liquid-to-material ratio on extraction yield of polypeptide
2.2 响应面试验结果及分析
根据试验因素和水平的要求,设计试验因素水平见表1,试验设计及结果见表2,将所得的数据用Design-Expert 8.0.6软件分析,以提取时间、pH值和液料比为自变量,以多肽提取率Y为因变量建立提取杏鲍菇菌丝体多肽工艺的二次回归方程,方程为:

(4)

表1 响应面试验因素水平表Table 1 Factors and levels in BBD

表2 Box-Benhnken试验设计及结果Table 2 BBD and corresponding results for response surface
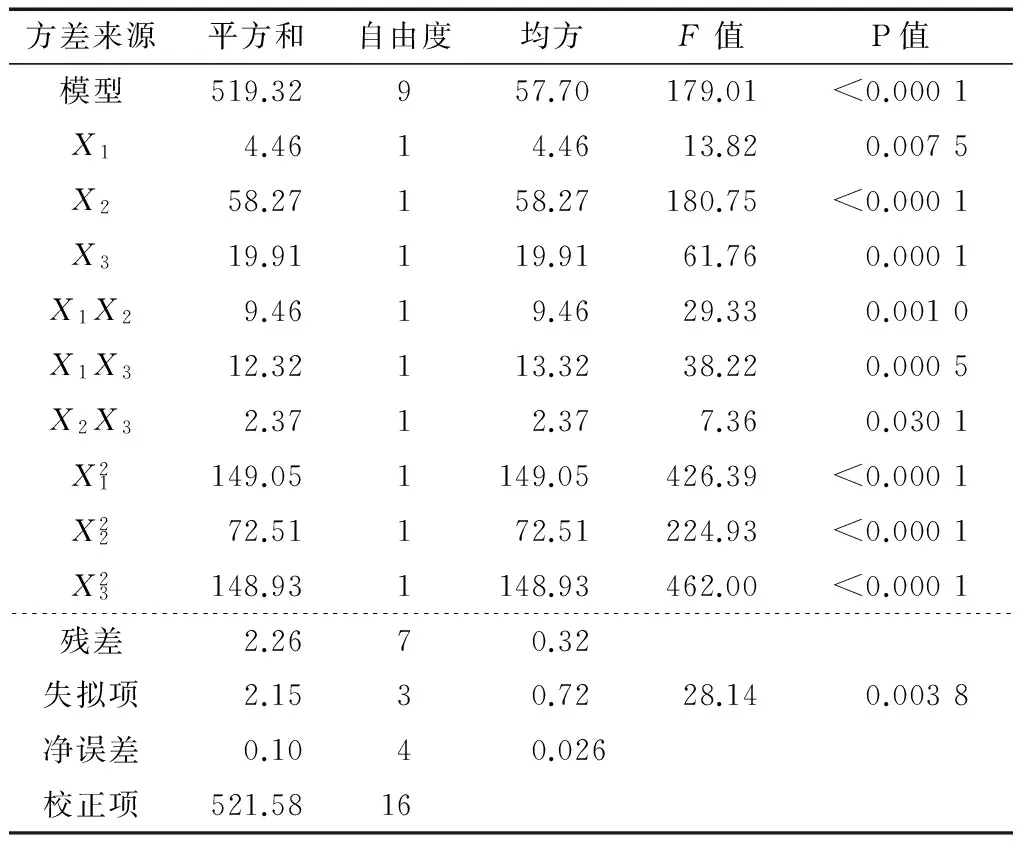
表3 BBD方差分析结果†Table 3 BBD variance analysis results

2.3 响应面交互作用分析
如图4所示,响应面坡度较为陡峭,等高线相对较为密集,表明响应值(多肽提取率)对两两因素交互作用的改变较为敏感,等高线沿pH值轴变化的趋势明显高于浸提时间轴和料液比轴;等高线沿料液比轴变化的趋势明显高于浸提时间轴。由此推知,各因素对杏鲍菇菌丝体多肽提取率的影响程度从大到小依次为:pH值>料液比>提取时间。响应面曲线越陡,说明所对应因素对响应值的影响也越显著,这和方差分析的结果相一致。各因素在所选取的范围内均能得到最佳响应值,说明各因素所选择的试验范围合理有效。
2.4 响应面模型的验证
利用响应面分析得到杏鲍菇菌丝体多肽提取工艺的最佳组合为pH值8.85,料液比1∶11.86 (g/mL),提取时间4.17 h,最高多肽提取率预测值为50.88%。出于对实际操作可行性考虑,验证实验需根据实际试验条件稍加修改为:pH值8.9,料液比1∶11.9 (g/mL),提取时间4.2 h,多肽提取率实际值为(50.76 ± 0.05)%,相对误差0.24%,实验值和预测值之间有很好的一致性,因此,该模型较准确可靠。
2.5 杏鲍菇菌丝体多肽的鉴定
由图5可知,杏鲍菇菌丝体提取液在220 nm处有最大吸收峰,与标准蛋白溶液相一致(肽键吸收波长200~230 nm),所以该提取液为蛋白提取液。
2.6 杏鲍菇菌丝体多肽的纯化
由图6可知,经过Sephadex-50葡聚糖凝胶过滤后的杏鲍菇菌丝体多肽溶液经蒸馏水洗脱后,洗脱曲线上出现了2个明显的波峰,分别在10 min和40 min左右。在10 min出现的波峰可能为相对分子量较大的肽,所以先被洗脱下来,后出现的波峰可能为较小分子的肽。之后的溶液在595 nm下几乎无吸收值,可知多肽已全被洗脱下来。分别收集2个多肽组分,进行其抗氧化活性的研究。

图4 各两因素交互作用对多肽提取率影响的曲面图和等高线图Figure 4 Response surface showing the effects of four variables on the extraction yield of polypeptide

图5 杏鲍菇菌丝体多肽和标准蛋白紫外扫描Figure 5 Pleurotus eryngii mycelium polypeptide and standard sample UV scan

图6 杏鲍菇菌丝体多肽Sephadex-50葡聚糖 凝胶层析图(595 nm)Figure 6 The Sephadex-50 chromatography of Pleurotuseryngii mycelium polypeptide
2.7 多肽抗氧化活性分析
2.7.1 杏鲍菇菌丝体多肽相对还原力的测定 杏鲍菇菌丝体多肽的还原能力可以作为其潜在抗氧化活性的重要指标[13]。由图7可知,在0.1~1.0 mg/mL有效质量浓度范围内,随着质量浓度的增大,两个菌丝体多肽组分还原能力逐渐增强,虽然其还原能力显著低于同浓度的VC,但是Fr.1的还原力显著高于同浓度BHT的还原能力(P<0.05),Fr.2的还原力与同浓度BHT的还原能力差异不显著(P>0.05);在1 mg/mL浓度时,Fr.1的还原力约为同浓度VC还原力的50%,因此,从杏鲍菇菌丝体中提取的多肽Fr.1具有较强的还原力。
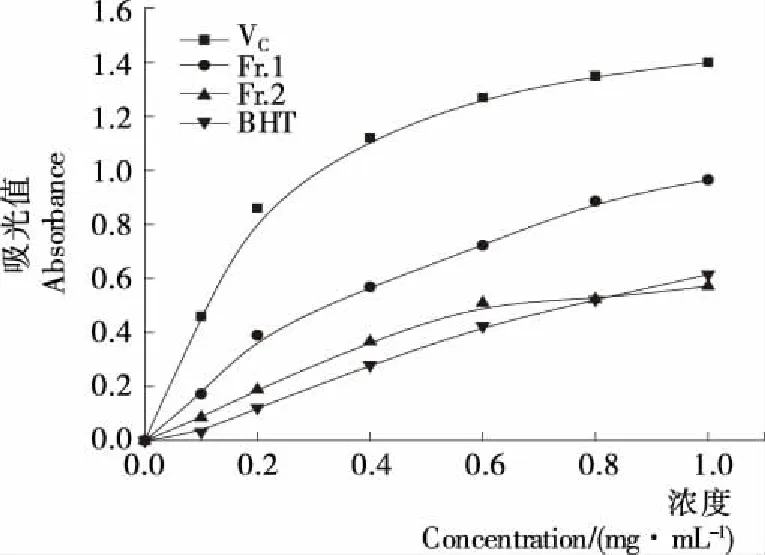
图7 杏鲍菇菌丝体多肽还原力(700 nm)Figure 7 Reducing power of Pleurotus eryngiimycelium polypeptide

图8 杏鲍菇菌丝体多肽对•的清除能力Figure 8 Scavenging effects of Pleurotus eryngiimycelium polypeptide on • radicals


图9 杏鲍菇菌丝体多肽对·OH的清除能力Figure 9 Scavenging effects of Pleurotus eryngiimycelium polypeptide on ·OH radicals
2.7.4 多肽对DPPH·的清除能力测定 由图10可知,随着多肽浓度的增加,其对DPPH·的清除能力逐渐增强,在浓度达到0.4 mg/mL以后,清除率基本保持稳定。相同浓度下,多肽Fr.1对DPPH·的清除率显著高于BHT和Fr.2,低于VC;Fr.2对DPPH·的清除率显著高于BHT(P<0.05)。因此,可以推断杏鲍菇菌丝体多肽具有清除DPPH·的能力。

图10 杏鲍菇菌丝体多肽对DPPH·的清除能力
Figure 10 Scavenging effects ofPleurotuseryngiimyceli-um polypeptide on DPPH free radicals
3 结论
在单因素试验的基础上,通过响应面法优化杏鲍菇菌丝体提取多肽工艺,建立了多元回归模型,该模型高度显著,拟合度好。多肽提取最佳条件为pH值8.85,提取时间4.17 h,提取料液比1∶11.86 (g/mL),多肽提取率理论值为50.88%,实验验证值为(50.76 ± 0.05)%,相对误差0.24%,说明回归模型准确性、可靠性较高。杏鲍菇菌丝体多肽具有还原力并对超氧阴离子自由基、羟基自由基和DPPH自由基有明显的清除作用,说明杏鲍菇菌丝体多肽具有一定的抗氧化活性,这为杏鲍菇菌丝体多肽功能性食品开发提供科学理论依据。但是,杏鲍菇菌丝体多肽的组成及构效关系有待进一步研究。
[1] 陈君琛, 杨艺龙, 翁敏劼, 等. 即食杏鲍菇热风-真空联合干燥工艺优化[J]. 农业工程学报, 2014, 30(14): 331-338.
[2] 田平平, 王杰, 秦晓艺, 等. 采后处理对杏鲍菇贮藏品质及抗氧化酶系统的影响[J]. 中国农业科学, 2015, 48(5): 941-951.
[3] RO H S, KIM S S, RYU J S, et al. Comparative studies on the diversity of the edible mushroomPleurotuseryngii: ITS sequence analysis, RAPD fingerprinting, and physiological characteristics[J]. Mycological Research, 2007, 111(6): 710-715.
[4] WANG Shao-juan, LI Yong-xia, BAO Li, et al. Eryngiolide A, a cytotoxic macrocyclic diterpenoid with an unusual cyclododecane core skeleton produced by the edible mushroomPleurotuseryngii[J]. Organic Letters, 2012, 14(14): 3 672-3 675.
[5] RAJORIA A, KUMAR J, CHAUHAN A K. Anti-oxidative and anti-carcinogenic role of lycopene in human health-a review[J]. Journal of Dairying, Foods and Home Science, 2010, 29(3/4): 157-165.
[6] 唐梦茹, 陈涛涛, 汪少芸, 等. 响应面优化酶解法制备韭菜籽蛋白抗氧化肽工艺[J]. 中国食品学报, 2016, 16(4): 159-166.
[7] YAOITA Y, KIKUCHI M, MACHIDA K. Terpenoids and Sterols from Some Japanese Mushrooms[J]. Natural Product Communications, 2014, 9(3): 419-426.
[8] 陈永生, 扶雄, 周林, 等. 亮叶杨桐叶中酚类物质抗氧化和抗 HepG2 细胞增殖作用[J]. 现代食品科技, 2016, 32(8): 14-20.
[9] OYAIZU M. Antioxidative activity of browninf products of Glucosamine fractionated by organic solvent and thin layer chromatography[J]. Nippon ShoKuhin Kogyo Gakkaishi, 1986, 35: 771-775.
[10] 罗璇, 何景. 超声辅助提取花生红衣色素工艺的优化[J]. 食品与机械, 2016, 32(9): 172-176.
[11] 刘香萍, 王国庆, 李国良, 等. 响应面法优化提取紫花苜蓿叶总黄酮及其抗氧化活性研究[J]. 中国食品学报, 2016, 16(4): 145-152.
[12] OFORI-BOATENG C, LEE K T. Response surface optimiz-ation of ultrasonic-assisted extraction of carotenoids from oil palm (ElaeisguineensisJacq.) fronds[J]. Food Science and Nutrition, 2013, 1(3): 209-221.
[13] ZHANG Qing-an, ZHANG Zhi-qi, YUE Xuan-feng, et al. Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder[J]. Food Chemistry, 2009, 116(2): 513-518.
[14] LAI Ji-xiang, XIN Can, ZHAO Ya, et al. Optimization of ultrasonic assisted extraction of antioxidants from black soybean (Glycinemaxvar) sprouts using response surface methodology[J]. Molecules, 2013, 18(1): 1 101-1 110.
[15] 刘存芳, 史娟, 张强. 橘皮多糖超声辅助提取工艺优化及其抗氧化活性研究[J]. 食品与机械, 2016, 32(9): 147-150.
Optimization Extraction of polypeptide fromPleurotuseryngiimycelium and Its Antioxidationinvitro
(1.FoodScienceandEngineeringCollege,QingdaoAgriculturalUniversity,Qingdao,Shandong266109,China;2.ShandongProvincialLaboratoryofAppliedMycology,Qingdao,Shandong266109,China)
The optimal extraction conditions of polypeptide fromPleurotuseryngiimycelium was ivestigated, and activity of the antioxidant was evaluated in this study. Based on the single-factor tests, the extraction conditions of polypeptide fromP.eryngiimycelium were optimized by Response Surface Methodology(RSM) to increase the extraction rate of polypeptide. Moreover, the polypeptide was purified with Sephadex-50, and the antioxidant activity of polypeptide was assessed using several assay model systems in vitro. The optimal extraction conditions of polypeptide were pH 8.85, extraction time 4.17 h, liquid-to-material ratio 1∶11.86 (g/mL). Under the optimal extraction conditions, the maximum extraction rate of polypeptide was 50.88%. Extracted polypeptide showed good antioxidant activity in a dose-dependent manner.
Pleurotuseryngii; mycelium; polypeptide; antioxidant activity
10.13652/j.issn.1003-5788.2017.04.028
湖南省科技厅2015年重点研发计划项目(编号:2015NK3018)
陈伟,男,吉首大学在读本科生。
李加兴(1969-),男,吉首大学教授,博士。 E-mail: jslijiaxing@163.com
2017—02—22
