肾移植术后,反复发热、腹泻、腹膜后淋巴结肿大
2017-07-05李世军许书添
金 英 李世军 许书添
·临床集锦·
肾移植术后,反复发热、腹泻、腹膜后淋巴结肿大
金 英 李世军 许书添
中年男性,肾移植术后服用泼尼松、环孢素、硫唑嘌呤及雷公藤多苷片等抗排斥治疗,既往曾患新生隐球菌病(累及肺部及中枢神经系统),氟康唑及伊曲康唑抗真菌治疗后痊愈,后续泼尼松联合吗替麦考酚酯、他克莫司抗排斥。近4月出现反复发热伴腹泻,PET-CT提示全身多处淋巴结代谢增高,多次痰及尿液找抗酸杆菌阳性,腹腔淋巴结活检提示“鸟型胞内分支杆菌假瘤”,最终诊断为播散性鸟胞内分枝杆菌复合体感染,经治疗后病情稳定。
肾移植术后 鸟胞内分支杆菌复合体 诊断 治疗
病例摘要
现病史 45岁男性,因“肾移植术后18年,反复发热腹泻4月余”入院。
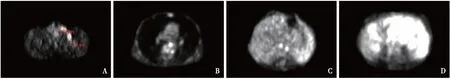
图1 A:锁骨上可见两枚代谢增高淋巴结;B:纵隔内食管旁可见代谢增高淋巴结;C:脾脏增大,代谢增高;D:腹腔内可见多枚肿大融合淋巴结,代谢增高
既往史 1993年发现血压升高及尿检异常,SCr升高,1995年开始血液透析治疗,1997年行肾移植术。个人史、家族史无特殊。
体格检查 体温38.6℃,血压 149/77 mmHg,心率 60 次/min,体重38 kg,BMI 12.8 kg/m2,极度消瘦。左锁骨上窝可触及3枚淋巴结,最大约2 cm,质韧可活动;双肺呼吸音稍粗,无啰音,心律齐,无杂音,腹部平软,可见一长约10 cm陈旧性手术瘢痕及三处大小约1 cm×1 cm陈旧性手术瘢痕,右腰部可见片状瘀斑,双下肢无水肿。
实验室检查
尿检 尿蛋白定量6.88~2.35 g/24h,尿红细胞 1.0万/ml,尿白细胞0~1/HP,管型阴性。
血常规 血红蛋白72 g/L,白细胞0.7×109/L,中性粒细胞/淋巴细胞比例86.2%/1.5%,单核细胞12%,血小板 21×109/L,CRP 57.9 mg/L
血生化 降钙素原 7.89 μg/L,IL-6 2895 ng/L,脑利钠肽前体1 772 pmol/L,肌钙蛋白T 0.062,肌红蛋白 1253 ng/ml,白蛋白 16.9 g/L,球蛋白 21.3 g/L,谷丙转氨酶40 μ/L,谷草转氨酶34 μ/L,SCr 297 μmol/L,钾3.5 mmol/L,钠118 mmol/L,TCO210.3 mmol/L,氯99 mmol/L,淀粉酶 120 μ/L,脂肪酶 254 μ/L
免疫学 CD3+39个/μl,CD4+13个/μl,CD8+21个/μl,CD4+/CD8+0.62;CD20+5个/μl,调节T细胞2个/μl,HLA-DR 44.3%,补体C3 0.476 g/L,补体C4 0.138 g/L,RF<20.0,IgE<20.0 IU/ml,IgA 0.769 g/L,IgM 0.305 g/L,IgG 8.930 g/L,ASO 32.8 IU/ml。
随着人们生活水平的不断提高,二胎政策的开放,越来越多的家庭选择要二胎,而且随着医疗水平的提高,以现在的人口结构为基础,我国的人口总量还会持续增加。在近段时期内,可能会出现生育高峰期,分娩人数不断增加。而随着分娩人数的增加,护理人员的工作就会变得更加繁重,护理人员的数量也会相对缺乏。而由于二胎政策的实施,导致之前积累的生育需求在一段时间内集中爆发,就更加突出了护理人员缺乏的情况,导致了二胎政策下产科护理存在了一定的风险。
病原学 真菌感染G试验、GM试验阴性,痰浓缩集菌抗酸杆菌:先后3次均4+;中段尿查抗酸杆菌:1次2+,1次阴性;结核感染T细胞试验:<2.0 pg/ml;结核杆菌PCR阴性;无条件行非结核抗酸杆菌培养。多次血培养均阴性。HCV-RNA 5.18×106IU/ml。痰培养:(8月29日)阴性,(9月6日)铜绿假单胞菌(左氧氟沙星、环丙沙星、阿米卡星等敏感),(9月18日)肺炎克雷伯菌4+(仅替加环素敏感,余耐药)。
辅助检查
胸腹部CT平扫(9月6日):(1)双肺炎症,双侧胸腔积液,较8月28日(图3)略有加重;(2)右肺结节,较前片相仿;(3)肾移植术后,移植肾包膜下多发钙化,移植肾囊肿;(4)肝多发囊肿,脾大,胆囊结石;(5)双肾萎缩,多发囊肿;(6)腹腔、盆腔积液。
胸部CT平扫(9月14日,图2):(1)两肺炎症,两侧少量胸腔积液合并左肺下叶膨胀不全;(2)心包积液;(3)双侧腋窝肿大淋巴结;(4)腹腔积液。
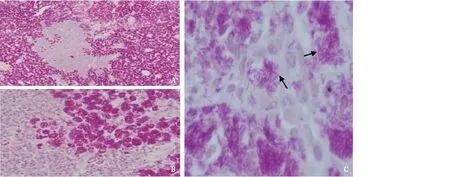
图2 腹腔淋巴结活检组织病理抗酸染色A:淋巴组织破坏,仅残存少量淋巴滤泡组织(HE,×100);B:较多巨噬细胞胞质内见淡染、短梭及点状物质(HE,×200);C:较多巨噬细胞破裂,较多的棒状抗酸染色阳性杆菌(抗酸染色,×600)
诊断分析 中年男性,肾移植术后长期抗排斥治疗,重度营养不良,既往曾有新生隐球菌感染史。入院时免疫功能低下、粒细胞缺乏、贫血伴低蛋白血症。近期反复夜间发热伴腹泻,锁骨上窝触及肿大淋巴结,肺部CT见双肺炎症,右肺结节,PET-CT见多发淋巴结肿大伴代谢增高,多次尿、痰抗酸杆菌阳性,需考虑以下疾病。
血行播散性结核病 常继发于原发性肺结核,亦可因继发性结核病的结核灶复燃、恶化,最终经血行播散。免疫缺陷患者系其高危人群。可累及除肺部以外全身多脏器,如肾脏、消化道、肠系膜淋巴结等。该患者反复低热伴腹泻,且痰液及尿液标本多次找抗酸杆菌均阳性,需排除结核病可能,虽然其在院期间结核感染T细胞试验、结核杆菌PCR均阴性。
恶性淋巴瘤 常表现为无痛性淋巴结肿大、肝脾肿大,全身各器官均可受累,可伴发热、盗汗、消瘦、瘙痒等全身症状。活检病理可明确诊断。霍奇金淋巴瘤的病理特点是多种炎症细胞的混合增生背景中见到诊断性的R-S细胞及其变异型细胞,非霍奇金淋巴瘤可见正常淋巴结或组织结构破坏,肿瘤细胞散在或弥漫浸润,根据不同的病理类型有各自独特的病理表现和免疫表型。该患者多发FDG代谢增高的肿大淋巴结,需排除恶性淋巴瘤,但患者淋巴结活检免疫组化亦以巨噬细胞标记为主,未见异常淋巴细胞或自然杀伤细胞。
播散性隐球菌病 新生隐球菌引起的亚急性或慢性深部真菌病,免疫缺陷患者多见,以中枢系统感染最常见,主要表现为头痛、恶心、呕吐、发热及意识障碍等症状。可侵犯皮肤、肺部、骨骼等多种脏器,皮肤及肺部受累常见,肠道受累罕见,可表现为腹泻[1],该患者既往有新生隐球菌感染,但本次脑脊液未见隐球菌,临床表现也不支持新生隐球菌感染复发。
播散性鸟胞内分枝杆菌复合体感染 非结核分枝杆菌(NTM)感染中,以鸟-胞内分枝杆菌复合体(MAC)感染最常见,而全身播散感染病例中MAC更高达90%。播散性MAC感染可累及全身多种脏器,消化道、肺部、皮肤及淋巴结最常见。临床表现常无特异性,以发热、乏力、消瘦多见,可见相应脏器受累的症状。MAC以萋-尼抗酸染色呈双极抗酸的特点。此患者肾移植术后18年,既往曾出现隐球菌感染,长期免疫抑制剂治疗,淋巴细胞低下,此次因持续发热、腹泻伴消瘦就诊,PET-CT示多处淋巴结高代谢,外院淋巴结活检提示大量巨噬细胞破坏及抗酸杆菌,但结核相关指标阴性,同时住院期间多次痰及中段尿清洁标本送检提示抗酸杆菌阳性。淋巴结活检标本经我院病理科会诊:大量组织样细胞增生,结合原单位抗酸染色及免疫组化标记,考虑鸟型胞内分枝杆菌性淋巴结炎(图3)。结合患者临床表现、实验室检查及组织病理学检查,诊断播散性MAC感染。

图3 胸部CT可见右肺结节(↑)及左肺下叶炎症渗出演变过程(A,E:2015-08-28;B,F:2015-09-06;C,G:2015-09-14;D,H:2015-9-16 )
最后诊断 (1)播散性鸟胞内分枝杆菌复合体感染(累及肺、淋巴结、肾脏及胃肠道);(2)肺部感染;(3)低钠血症,代谢性酸中毒;(4)右侧同种异体肾移植术后(慢性移植肾功能不全);(5)慢性丙型病毒性肝炎(活动期);(6)重度营养不良。
治疗及转归 入院后予甲泼尼龙20 mg/d静滴,撤减免疫抑制剂,输注冷沉淀、血小板及营养支持和对症治疗。诊断明确后予利福喷丁胶囊0.3 g/d、乙胺丁醇0.75 g/d、克拉霉素1 g/d抗NTM治疗(图4),腹泻症状改善,尿量增多达3 000~4 000 ml/d,无尿路刺激征,但仍有发热,胸部CT可见双肺感染加重,痰培养铜绿假单胞菌,9月7日加用左氧氟沙星。9月17日因发热无改善,复查胸部CT示肺部感染加重,痰培养生长肺炎克雷伯菌,9月18日予替加环素治疗,体温下降36.3~37.5℃。9月23日因腹泻改善,可进食流质,办理出院,继续抗NTM治疗,仍有反复低热(37~38℃)。10月9日门诊复查SCr 204.2 μmol/L,白蛋白26.6 g/L,CRP 46.2 mg/L,WBC 4.4×109/L,淋巴细胞比例0.141 2,Hb 77 g/L,PLT 95×109/L,加用泼尼松(15 mg/d)+他克莫司(3 mg/d)+咪唑立宾(100 mg,q12h)抗排斥,仍间断发热,纳差、腹泻,体重无明显改善。10月28日复查他克莫司浓 6.93 ng/ml,SCr 229 μmol/L,尿蛋白1+,Hb 69 g/L,PLT 231×109/L,治疗同前。
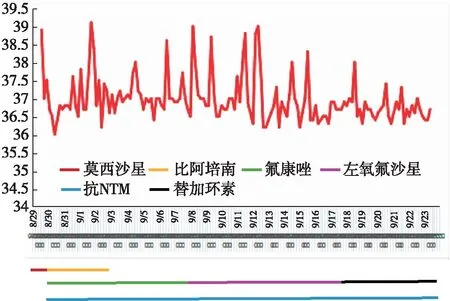
图4 患者住院期间体温变化及用药情况NTM:非结核分枝杆菌
讨 论
本例患者长期免疫抑制剂治疗,免疫缺陷、营养不良,有新生隐球菌和丙肝病史。此次反复发热伴腹泻,结合腹腔淋巴结活检病理及多次痰液、尿液标本找抗酸杆菌等检查,最终确诊为播散性MAC感染。在NTM感染疾病中,MAC发病率最高,诊断较为困难,且在非HIV患者中有逐年增长的趋势,此种非结核性分枝杆菌感染的诊治关键在于早期取得病原学证据从而早期治疗。
鸟胞内分支杆菌的组成 NTM是指结核分枝杆菌复合群和麻风分枝杆菌以外的分枝杆菌,已发现150余种。由于分枝杆菌的菌种鉴定工作繁琐,对实验室人员水平要求高,目前只有为数不多的实验室开展此项工作。MAC是一种人畜共患的条件致病菌,可局部感染亦可发生全身播散。MAC主要由鸟分枝杆菌和胞内分枝杆菌组成,传统生化检验方法不能区分两类细菌,但致病性特殊,故统称为MAC,其中鸟分枝杆菌在疾病播散性全身感染中作用更关键,胞内分枝杆菌则在呼吸系统感染中起主要作用[2]。
MAC呈短到长的杆状细胞,有些为丝状体,具有萋-尼抗酸染色呈双极抗酸的特点[3]。MAC可见于世界各地,可存在于各种生态环境中,如水源、土壤和动物等。人造水体中也有MAC,如户内水系统、水池及热水桶等。通常认为致病性的MAC多来自自然水体,且以气溶胶的形式存在,可经循环的热水系统传播[4-5]。免疫功能正常时,当MAC通过呼吸道或消化道时会被巨噬细胞吞噬。先天免疫缺陷或后天免疫缺陷,CD4+淋巴细胞计数过低(<50个/μl)、IFN-γ和IL-12通路缺陷等都是NTM感染的易感因素[6]。
临床表现 MAC主要通过消化道进入机体,呼吸道次之。NTM感染可分为以下几种类型:纤维性囊肿、超敏反应性疾病(热浴肺等)、淋巴系统感染、局限其他部位感染以及播散型感染[2]。MAC感染最常累及肺部及淋巴结,播散型感染可累及任何组织器官。头颈部淋巴结最常受累,组织学表现为坏死性肉芽肿性炎,偶见干酪样坏死[7]。中枢受累少见,可表现为头痛、恶心、呕吐、共济失调、言语错乱等[12-15]。
晚期HIV感染患者易发生播散型MAC感染[12],90%播散型感染的NTM病的病源体为MAC,其中>90%系鸟分枝杆菌感染。MAC感染的临床表现及实验室检查无特异性且多样,主要表现为发热、消瘦及贫血等。Roos等[13]发现20例播散型MAC感染患者主要表现为发热、体重减轻以及腹泻,所有患者均有严重免疫缺陷(中位CD4+淋巴细胞10个/μl),可伴贫血、肝酶异常及低白蛋白血症,诊断后的中位生存时间仅为8个月。
肾移植患者MAC感染较为罕见。Fadlallah等[14]报道了1例37岁女性肾移植术后20年的患者,曾发生多种复杂的感染,发病时主要表现为全身多处红斑样皮疹及皮下结节,无其他症状,CT发现双肺弥漫树芽状结节,皮肤活检证实为抗酸杆菌感染,4个月后的下臂结节培养生长MAC,确诊为MAC感染。Fadlallah等[14]同时总结了11例肾移植术后MAC感染病例,其中6例为播散型感染,可累及肺、肝、脾、骨髓、肠系膜淋巴结、小肠、肾脏等多个脏器,5例为局限性感染,分别局限于左腕关节滑膜炎、左臀假体、肺、左踝关节和移植肾,皮肤感染罕见。其中各脏器受累主要依赖临床表现及相应体液标本的培养送检,腹腔内、腹膜后等组织感染诊断可靠附近淋巴结穿刺活检,此例患者因多次痰及中段尿找到抗酸杆菌,结合淋巴结活检及腹泻症状,故认为累及肺部、肾脏、淋巴结及胃肠道。
治疗与预后 感染MAC的HIV患者,需同时兼顾MAC与HIV的治疗。ATS推荐所有患者的起始治疗为:克拉霉素 1 000 mg/d或者阿奇霉素500 mg/d,联合乙胺丁醇15 mg/kg/d,可加用利福布丁300 mg/d。大环内酯类耐药者治疗成功率低,可加用氨基糖苷类药物(如阿米卡星)或喹诺酮类(如莫西沙星)。与克拉霉素联用可提高利福布丁的血药浓度,但可导致关节痛、葡萄膜炎、中性粒细胞减少及肝损伤等不良反应,需减低利福布丁剂量或一起停用。受艾滋药物的影响,HIV感染患者需谨慎调整上述药物剂量[2]。值得注意的是,本例患者在后期痰培养出现肺炎克雷伯杆菌感染后曾予近1周的替加环素治疗后体温改善。替加环素作为第一个蛋白合成阻滞剂的甘氨四环素类药物,具有抗NTM治疗作用,而且大部分报道中替加环素仍用于针对前期药物治疗失败的NTM感染患者[15]。
因感染MAC的患者大都存在免疫功能缺陷,以HIV患者居多,基础状况较差,治疗难度大。单纯MAC肺病的预后尚可,日本的相关研究中[16],随访中位时间4.7年,累积5年与10年总病死率为23.9%与46.5%。不经治疗的播散MAC感染死亡率非常高,在Roos等[13]的研究中,艾滋患者合并播散型MAC感染的患者中诊断后中位存活时间为8个月[13]。Fadlallah等[14]总结的12例肾移植合并MAC感染的患者中,7例播散型感染的病例中2例死亡,剩余5例均感染得到控制。局限部位感染的5例患者中1例数据不明,剩余4例死亡1例,余3例缓解。
小结:慢性肾脏病患者常需要长期使用激素及免疫抑制剂,发生机会感染和特殊感染的风险较高。而目前对于非结核分枝杆菌感染的认识相对欠缺。对于免疫功能低下患者出现发热、乏力、纳差、消瘦等症状时,临床医师需放宽视野、寻找病原学证据,考虑到特殊致病菌感染的可能。播散性MAC感染预后较差,因而早期诊断干预,及时启用NTM治疗对于此类患者尤为关键。
1 Sungkanuparph S,Tanphaichitra D,Pracharktam R.Chronic diarrhoea caused by Cryptococcus neoformans in a non-human immunodeficiency virus-infected patient.Scand J Infect Dis,2003,35(3):211-212.
2 Griffith DE,Aksamit T,Brown-Elliott BA,et al.An official ATS/IDSA statement:diagnosis,treatment,and prevention of nontuberculous mycobacterial diseases.Am J Respir Crit Care Med,2007,175(4):367-416.
3 Saito H,Tomioka H.Susceptibilities of transparent,opaque,and rough colonial variants of Mycobacterium avium complex to various fatty acids.Antimicrob Agents Chemother,1988,32(3):400-402.
4 Tobin-D′Angelo MJ,Blass MA,del RC,et al.Hospital water as a source of Mycobacterium avium complex isolates in respiratory specimens.J Infect Dis,2004,189(1):98-104.
5 Sugita Y,Ishii N,Katsuno M,et al.Familial cluster of cutaneous Mycobacterium avium infection resulting from use of a circulating,constantly heated bath water system.Br J Dermatol,2000,142(4):789-793.
6 Sexton P,Harrison AC.Susceptibility to nontuberculous mycobacterial lung disease.Eur Respir J,2008,31(6):1322-1333.
7 Mahadevan M,Neeff M,Van Der Meer G,et al.Non-tuberculous mycobacterial head and neck infections in children:Analysis of results and complications for various treatment modalities.Int J Pediatr Otorhinolaryngol,2016,82:102-6.
8 Dickerman RD,Stevens QE,Rak R,et al.Isolated intracranial infection with Mycobacterium avium complex.J Neurosurg Sci,2003,47(2):101-105.
9 Di Patre PL,Radziszewski W,Martin NA,et al.A meningioma-mimicking tumor caused by Mycobacterium avium complex in an immunocompromised patient.Am J Surg Pathol,2000,24(1):136-139.
10 Morrison A,Gyure KA,Stone J,et al.Mycobacterial spindle cell pseudotumor of the brain:a case report and review of the literature.Am J Surg Pathol,1999,23(10):1294-1299.
11 Sadek M,Yue FY,Lee EY,et al.Clinical and immunologic features of an atypical intracranial mycobacterium avium complex (MAC) infection compared with those of pulmonary MAC infections.Clin Vaccine Immunol,2008,15(10):1580-1589.
12 Nightingale SD,Byrd LT,Southern PM,et al.Incidence of Mycobacterium avium-intracellulare complex bacteremia in human immunodeficiency virus-positive patients.J Infect Dis,1992,165(6):1082-1085.
13 Roos F,Flepp M,Figueras G,et al.Clinical manifestations and predictors of survival in AIDS patients with disseminated Mycobacterium avium infection.Eur J Clin Microbiol Infect Dis,2001,20(6):428-430.
14 Fadlallah J,Rammaert B,Laurent S,et al.Mycobacterium avium complex disseminated infection in a kidney transplant recipient.Transpl Infect Dis,2016,18(1):105-111.
15 Soni I,De Groote MA,Dasgupta A,et al.Challenges facing the drug discovery pipeline for non-tuberculous mycobacteria.J Med Microbiol,2016,65(1):1-8.
16 Hayashi M,Takayanagi N,Kanauchi T,et al.Prognostic factors of 634 HIV-negative patients with Mycobacterium avium complex lung disease.Am J Respir Crit Care Med,2012,185(5):575-583.
(本文编辑 律 舟)
Recurrent fever, diarrhea and retro-peritoneal lymphadenopathy in a kidney transplant recipient
JINYing,LIShijun,XUShutian
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A 45-year-old male kidney transplant recipient who kept a long-term immunosuppressive agents consisted of prednisone, cyclosporine, azathioprine and tripterygium wilfordii. He had a post-transplantation infection experience: adequately treated cryptococcus neoformans infection involved lung and central nervous system with the agents of fluconazole and sporanox. After cryptococcus neoformans infection cured, his immunosuppressive regimen changed into the combination of prednisone, mycophenolate mofetil and tacrolimus. Four months lately, he was suffered with recurrent fever which mainly occurred at night and persistent diarrhea. Acid fast bacilli were found several times in his sputum and midstream urine specimen. PET-CT showed a lot of lymphonodus with high metabolic rate. The celiac lymph node histological examination showed highly considered mycobacterium avium-intracellulare complex pseudotumor. The final diagnosis is mycobacterium avium-intracellulare complex disseminated infection.
post-renal transplantation mycobacterium avium-intracellulare complex diagnosis treatment
10.3969/cndt.j.issn.1006-298X.2017.03.020
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-07-14
