急性肾损伤修复与治疗干预
2017-07-05董建华综述李世军审校
董建华 综述 李世军 审校
·肾脏病基础·
急性肾损伤修复与治疗干预
董建华 综述 李世军 审校
急性肾损伤修复是一个复杂的病理生理过程,对其机制的理解,有助于寻找更好的治疗方法。本文将概述急性肾损伤修复机制、生物标志物、靶向治疗和影响因素,以提高对急性肾损伤修复最新理论和治疗方法的认识。
急性肾损伤 生物标志物 修复
急性肾损伤(AKI)是一种常见的以肾功能快速下降及代谢废物蓄积为表现的临床综合征。根据临床上最新的以血清肌酐及尿量为基础的改善全球肾脏疾病预后组织(KDIGO)标准,约40%的危重症患者受到AKI影响,约20%的维持性肾脏替代治疗的终末期肾病患者与AKI有关[1]。缺血再灌注损伤、肾毒素和脓毒症是引起AKI的主要原因,与微循环障碍和肾小管上皮细胞功能障碍有关。AKI肾组织修复机制复杂,涉及上皮细胞、内皮细胞、炎性细胞和基质,使得用生物标志物反映损伤和修复变得很困难。本文将对AKI修复机制、生物标志物、靶向治疗和影响因素进行概述,以提高对AKI修复的认识。
AKI修复机制
肾脏有显著的修复和再生能力,AKI后肾功能可完全恢复。在急性缺血性肾损伤动物模型中,近端肾小管上皮细胞增生明显[2]。AKI后增生的肾小管上皮细胞来源成为研究AKI修复的关键。Duffield等[3]利用表达增强型绿色荧光蛋白(EGFP)基因的嵌合体小鼠,发现骨髓来源细胞对缺血性肾损伤后上皮细胞的修复无明显作用。随后Humphreys等[4]使用遗传图谱和转基因小鼠标记肾小管上皮细胞,发现残存的上皮细胞再生是修复缺血性肾损伤的主要机制。与之相反,有学者提出可能存在具有高再生潜能和抗凋亡的特异性肾小管细胞亚群,也称为散在肾小管上皮细胞或近端小管罕见细胞,这些细胞可能是一种特定的肾小管干细胞群[5]。为此,Kusaba等[6]和Berger等[7]分别利用转基因小鼠标记这些肾小管细胞群,得出相同的结论,即散在肾小管细胞不是干细胞群,显性细胞几乎可以是任何近端肾小管细胞(图1)。肾小管上皮细胞可转换到一个共同的损伤反应程序,在肾小管细胞去分化的过程中,尚存的上皮细胞会重新填充缺损的细胞。
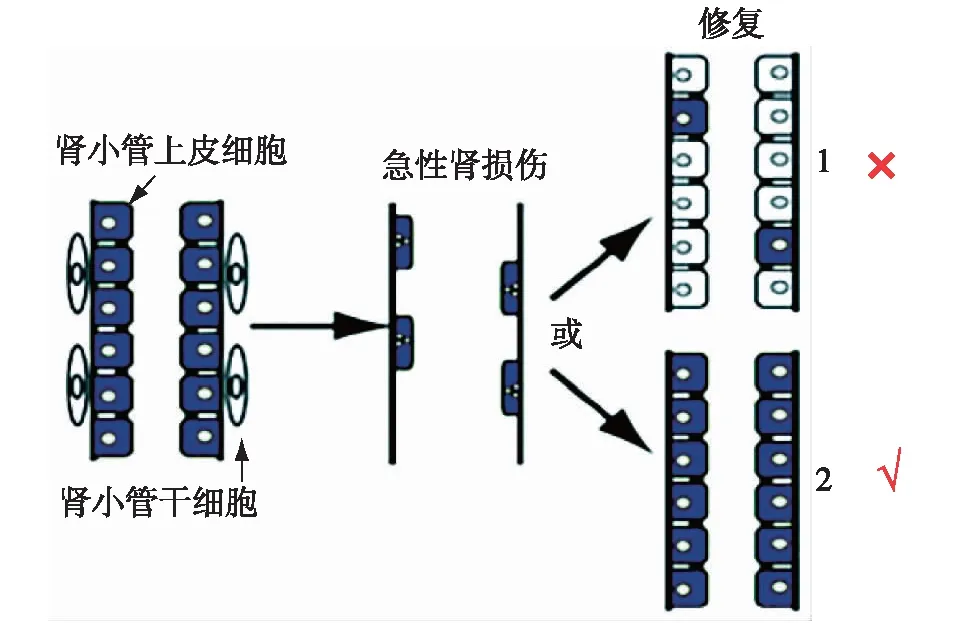
图1 急性肾损伤修复模式图模式1:肾小管干细胞(白色)增殖、分化;模式2:肾小管上皮细胞(蓝色)去分化、迁移、增殖和再分化;但最终的实验结果显示残存的肾小管上皮细胞再生是肾损伤修复的主要机制
AKI修复是一个复杂的分子生物学过程,对其分子和细胞基础所知甚少,目前研究进展包括损害相关分子模式、肾巨噬细胞/树突状细胞、细胞周期调控等方面。AKI伴随的无菌性炎症反应可致肾小管损伤。损伤的肾小管细胞释放细胞内因子致免疫细胞激活并产生炎症介质(也称损害相关分子模式,DAMPs)。DAMPs可激活一系列模式识别受体,如肾小管上皮细胞上的Toll样受体4(TLR4)。最近一项研究阐述了TLR4和白细胞介素22(IL-22)在肾脏修复中作用[8]。在肾损伤早期阻断TLR4可抑制IL-22产生,而在肾损伤修复期阻断TLR4亦会抑制IL-22产生和肾小管细胞再生。结果显示TLR4通过刺激单核巨噬细胞分泌IL-22,促进缺血肾损伤修复。
巨噬细胞在肾脏修复中可表现出不同的功能,包括促炎症反应(M1或经典激活)和组织修复(M2 或选择性激活)。有学者研究了肾巨噬细胞/树突状细胞在AKI修复中的作用,发现抑制巨噬细胞集落刺激因子-1信号通路,会阻断巨噬细胞/树突状细胞增殖,降低M2极化,抑制肾功能恢复[9]。结果显示可调节肾巨噬细胞/树突状细胞增殖和极化的集落刺激因子1对肾小管上皮细胞再生起重要作用。
细胞周期调控在AKI修复中起重要作用[10]。肾脏缺血性损伤24h内,肾小管上皮细胞会经历细胞凋亡和坏死;幸存下来的细胞,通常是处于静止期的近端小管上皮细胞,增殖并进入细胞周期。在缺血后炎症环境中,增殖细胞对基因毒性应激非常敏感。进入细胞周期,依次激活周期蛋白依赖性蛋白激酶(Cdks)4/6和2,并合成检控蛋白,包括p21。这种损伤后再次进入细胞周期被看作是一种保护性反应。既往的研究表明,Cdk抑制剂p21表达会减轻损伤,p21超表达或使用其它蛋白酶抑制剂可以预防缺血性细胞死亡。因此,Cdk2 或 Cdk4/6 抑制剂瞬时表达代表了一种提高肾脏修复能力的新策略,既能预防早期肾小管细胞死亡,也能增强受损肾小管增殖修复。
AKI修复的生物标志物
目前有很多肾损伤早期的尿液生物标志物用于评估AKI,而反映肾组织修复的生物标志物却很少。肾脏修复时,残存的上皮细胞沿基底膜分化、迁移并增殖,以恢复细胞数目,然后再分化,使肾单位完全恢复。尿沉渣中有丝分裂的肾小管上皮细胞是一种简单的标记物,可以反映肾小管细胞增殖。反映上皮细胞增殖的蛋白质可能成为肾脏修复的生物标志物。研究发现[11],尿中金属基质蛋白酶-2(TIMP-2)和胰岛素样生长因子结合蛋白7(IGFBP7)增加可作为早期预测AKI的生物标志物,其尿中浓度下降是肾功能恢复的强预测因子。由于TIMP-2和IGFBP7可诱导增殖细胞在细胞周期G1停滞,参与AKI早期损伤阶段,故尿中TIMP-2和IGFBP7浓度下降意味着细胞增殖修复开始。肾小管上皮细胞刷状缘表达的2a型钠磷协同转运蛋白(NaPiT2a)也可能成为肾脏修复的生物标志物。尿毒症小鼠模型中,近端肾小管细胞表达的NaPiT2a降低,随着肾脏缺氧改善,NaPiT2a的表达也随之增加[12]。因此,如果尿中NaPiT2a水平增加,说明肾小管刷状缘在恢复。尿中有很多由肾小管上皮细胞分泌的直径小于100 nm的小泡,称为外泌体,其中含有很多与疾病相关的蛋白,为AKI诊断提供了重要的疾病标志物来源。例如,AKI患者外泌体中胎球蛋白-A水平增加,可作为肾损伤的生物标志物,但暂不清楚胎球蛋白-A在肾脏修复过程中的变化[13]。
目前很难区分治疗AKI是加速肾脏修复,还是限制肾损伤,显然减少初始肾损伤可促进肾脏更好的修复。在实验中,肾损伤时间是可知的;因此,比较修复后肾小球滤过率(GFR)与初始损伤前的GFR,可以区分不同治疗方法对AKI的效果。但在临床中,损伤结束或修复开始的时间往往是未知的,确定肾损伤时间是一个难题。因此,肾脏修复相关生物标志物在AKI中的应用非常重要。
AKI修复的肾功能评价指标
AKI修复包括肾脏结构和功能的恢复。目前尚没有最佳的生物标志物评价肾脏修复,只能通过评估血清肌酐的变化反映GFR。血清肌酐是一种不敏感的AKI生物标志物,即使血清肌酐降至正常范围,也不能反映全部肾脏组织结构和功能恢复。AKI修复的目标是肾功能完全修复(CFR),包括肾血流灌注、GFR和肾小管功能。然而,目前几乎所有的临床研究只涉及GFR,而CFR包含的范围更广泛,如尿浓缩功能、肾小管周围毛细血管密度等。目前尚不明确CFR的发生率,治疗干预对CFR的影响,及肾功能不完全修复时的后果,故需要生物标志物评价AKI患者肾功能的变化。
肾血流灌注恢复依赖于肾血流量(RBF)和微循环功能改善。目前一些技术手段已经用来评估RBF和微血管组织氧合功能。超声造影技术已广泛应用气体微泡造影剂来评估心肌灌注,同时也用于检测健康人群的肾功能储备,诊断肾动脉狭窄、移植肾灌注异常及评估ICU患者潜在的AKI风险[14]。磁共振成像是一种利用脱氧血红蛋白的顺磁性原理,快速评价肾组织氧利用的非侵入性方法。有研究已应用核磁共振成像比较移植肾肾功能正常时和排斥反应急性肾小管坏死时的区别[15]。正电子发射断层扫描和光谱分析也可用于评估RBF和肾组织氧利用[16-17],但都需要更多的临床研究验证。菊粉、碘酞酸盐或碘海醇等是测定肾小球滤过功能理想的外源性物质,其血浆清除率可准确反映GFR,但操作过程非常繁琐,在临床实践中受到限制。目前一种便携式光纤荧光分析仪可快速测量实验动物GFR,与碘海醇测定结果一致[18]。这项技术在AKI中有广泛的应用前景,但仍需要临床研究证实其有效性和安全性。肾小管是AKI最常见的受损部位。小分子蛋白尿、肾性糖尿、肾小管酸化和浓缩功能等是评估肾小管功能的常用指标,却很少有研究使用这些指标评估AKI肾功能的恢复情况。总之,肾功能恢复的生物标志物应反映RBF、肾组织氧利用、GFR和肾小管功能,需要结合影像学、功能性研究及前瞻性研究,寻找最佳生物标志物来评估AKI修复。
AKI治疗靶目标
骨髓间充质干细胞(MSCs)迁移到受损的肾脏组织,并释放细胞因子,包括基质衍生因子1及其受体CXCR、肝细胞生长因子(HGF)及其受体c-met、血管内皮细胞黏附信号(如 VLA-4/VCAM-1),以及基质黏附信号(如CD44-依赖透明质酸作用)。研究表明植入的MSCs不会直接分化为成熟的肾小管上皮细胞[19]。MSCs通过旁分泌调节受伤的小管细胞的去分化、迁移、增殖和再分化,以恢复肾脏稳态。AKI动物模型腹腔注射和静脉注射MSCs肾脏修复效果相同,说明组织修复通过旁分泌机制调节[20]。MSCs释放的细胞因子会促进肾小管增殖、触发血管生成,如碱性成纤维细胞生长因子(bFGF)、IL-6、 HGF、转化生长因子β(TGF-β)、表皮生长因子(EGF)、基质衍生因子1、血管生成素1、红细胞生成素(EPO)、血管内皮生长因子(VEGF)和胰岛素样生长因子(IGF)等。敲除VEGF或IGF的AKI模型会降低MSCs的修复作用[21-22]。MSCs释放的其他因子,如前列腺素(PGE2)、IL-10、一氧化氮(NO)和血红色氧化酶1(HO-1)等,产生抗炎和免疫调节的作用,抑制树突状细胞分化或激活,抑制CD4+/CD8+T细胞增殖/细胞因子释放,以及刺激调节T细胞[23]。在临床应用中,需警惕MSCs恶性分化、肿瘤和超免疫抑制等副作用;同时比较骨髓MSCs与脂肪组织、脐带血等分离的MSCs治疗效果,识别MSCs旁分泌释放的细胞因子。研究显示MSCs来源的胞外囊泡,可能通过蛋白质和基因物质直接影响邻近细胞的生物学行为,故胞外囊泡可通过mRNA和微小RNA转移,诱导肾脏修复[24]。
肾组织修复与肾小管上皮细胞增殖和血管内皮细胞形成有关。新近的研究已经确定在缺血再灌注和脓毒症所致AKI中存在新的潜在治疗目标。巨噬细胞可调节AKI修复,巨噬细胞在缺血的肾组织聚集,尽管在早期会加强炎症反应,但在后期它们通过吞噬细胞碎片和其他机制促进修复。例如,巨噬细胞分泌Wnt7b促进肾小管上皮细胞增殖[25]。上皮细胞、内皮细胞潜在治疗靶目标汇总在表1和表2[26]。
AKI修复的影响因素
影响AKI修复的因素包括疾病因素和患者因素。有证据表明引起AKI的病因是肾功能恢复的重要影响因素。Amdur等[27]发现,急性肾小管坏死比病因不清的AKI更容易发展至慢性肾功能不全。多种致病因素比单一病因(如缺血)引起的AKI进展为CKD的机率更高(38% vs 5%)[28]。脓毒症所致AKI的病死率高、住院时间长,需要肾脏替代治疗的比例高(71%);然而,这类型的AKI肾功能恢复速度却更快,也更易摆脱肾脏替代治疗[29]。

表1 上皮细胞的修复靶目标
AKI:急性肾损伤;CKD:慢性肾脏病
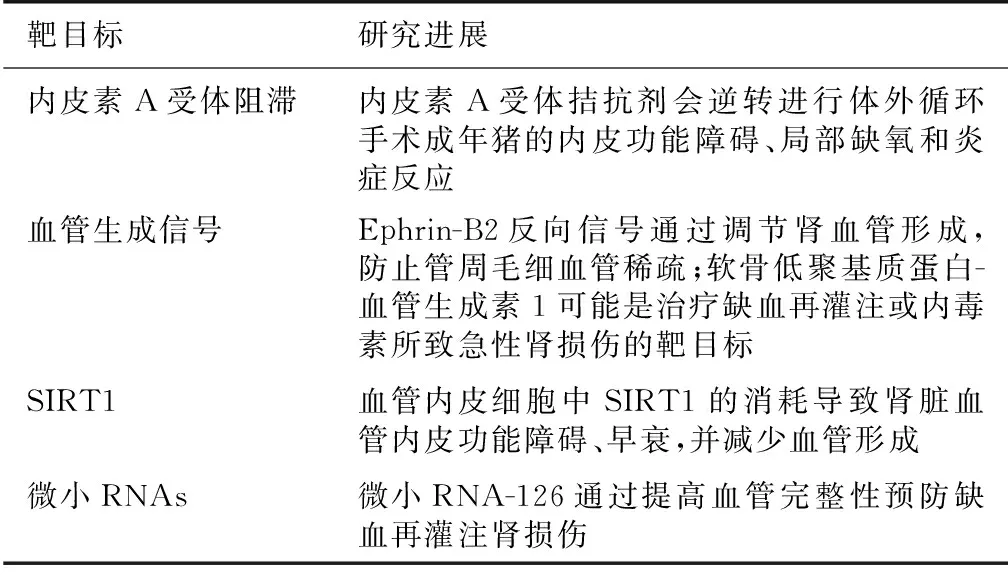
表2 内皮细胞的修复靶目标
SIRT1:沉默信息调节子1
年龄和并存疾病可能是影响AKI修复的重要患者因素。衰老本身会促进AKI进展、延缓肾功能的恢复,包括氧化应激、细胞衰老、细胞凋亡增加、上皮细胞增殖下降等。老年人发生AKI的因素一般涉及多种病因,如脓毒症、肾毒性药物、低灌注及尿路梗阻等。年龄是否是影响AKI恢复的危险因素,目前仍存在争议。对行肾脏替代治疗的AKI患者进行Meta分析发现,老年患者肾功能恢复率较年轻患者低50%[30]。相反,另一项研究中[28],425例AKI患者中,肾功能完全或部分恢复者在年龄方面并没有显著差异。老年AKI患者肾功能恢复效果好可能与此项研究纳入患者均排除了肾脏基础疾病有关。目前不能完全明确老龄是AKI恢复的危险因素。一项大型队列研究发现,充血性心衰和糖尿病是影响AKI恢复的高危因素[31]。
小结:AKI修复的分子生物学机制复杂,涉及肾小管上皮细胞、炎性细胞、细胞因子等方面,传统的生物标志物(如GFR)已不能准确反映AKI及其修复过程中肾脏结构和功能的变化,TIMP-2、IGFBP7等标志物可有助于定位肾脏修复过程,为临床评估肾脏修复提供更好的方法。骨髓间充质干细胞可作为靶向治疗的新方法,肾小管上皮细胞、内皮细胞和巨噬细胞等均可成为促进AKI修复的新靶点。
1 Coca SG.Long-term outcomes of acute kidney injury.Curr Opin Nephrol Hypertens,2010,19(3):266-272.
2 Witzgall R,Brown D,Schwarz C,et al.Localization of proliferating cell nuclear antigen,vimentin,c-Fos,and clusterin in the postischemic kidney.J Clin Invest,1994,93(5):2175-2188.
3 Duffield JS,Park KM,Hsiao LL,et al.Restoration of tubular epithelial cells during repair of the postischemic kidney occurs independently of bone marrow-derived stem cells.J Clin Invest,2005,115(7):1743-1755.
4 Humphreys BD,Valerius MT,Kobayashi A,et al.Intrinsic epithelial cells repair the kidney after injury.Cell Stem Cell,2008,2(3):284-291.
5 Hansson J,Hultenby K,Cramnert C,et al.Evidence for a morphologically distinct and functionally robust cell type in the proximal tubules of human kidney.Hum Pathol,2014,45(2):382-393.
6 Kusaba T,Lalli M,Kramann R,et al.Differentiated kidney epithelial cells repair injured proximal tubule.Proc Natl Acad Sci USA,2014,111(4):1527-1532.
7 Berger K,Bangen J-M,Hammerich L,et al.Origin of regenerating tubular cells after acute kidney injury.Proc Natl Acad Sci USA,2014,111(4):1533-1538.
8 Kulkarni OP,Hartter I,Mulay SR,et al.Toll-like receptor 4-induced IL-22 accelerates kidney regeneration.J Am Soc Nephrol,2014,25(5):978-989.
9 Zhang MZ,Yao B,Yang S,et al.CSF-1 signaling mediates recovery from acute kidney injury.J Clin Invest,2012,122(12):4519-4532.
10 DiRocco DP,Bisi J,Roberts P,et al.CDK4/6 inhibition induces epithelial cell cycle arrest and ameliorates acute kidney injury.Am J Physiol Renal Physiol,2014,306(4):F379-388.
11 Meersch M,Schmidt C,Van Aken H,et al.Urinary TIMP-2 and IGFBP7 as early biomarkers of acute kidney injury and renal recovery following cardiac surgery.PLoS ONE,2014,9(3):e93460.
12 Kamimoto M,Mizuno S,Ohnishi H,et al.Type 2a sodium-phosphate cotransporter serves as a histological predictor of renal dysfunction and tubular apical damage in the kidneys of septic mice.Biomed Res,2009,30(4):251-258.
13 Zhou H,Pisitkun T,Aponte A,et al.Exosomal Fetuin-A identified by proteomics:A novel urinary biomarker for detecting acute kidney injury.Kidney Int,2006,70(10):1847-1857.
14 Göcze I,Wohlgemuth WA,Schlitt HJ,Jung EM.Contrast-enhanced ultrasonography for bedside imaging in subclinical acute kidney injury.Intensive Care Med,2014,40(3):431.
15 Han F,Xiao W,Xu Y,et al.The significance of BOLD MRI in differentiation between renal transplant rejection and acute tubular necrosis.Nephrol Dial Transplant,2008,23(8):2666-2672.
16 Juillard L,Janier MF,Fouque D,et al.Renal blood flow measurement by positron emission tomography using 15O-labeled water.Kidney Int,2000,57(6):2511-2518.
17 Scheeren TW,Martin K,Maruschke M,et al.Prognostic value of intraoperative renal tissue oxygenation measurement on early renal transplant function.Transpl Int,2011,24(7):687-696.
18 Wang E,Meier DJ,Sandoval RM,et al.A portable fiberoptic ratiometric fluorescence analyzer provides rapid point-ofcare determination of glomerular filtration rate in large animals.Kidney Int,2012,81(1):112-117.
19 Tögel F,Yang Y,Zhang P,et al.Bioluminescence imaging to monitor the in vivo distribution of administered mesenchymal stem cells in acute kidney injury.Am J Physiol Renal Physiol,2008,295(1):315-321.
20 Bi B,Schmitt R,Israilova M,et al.Stromal cells protect against acute tubular injury via an endocrine effect.J Am Soc Nephrol,2007,18(9):2486-2496.
21 Tögel F,Zhang P,Hu Z,Westenfelder C.VEGF is a mediator of the renoprotective effects of multipotent marrow stromal cells in acute kidney injury.J Cell Mol Med,2009,13(8B):2109-2114.
22 Imberti B,Morigi M,Tomasoni S,et al.Insulin-like growth factor-1 sustains stem cell mediated renal repair.J Am Soc Nephrol,2007,18(11):2921-2928.
23 Cho DI,Kim MR,Jeong HY,et al.Mesenchymal stem cells reciprocally regulate the M1/M2 balance in mouse bone marrowderived macrophages.Exp Mol Med,2014,46:e70.
24 Tomasoni S,Longaretti L,Rota C,et al.Transfer of growth factor receptor mRNA via exosomes unravels the regenerative effect of mesenchymal stem cells.Stem Cells Dev,2013,22(5):772-780.
25 Kinsey GR.Macrophage dynamics in AKI to CKD progression.J Am Soc Nephrol,2014,25(2):209-211.
26 Humphreys BD,Cantaluppi V,Portilla D,et al.Acute Dialysis Quality Initiative (ADQI) XIII Work Group.J Am Soc Nephrol,2016,27(4):990-998.
27 Amdur RL,Chawla LS,Amodeo S,et al.Outcomes following diagnosis of acute renal failure in U.S.veterans:Focus on acute tubular necrosis.Kidney Int,2009,76(10):1089-1097.
28 Schiffl H,Fischer R.Clinical cause of presumed acute tubular necrosis requiring renal replacement therapy and outcome of critically ill patients:Post hoc analysis of a prospective 7-year cohort study.Int Urol Nephrol,2012,44(6):1779-1789.
29 Bagshaw SM,Uchino S,Bellomo R,et al.Beginning and Ending Supportive Therapy for the Kidney (BEST Kidney) Investigators:Septic acute kidney injury in critically ill patients:Clinical characteristics and outcomes.Clin J Am Soc Nephrol,2007,2(2):431-439.
30 Schmitt R,Coca S,Kanbay M,et al.Recovery of kidney function after acute kidney injury in the elderly:A systematic review and meta-analysis.Am J Kidney Dis,2008,52(2):262-271.
31 Pannu N,James M,Hemmelgarn B,et al.Alberta Kidney Disease Network:Association between AKI,recovery of renal function,and long-term outcomes after hospital discharge.Clin J Am Soc Nephrol,2013,8(2):194-202.
(本文编辑 律 舟)
Repair and targeted therapy after acute kidney injury
DONGJianhua,LIShijun
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Acute kidney injury (AKI) repair is a complicated process of molecular biology, and the understanding of the mechanism, can be used to guide therapeutic strategies aimed at accelerating this process. In order to improve the latest theory and treatment of AKI, we review very recent discoveries in this area, including mechanisms of repair, kidney repair biomarkers, targeted therapy and influencing factors.
acute kidney injury biomarker repair
10.3969/cndt.j.issn.1006-298X.2017.03.015
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-10-03
