细胞外囊泡:一类新的细胞间信使
2017-07-05张思盼综述刘志红审校
张思盼 综述 刘志红 审校
·基础医学·
细胞外囊泡:一类新的细胞间信使
张思盼 综述 刘志红 审校
细胞外囊泡(EVs),是一类由细胞分泌的双层脂质膜结构的微小囊泡。近年来研究发现EVs在细胞间信息间通信中扮演十分重要的角色。这些囊泡包裹了mRNA、microRNA等小RNA、质粒DNA、酶和神经递质等,并且通过其表面相关受体和特定细胞间黏附分子,特异性识别靶细胞、进行信号转导,继而参与靶细胞的功能调控。
细胞外囊泡 外泌体 microRNA 细胞间通信
生物体内的细胞每时每刻都在对自身、相邻和远隔细胞的各种信号进行处理和应答,正是这种细胞间的通信保证了细胞在代谢、增殖和分化等行为上保持与细胞群体、器官和机体的整体活动协调一致。细胞外信使可依赖于囊泡转运这一途径实现复杂的细胞通信。囊泡转运已经在细胞内被证明是细胞物质运输的基本途径,细胞内的物质分泌很大一部分是通过囊泡转运实现的。
细胞外囊泡(extracellular vesicles,EVs)是细胞外信号的重要部分[1]。EVs可通过不同方式影响靶细胞:发挥信号转导复合体作用,或者在细胞间转移膜受体和蛋白,或者水平传递遗传信息来调节靶细胞基因表达[2-3]。本文拟就EVs在细胞间通信的生物学功能做一简述。
EVs的生物学特征
EVs是细胞分泌的双层脂质膜结构的颗粒,最初被认为是细胞排出多余物质的“垃圾袋”。根据形成过程和细胞来源,EVs可分为外泌体、微囊泡、凋亡小体、神经突触小体等[4]。外泌体多数直径40~100 nm,由多囊体内体与细胞膜融合形成,可运送细胞表面受体、脂质及核蛋白、酶和核酸等。外泌体的膜结构可保护核酸不被降解。微囊泡大多直径200~1 500 nm,由细胞膜出芽形成,可运输成分与外泌体相近[5]。几乎所有细胞都能释放EVs[1]。与传统细胞间信使相比,EVs可被称作“信使云”,其作用更为丰富。
多数研究外泌体或微囊泡的文献只检测了少数标志物,因此EVs学界倾向于统称这些囊泡为EVs,以“外泌体”、 “小EVs”指代直径40~150 nm的囊泡,用“微囊泡”指代直径150~1 000 nm的囊泡。无论是EVs的内容物,还是膜表面成分均携带了来源细胞的信息。EVs数量和其中的内含物随来源细胞的状态、接受的刺激而变化,同一种细胞在不同状态下可以释放出内容物完全不同的EVs[1-2]。这种变化直接影响EVs的功能,使得靶细胞做出与分泌细胞相应的反应。
EVs与靶细胞的作用方式
与传统的信使相似,EVs介导的细胞间通信按照分泌细胞和靶细胞作用方式的不同可以分为邻分泌作用、旁分泌作用和远距分泌作用[4](图1)。邻分泌,又称并分泌,是通过膜锚定配体及其受体相互作用在相邻细胞间进行信号转导,细胞通过伸出突起表面的膜锚定配体与相邻细胞表面受体相互作用传递信号,或者通过释放EVs表面的膜锚定配体与相邻细胞的膜受体相互作用。旁分泌指EVs在组织间隙中扩散,邻近细胞通过内吞或以膜融合方式摄取囊泡,实现细胞间通信。远距分泌是分泌细胞分泌的EVs进入血管或淋巴管,随着血液或淋巴液循环至远隔器官,被靶细胞摄取的作用方式。
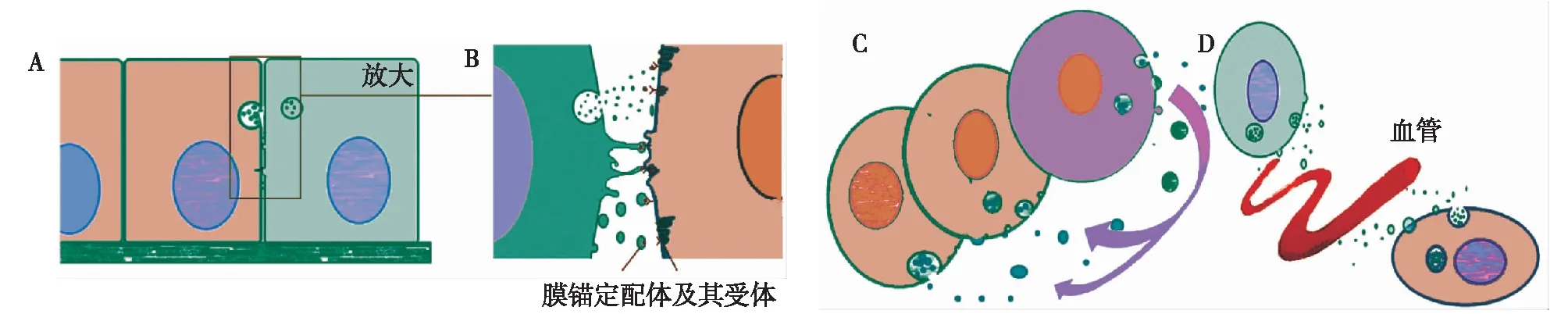
图1 细胞外囊泡(EVs)作用方式[4]A:邻分泌;B:邻分泌局部示意图, EVs表面的膜锚定配体与相邻细胞的膜受体相互作用;C:旁分泌, EVs在组织间隙中扩散,邻近细胞通过内吞或膜融合方式摄取囊泡;D:远距分泌,EVs进入血管或淋巴管,循环至远隔器官,被靶细胞摄取,参与其功能调控
EVs与靶细胞的相互作用是有选择性的,例如血小板来源EVs与巨噬细胞和内皮细胞相互作用,但是不和神经元相互作用,而中性粒细胞来源的EVs则与血小板、巨噬细胞和树突细胞相互作用[6]。
EVs与靶细胞相互作用模式可分为直接融合、被靶细胞内吞,或者间接地由膜表面受体介导信号传递、膜表面受体转移(图2)[4,6]。一旦被内化,EVs被内体隔离直至与溶酶体融合,或者与内体膜融合,将装载物释放入细胞质。

图2 EVs与靶细胞相互作用的模式图[6]EVs:细胞外囊泡;ECM:细胞外基质;EVs可以与靶细胞膜融合释放内容物,或被内吞,或者通过膜表面配体和受体转导信号;EVs也可以释放各种酶重塑细胞外基质
EVs的邻分泌和旁分泌作用
EVs的邻分泌和旁分泌作用在发育过程中起到重要作用。胚胎细胞中存在的决定细胞发育命运的物质称为成形素,组织沿着成形素浓度梯度分化,从而形成组织模式。成形素从分泌细胞分散到相邻组织。Greco等[7]证实很多成形素和细胞膜紧密相关,成形素被包裹在膜性囊泡中分泌,囊泡在空间上固定和稳定了成形素,确保了恰当的浓度梯度形成。体结囊泡包裹(NVPs)则参与哺乳动物左右轴发育,节细胞被激活后分泌含有成形素的NVPs,这些NVPs通过特殊纤毛的旋转形成的结流被运输到身体的左侧[8]。成形素从右到左的浓度梯度决定了体节和类体节内部细胞分化左右方向的极性。
EVs的邻分泌和旁分泌作用在干细胞更新、扩增和分化中起重要作用。干细胞,尤其是胚胎干细胞,能分泌大量EVs。EVs参与干细胞自我更新和亚全能干细胞及多能干细胞扩增。Ratajczak等[9]发现胚胎干细胞分泌的EVs可通过干细胞扩张因子Wnt-3和多能干细胞转录因子八聚体转录因子4及其mRNA诱导造血干细胞转化。Deregibus等[10]发现人内皮祖细胞来源EVs可通过转运mRNA引起人血管内皮细胞的血管生成,并且EVs转运的mRNA可在靶细胞被翻译成相应蛋白。干细胞分泌的EVs同样富含调节干细胞信号通路蛋白表达的miRNA[6]。EVs通过转运干细胞扩增、分化过程中重要的miRNA、蛋白及其mRNA,协调统一干细胞群体的生物行为,为细胞分化的有序性奠定基础。
EVs的旁分泌作用既可激活免疫细胞,也可维持免疫耐受。Raposo等[11]发现B细胞内特殊的晚期内体包裹了大量富含新合成的主要组织相容性复合体II (MHC II)分子的膜性囊泡,这些囊泡能够引起T细胞MHC II分子限制性反应。B细胞每天丢失50%的膜MHC II分子,其中12%是通过EVs释放的,这些MHC II 分子可引起T细胞活化[12]。树突细胞也通过类似方式激活T细胞[13]。抗原递呈细胞(APC)来源的EVs激活T细胞能力比APC差,当向APC-EVs添加大量MHC时,APC-EVs激活T细胞能力提高,说明EVs通过提呈抗原的作用依赖于EVs表面MHC分子数量[14]。免疫突触是T细胞和抗原提呈细胞间进行抗原识别的精细结构, EVs运输是免疫突触进行细胞通信的重要方式[5]。树突状细胞(DC)间通过EVs交流扩大自身功能,未成熟DC和成熟DC含有不同mRNA和microRNA(miRNA),DC来源EVs包裹着影响DC前体细胞分化、DC发育的miRNA和mRNA,靶细胞内吞EVs后这些内容物进入靶细胞,从而调节DC的发育分化[15]。
EVs的旁分泌作用同样参与肾脏损伤修复,许多研究表明骨髓干细胞通过定植后的旁分泌作用促进损伤后残余的肾小管上皮细胞增殖。Bruno等[16]发现骨髓干细胞通过分泌EVs促进急性肾损伤(AKI)小管修复,尾静脉注射EVs和骨髓干细胞移植对AKI的保护作用相似,RNA酶(RNase)处理的骨髓干细胞EVs失去促AKI恢复作用。缺血再灌注模型中骨髓干细胞EVs同样通过miRNA抑制肾小管上皮细胞凋亡,促进小管上皮细胞增殖,并且能够减少AKI后慢性肾脏病(CKD)的发生[17]。和野生型间充质干细胞相比,敲除Drosha的间充质干细胞在分泌EVs数量、EVs表面分子表达、EVs被肾小管上皮细胞吸收能力方面无差别,但敲除Drosha的间充质干细胞来源EVs对AKI小鼠无损伤修复功能,AKI中肾小管上皮细胞下调的基因mRNA在给予野生型间充质干细胞来源EVs后恢复正常水平,该作者对AKI小鼠进行转录组学研究发现,AKI后小管脂肪酸代谢相关基因下调,而炎症、细胞间黏附分子、基质受体基因上调,给予间充质干细胞来源EVs可逆转这些变化,给予Drosha敲除的间充质干细胞来源EVs无上述修复作用[18]。内皮祖细胞也通过旁分泌逆转AKI,通过分泌EVs传递mRNA,促进内皮细胞血管生成,抑制小管细胞凋亡,促进小管细胞增殖,减少白细胞浸润;内皮祖细胞EVs也通过减少血管变薄、小球硬化和间质纤维化延缓CKD进程[19]。内皮祖细胞EVs表达miRNA与成纤维细胞不同,富含调控增殖、血管生成和凋亡的miRNA。 敲低内皮祖细胞Dicer或者用RNase处理、去除促血管生成的miR-126和miR-296均破坏内皮祖细胞EVs的AKI保护作用。祖细胞通过EVs水平调节肾脏固有细胞基因表达,使它们进入再生程序。
在肿瘤原发部位,EVs可通过稳定细胞突起增强肿瘤细胞运动能力,也可通过将纤连蛋白等细胞外基质(ECM)成分包裹入外泌体诱导肿瘤细胞持续的定向迁移(图3)[20]。含有基质金属蛋白酶的EVs直接参与基质重塑,并促进专司降解ECM的细胞突起行使功能。ECM重塑是肿瘤细胞在组织中迁移的基础。EVs也可募集成纤维细胞和骨髓来源细胞等亲肿瘤间质细胞并促进它们分化。而成肿瘤相关纤维细胞分泌的EVs又可使肿瘤细胞获得耐药性。
EVs的远距分泌作用
常见的EVs远距分泌作用见于血细胞与肾脏固有细胞等实质细胞之间。EVs的远距分泌作用参与自身免疫疾病发展。血管炎患者白细胞来源激肽B1受体阳性微囊泡数量高于健康对照,并且血管炎患者B细胞来源微囊泡也表达B1受体,而正常人B细胞不表达B1受体,Kahn等[21]通过免疫电镜研究发现白细胞来源微囊泡可向肾小球血管内皮细胞运输B1受体,体外试验表明中性粒细胞来源微囊泡使靶细胞膜表面B1受体增加,使得靶细胞可被激肽系统激活,说明白细胞来源微囊泡可能参与肾脏炎症。外泌体、微囊泡和凋亡小体分别含有不同的损伤相关分子模式(DAMPs)及重要的自身抗原[22]。滑膜EVs含有类风湿性关节炎(RA)可能的致病自身抗原瓜氨酸蛋白。RA患者的血小板来源微囊泡(PMV)数量高于正常人,PMVs包含促炎细胞因子,PMVs和滑膜液EVs能导致关节炎症。系统性红斑狼疮(SLE)患者血液EVs数量也高于正常人, PMVs数量和抗DNA抗体量负相关[23]。EVs运输的DNA能和抗DNA抗体结合,引起免疫反应。SLE患者PMVs与类风湿关节炎、青少年特发性关节炎和健康人PMVs相比,拥有特殊的蛋白表达谱。SLE患者循环中内皮细胞微囊泡数量增加则反映内皮功能紊乱。这些囊泡促进凝血,参与心血管损害过程。
EVs远距分泌作用在肿瘤领域中有较多的研究。宿主细胞和肿瘤细胞分泌的外泌体介导肿瘤生长、侵袭和转移(图3)[20]。肿瘤细胞来源外泌体(TExs)含有miRNAs和RNA诱导沉默复合体装载复合体(RLC) ,可在细胞外将前体miRNA加工为成熟 miRNAs[24]。乳腺癌细胞外泌体处理靶细胞后抑制抗肿瘤免疫。患者血清外泌体通过Dicer依赖方式促进正常上皮细胞形成肿瘤。高侵袭性黑素瘤细胞分泌的外泌体使血管通透性增加,促进骨髓来源细胞迁移到靶器官,形成转移微环境;高侵袭性肿瘤外泌体处理低侵袭性肿瘤后永久地改变低侵袭性肿瘤细胞的侵袭能力和转移方向;这些外泌体具有特定的运载物,包括原癌蛋白,酪氨酸蛋白酶相关蛋白2(TYRP2)等[25]。
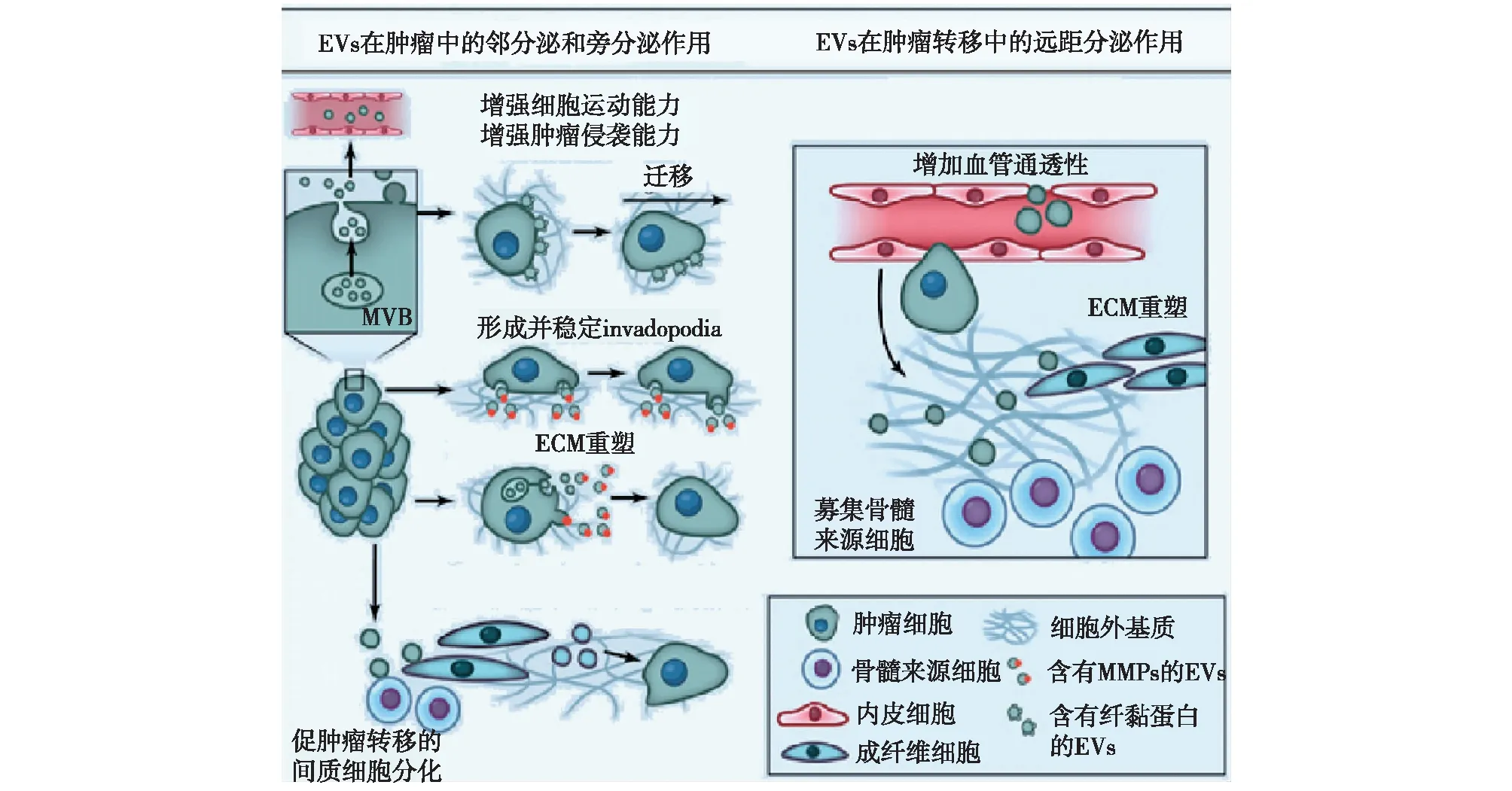
图3 EVs介导肿瘤生长、侵袭和转移[20]左侧:EVs在肿瘤侵袭中的邻分泌和旁分泌作用;右侧:EVs在肿瘤转移中的远距分泌作用;MVB:多囊泡内体;EVs:细胞外囊泡;ECM:细胞外基质;MMPs:基质金属蛋白酶;invadopodia:肿瘤细胞侵袭过程中形成的伪足
EVs的远距分泌作用解释了肿瘤定向转移学说。不同转移特性肿瘤细胞的TExs具有不同的整合素表达谱:外泌体整合素α6β4和 α6β1与肺定向转移有关,而αvβ5与肝定向转移有关;外泌体整合素被肺和肝的固有细胞摄取后增加促炎基因表达,为转移准备特定“土壤”,奠定转移瘤器官特异性基础;临床数据也表明TExs整合素可预测肿瘤转移器官[26]。胰腺导管腺癌(PDAC)分泌的外泌体定向进入肝脏[27],PDAC外泌体刺激库夫细胞分泌转化生长因子β(TGF-β),形成肿瘤转移微环境。
TExs通过两方面发挥免疫抑制作用:阻断DC、自然杀伤细胞、CD4+T细胞、CD8+T细胞等免疫细胞的抗肿瘤作用,诱导髓样抑制性细胞、T调节细胞、B调节细胞等免疫抑制细胞[28]。TExs可激活巨噬细胞,巨噬细胞也可通过模式识别受体识别TExs的RNA和蛋白复合体诱导炎症反应[29],TExs与TLR2结合,激活巨噬细胞核因子κB信号通路,释放白细胞介素6(IL-6),肿瘤坏死因子α和单核细胞趋化蛋白1等促炎因子。TExs包含的大量非编码小RNA也可以被Toll一样受体(TLR)识别,TLR7和TLR8识别TExs来源miRNAs,激活巨噬细胞,释放促炎因子。因此,外泌体通过促进肿瘤相关慢性炎症参与肿瘤生长、侵袭和转移。
EVs在感染中同样起重要作用。肝脏中乙型肝炎病毒会刺激抗感染肝脏非实质细胞如库普弗细胞释放外泌体,并将其输送到病毒易感的肝细胞处[28]。这些外泌体通过选择性包裹富集干扰素γ等各种抗病毒分子,肝细胞可利用这些分子来抵抗病毒感染。外泌体中多样的抗病毒分子使得病毒很难进化出针对其中一种或多种的躲避机制,利用外泌体进行抗病毒分子的输送可能一种有效的免疫武器。
EVs实现远距分泌作用的前提是随体液循环,一旦循环途径被阻断,其远距分泌作用也被阻止。淋巴结被膜下静脉窦CD169+巨噬细胞大量摄取TExs,阻止肿瘤外泌体进入淋巴结皮质从而促进抗肿瘤免疫[29],肿瘤进展或使用化疗药物可破坏这层免疫屏障,导致肿瘤转移,这也揭示了化疗加重肿瘤转移的可能机制。
小结:囊泡分泌是细胞的基本生命过程,EVs介导的细胞间通信以前一直被忽视,随着研究进展,EVs在细胞通信中的作用越来越明确。EVs通过特定的受体、黏附分子定向作用于靶细胞,通过脂质、细胞因子、核酸激活靶细胞蛋白信号通路,调节靶细胞基因表达。EVs同时运载细胞通信多种信号,复杂而精细地调节细胞间的信息交换。EVs介导的细胞通信在邻分泌、旁分泌、远距分泌水平均发挥重要作用。EVs研究为揭示疾病发生、进展和发现新的治疗靶点提供了新思路,也为很多疾病提供了也为很多疾病的治疗提供了新方法。
1 Raposo G,Stoorvogel W.Extracellular vesicles:exosomes,microvesicles,and friends.J Cell Biol,2013,200(4):373-383.
2 Valadi H,Ekström K,Bossios A,et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells.Nature Cell Biology,2007,9(6):654-659.
3 Zhang Y,Liu D,Chen X,et al.Secreted monocytic miR-150 enhances targeted endothelial cell migration.Mol Cell,2010,39(1):133-144.
4 Akers JC,Gonda D,Kim R,et al.Biogenesis of extracellular vesicles (EV):exosomes,microvesicles,retrovirus-like vesicles,and apoptotic bodies.J Neurooncol,2013,113(1):1-11.
5 Antonyak MA,Cerione RA.Emerging picture of the distinct traits and functions of microvesicles and exosomes.Proc Natl Acad Sci U S A,2015,112(12):3589-3590.
6 Turturici G,Tinnirello R,Sconzo G,et al.Extracellular membrane vesicles as a mechanism of cell-to-cell communication:advantages and disadvantages.Am J Physiol Cell Physiol,2014,306(7):C621-633.
7 Greco V,Hannus M,Eaton S.Argosomes:a potential vehicle for the spread of morphogens through epithelia.Cell,2001,106(5):633-645.
8 Hirokawa N,Tanaka Y,Okada Y.Left-right determination:involvement of molecular motor KIF3,cilia,and nodal flow.Cold Spring Harb Perspect Biol,2009,1(1):p.a000802.
9 Ratajczak J,Miekus K,Kucia M,et al.Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors:evidence for horizontal transfer of mRNA and protein delivery.Leukemia,2006,20(5):847-856.
10 Deregibus MC,Cantaluppi V,Calogero R,et al.Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizontal transfer of mRNA.Blood,2007,110(7):2440-2448.
11 Raposo G,Nijman HW,Stoorvogel W,et al.B lymphocytes secrete antigen-presenting vesicles.J Exp Med,1996,183(3):1161-1172.
12 Muntasell A,Berger AC,Roche PA.T cell-induced secretion of MHC class II-peptide complexes on B cell exosomes.Embo J,2007,26(19):4263-4672.
13 Nolte-′t Hoen EN,Buschow SI,Anderton SM,et al.Activated T cells recruit exosomes secreted by dendritic cells via LFA-1.Blood,2009,113(9):1977-1981.
14 Robbins PD,Morelli AE.Regulation of immune responses by extracellular vesicles.Nat Rev Immunol,2014,14(3):195-208.
15 Montecalvo A,Larregina AT,Shufesky WJ,et al.Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes.Blood,2012,119(3):756-766.
16 Bruno S,Grange C,Deregibus MC,et al.Mesenchymal Stem Cell-Derived Microvesicles Protect Against Acute Tubular Injury.J Am Soc Nephrol,2009,20(5):1053-1067.
17 Gatti S,Bruno S,Deregibus MC,et al.Microvesicles derived from human adult mesenchymal stem cells protect against ischaemia-reperfusion-induced acute and chronic kidney injury.Nephrol Dial Transplant,2011,26(5):1474-1483.
18 Collino F,Bruno S,Incarnato D,et al.AKI Recovery Induced by Mesenchymal Stromal Cell-Derived Extracellular Vesicles Carrying MicroRNAs.J Am Soc Nephrol,2015,26(10):2349-2360.
19 Cantaluppi V,Gatti S,Medica D,et al.Microvesicles derived from endothelial progenitor cells protect the kidney from ischemia-reperfusion injury by microRNA-dependent reprogramming of resident renal cells.Kidney Int,2012,82(4):412-427.
20 Tkach M,Théry C.Communication by Extracellular Vesicles:Where We Are and Where We Need to Go.Cell,2016,164(6):1226-1232.
21 Kahn R,Mossberg M,Ståhl AL,et al.Microvesicle transfer of kinin B1-receptors is a novel inflammatory mechanism in vasculitis.Kidney Int,2017,91(1):96-105.
22 Buzas EI,György B,Nagy G,et al.Emerging role of extracellular vesicles in inflammatory diseases.Nat Rev Rheumatol,2014,10(6):356-364.
23 Sellam J,Proulle V,Jüngel A,et al.Increased levels of circulating microparticles in primary Sjogren's syndrome,systemic lupus erythematosus and rheumatoid arthritis and relation with disease activity.Arthritis Res Ther,2009,11(5):R156.
24 Melo SA,Sugimoto H,O'Connell JT,et al.Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis.Cancer Cell,2014,26(5):707-721.
26 Hoshino A,Costa-Silva B,Shen TL,et al.Tumour exosome integrins determine organotropic metastasis.Nature,2015,527(7578):329-335.
27 Costa-Silva B,Aiello NM,Ocean AJ,et al.Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver.Nat Cell Biol,2015,17(6):816-826.
28 Li J,Liu K,Liu Y,et al.Exosomes mediate the cell-to-cell transmission of IFN-[alpha]-induced antiviral activity.Nat Immunol,2013,14(8):793-803.
29 Pucci F,Garris C,Lai CP,et al.SCS macrophages suppress melanoma by restricting tumor-derived vesicle-B cell interactions.Science,2016,352(6282):242-246.
(本文编辑 青 松 春 江)
Extracellular vesicles: an emerging messenger of intercellular communication
ZHANGSipan,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Extracellular vesicles (EVs) are cell-derived lipid bilayer membrane vesicles. As increasingly exemplified in the literature, distant cells can exchange information by sending out signals, via EVs stuffed with a selection of proteins, lipids, and nucleic acids, such as mRNA, microRNA and plasmid DNA. EVs also target recipient cells by bearing specific intercellular adherent molecules. Up taking EVs leads to modification of cell function and extracellular matrix. This review covers some of the most striking functions described for EVs in intercellular communication but also presents the limitations on our knowledge of their physiological roles.
extracellular vesicles intercellular communication exosomes microRNA
10.3969/cndt.j.issn.1006-298X.2017.03.013
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2017-01-03
