维持性血液透析患者血管通路使用情况分析
2017-07-05任红旗何群鹏贾凤玉龚德华
任红旗 何群鹏 贾凤玉 李 川 徐 斌 龚德华
维持性血液透析患者血管通路使用情况分析
任红旗 何群鹏 贾凤玉 李 川 徐 斌 龚德华
目的:分析南京总医院国家肾脏疾病临床医学研究中心血液透析患者首次和目前血管通路使用情况及影响因素。 方法:将2015年7月~2015年12月间在院行维持性血液透析治疗的患者纳入研究。 结果:294例患者,男性189例(64.3%),女性105例(35.7%),年龄53.2±15.1岁(15~87岁),透析龄6.2年(0.3~32)年。首次透析血管通路为动静脉内瘘56例(19.0%),无涤纶套导管235例(79.9%)。维持性血液透析患者血管通路动静脉内瘘占91.8%,带隧道带涤纶套导管占6.1%。年龄>65岁患者动静脉内瘘使用率开始减少,导管使用率增加。无涤纶套导管置管部位主要以颈内静脉为主,感染发生率为0.52/1 000导管日。自体动静脉内瘘部位主要以左桡动脉-头静脉为主(75.4%),早期并发症主要是术后血栓形成,晚期并发症包括内瘘堵塞、动脉瘤样扩张/动脉瘤形成及肢体水肿等。 结论:首次血液透析时血管通路以无涤纶套导管为主,维持性血液透析阶段血管通路以动静脉内瘘为主。导管置管部位主要以颈内静脉为主,且感染发生率较低。动静脉内瘘部位以左侧桡动脉-头静脉为主,早期并发症主要是术后血栓形成,晚期并发症包括内瘘堵塞、动脉瘤样扩张/动脉瘤形成及肢体水肿等。
血液透析 血管通路 动静脉内瘘 无涤纶套导管 带隧道带涤纶套导管
近年来,血液透析患者迅速增加,血管通路是透析患者的生命线,因此血管通路的选择对透析治疗至关重要,对透析效果和患者的长期存活有重要影响。血液透析患者死亡率增高,在某种程度上与血管通路相关的并发症和功能紊乱密切有关。
目前国内对血管通路的选择越来越重视,然而,血管通路使用情况,各家报道不一,缺乏详细的研究。因而,本研究针对本中心血液透析患者血管通路进行横断面研究,以明确首次透析和维持性血液透析患者血管通路使用情况,为血液透析患者血管通路选择提供一定的依据。
对象和方法
病例资料 将2015年7月~2015年12月在南京总医院国家肾脏疾病临床医学研究中心血液透析中心进行维持性血液治疗的患者纳入研究。排除各种原因引起的急性肾损伤、药物中毒等。
研究方法 资料收集来自于本中心透析患者登记本、海泰电子资料库、血液透析记录单及问卷调查。收集的资料包括:年龄、性别、开始进入血液透析基线资料、原发病、透析龄及合并症等。无涤纶套导管和带隧道带Cuff导管置管部位、留置时间、并发症;动静脉内瘘或移植血管动静脉内瘘(AVG)情况,包括内瘘建立部位、成熟时间、使用寿命及内瘘使用并发症。
问卷调查包括教育程度、透析前未造瘘的原因及内瘘堵塞的原因等。透析前未造瘘的原因包括无人告知、不愿意手术、发现时即尿毒症、血管条件差以及准备肾移植等。教育程度分为本科以上、大专、高中/中专及初中以下。内瘘堵塞的原因包括内瘘术后有无出血、外力压迫、感染等。
实验室检查 所有患者均检测血红蛋白(Hb)、血小板(PLT)、血清尿素氮(BUN)、血清肌酐(SCr)、血钾、血钠、血氯、血钙及尿素清除指数(Kt/V)等指标。
疑似导管感染时,分别从导管静脉端和外周静脉留取血液,双瓶同时送检微生物学检测。
导管感染定义 导管相关的血源感染(CRBSI):有感染的症状,至少一个经皮血液培养和导管末端培养,或者导管接口和外周静脉两份血液培养,培养出相同微生物[1-2]。导管感染率计算采用1 000导管日感染发生率表示[3-4]。
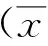
结 果
一般资料 共筛查315例患者,最终294例患者符合条件入选本研究。其中男性189例(64.3%),女性105例(35.7%),年龄53.2±15.1岁(15~87岁),且40~60岁居多(46.9%);透析龄6.2(0.3~32)年,以5~10年居多(37%)(图1)。患者体重64.4±12.2 kg,BMI 22.4±3.6 kg/m2。原发病包括:原发性肾小球疾病116例、糖尿病肾病24例、高血压肾损害22例、遗传性肾病12例、狼疮性肾炎7例、间质性肾炎6例、紫癜性肾炎4例、原因不明者103例。透析方式:普通血液透析230例(78.2%),血液透析滤过64例(21.8%);Kt/V为1.38±0.25。
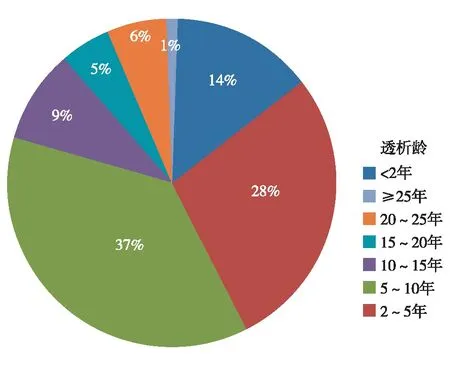
图1 患者透析龄分布
首次血液透析血管通路使用情况 294例患者首次血液透析血管通路为动静脉内瘘者56例,无涤纶套导管235例,直接穿刺3例。首次血管通路选择与学历无相关性。
238例首次血液透析前未建立动静脉内瘘的原因包括:55例(23.1%)患者不知晓,133例(55.9%)患者首次就诊时即诊断尿毒症,20例(8.4%)患者自己或家人不同意,26例(10.9%)患者血管条件不好(10.9%),4例(1.7%)患者等待肾移植。
维持性血液透析血管通路情况 294例维持性血液透析患者血管通路分布:270例(91.8%)患者使用内瘘,18例(6.1%)患者使用带隧道带涤纶套导管,4例患者使用无涤纶套导管,2例患者分别使用移植血管及直接动静脉穿刺。
进一步分析发现,年龄与血管通路间存在一定关系。年龄在65~74岁组内瘘使用率开始下降,导管使用率升至10.5%;在75岁以上组导管使用率升至22.6%,五组间比较存在着统计学上差异(χ2=16.69,P=0.003)(图2)。
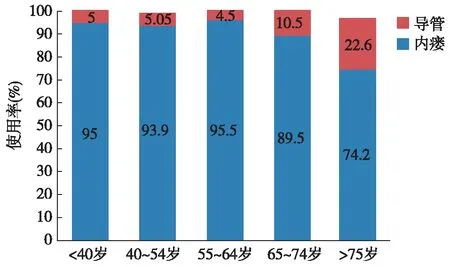
图2 年龄与血管通路关系
分析透析龄与血管通路的关联,发现透析龄小于2年者长期带隧道带Cuff导管使用率高于其他各组,并与透析龄在2~5年组相比具有统计学意义(χ2=3.98,P=0.046)。透析龄超过20年的患者全部使用动静脉内瘘(图3)。
图3 透析龄与血管通路关系**:透析龄<2年组 vs 2~5年组,P=0.046
无涤纶套导管
置管部位 235例患者首次血管通路为无涤纶套导管,颈内静脉置管209例(88.9%)[右侧颈内静脉197例(83.8%)];股静脉26例(11.1%)[右侧股静脉18例(7.7%)]。
留置时间及并发症 无涤纶套导管首次使用时间60d(30,90)d,最短留置5天,最长留置2 066d。
384例次置管共发生12次(3.1%)置管并发症:穿刺针误穿动脉 10例次(2.6%),周围血肿2例次(0.5%)。21例患者发生疑似导管感染23例次,11例次双瓶培养有明确的细菌生长,导管感染发生率为0.52/1 000导管日。
自体动静脉内瘘 284例患者有过内瘘手术史,其中本院手术259例(91.2%)。内瘘血管部位:左桡动脉-头静脉214例(75.4%),右桡动脉-头静脉60例(21.1%),左肱动脉-肘正中静脉4例(1.4%),右肱动脉-肘正中静脉4例(1.4%),右肱动脉-头静脉2例(0.7%)。端端吻合274例(96.5%),侧侧吻合8例(2.8%),端侧吻合2例(0.7%)。
284例患者内瘘手术后早期并发症包括出血3例(1.1%),手术失败13例(4.6%)。手术失败的原因,包括血流量不足2例(15.4%),血栓形成11例(84.6%)。9例患者重新内瘘手术成功。
首次透析时未行内瘘手术者共有238例中228例在透析后进行内瘘手术,其中215例内瘘手术成功(94.3%)。首次透析开始前和开始后内瘘手术成功者比较,发现两组在内瘘成熟时间上有明显统计学差异,透析后手术组明显低于透析前手术组 (表1)。
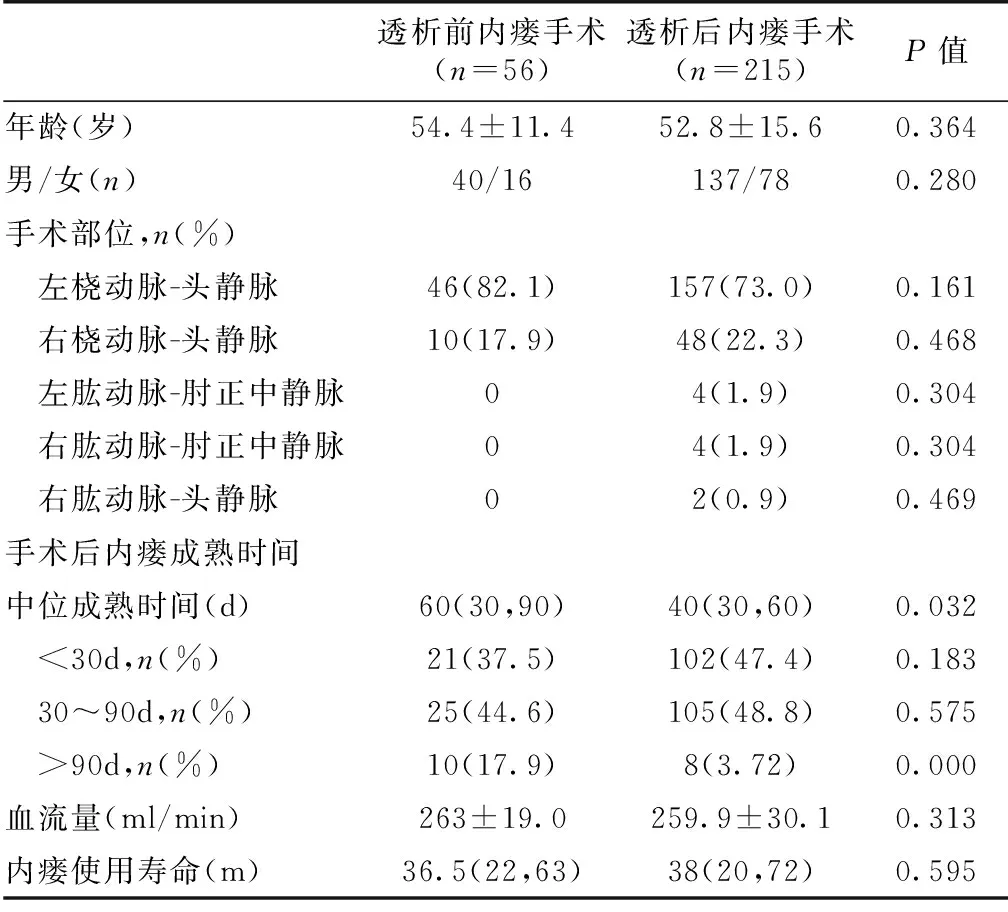
表1 首次透析前和透析后内瘘手术成功患者的一般情况
280例内瘘手术成功患者晚期并发症包括内瘘堵塞125例(44.6%),动脉瘤样扩张或动脉瘤形成107例(38.2%),血流量不足9例(3.2%),肢体水肿3例(1.1%),感染2例(0.7%)。
讨 论
建立血管通路是血液透析的前提条件,且血管通路质量直接影响患者的透析和生存质量[5],选择合适的血管通路对血液透析患者的透析和生存质量具有重要的意义。
血管通路选择 本研究中维持性血液透析患者原发病以慢性肾小球肾炎为主,年龄40~70岁为多,透析龄5~10年居多。首次血液透析时血管通路的选择,主要以无涤纶套导管为主,内瘘使用率仅占19%。与透析预后和实践模式研究(DOPPS)Ⅱ相比,我们首次透析内瘘使用率与美国(18%)相近,低于欧洲(50%)和加拿大(26%)[6],但远高于印度(4%)[7]。首次血液透析前未建立内瘘的主要原因是多数患者首次就诊时即诊断尿毒症,此外,约23%患者就诊时无人告知需行内瘘手术。而在西方国家,尤其在加拿大,首次未使用内瘘的主要原因却是多数患者等待内瘘手术时间过长[6]。有研究认为,学历与首次血管通路选择有一定关系,然而,我们研究发现学历与首次血管通路选择并无明显联系[8-9]。
本中心维持性血液透析患者血管通路仍以自体动静脉内瘘为主,高达91.8%,带隧道带涤纶套导管使用率仅为6.12%,与DOPPS V研究相比,本中心内瘘使用率与日本相仿(91%),高于美国(68%)、英国(80%)等国家;导管使用率仅高于日本(0.1%),明显低于美国(15%)、英国(16%)等国家[10]。
本研究中仅1例患者使用AVG,明显低于其他国家,原因可能与糖尿病患者比例较低、经济条件等因素有一定关系,也可能与医师、患者的接受程度存在着一定关系。
年龄、透析龄与血管通路 DOPPS V研究发现维持性透析患者不同年龄组间血管通路使用仅在75岁以上组存在差异,其内瘘使用率下降,导管使用率轻度增加[10]。本研究发现 <65岁患者年龄与血管通路使用间不存在相关性;年龄在65岁以上患者导管使用率明显增加,内瘘使用率减少。
Tsuchida等[11]报道,透析龄越长内瘘使用率越低,而AVG使用随透析龄延长使用率逐渐增加,透析龄在25年以上者AVG使用率高达12.5%。本研究发现透析龄<2年者内瘘使用率最低,仅78%,明显低于其他组。与日本研究不同的是,除透析龄<2年组,本中心其他年龄组内瘘使用率均高于日本相同透析龄患者,特别是透析龄>20年的20例患者均使用自体动静脉内瘘。
血管通路的部位及并发症 本中心无涤纶套导管置管部位主要以颈内静脉为主,并且首选右侧颈内静脉,这与文献报道一致[7,12]。置管并发症及导管感染发生率较低。
本中心自体动静脉内瘘部位主要以左桡动脉-头静脉AVF为主,首选端端吻合[13-15]。进一步对透析开始前和开始后行内瘘手术的一般情况进行比较,发现两组在内瘘成熟时间上,透析后手术组明显低于透析前手术组,进一步分析发现成熟时间>3个月者两组差异比较明显,分析其原因可能是透析开始前内瘘手术后成熟时间比较充裕,而透析开始后内瘘成熟时间由于受导管功能不良、导管感染等原因,导致无涤纶套导管使用时间较短,血管通路过早切换到动静脉内瘘,从而影响内瘘成熟时间[14,16-18]。
本研究动静脉内瘘早期并发症包括轻度渗血和手术失败。手术失败的原因主要是术后血栓形成(3.87%),与Salahi等[18]报道发生率基本相似(3.1%)。13例首次手术失败的患者中有9例患者再次手术取得成功。动静脉内瘘晚期并发症主要包括内瘘堵塞、动脉瘤样扩张或动脉瘤形成、血流量不足、肢体水肿以及感染等。内瘘堵塞是内瘘使用过程中常见并发症之一,Salmela等[19]报道内瘘手术后在透析开始前有46%患者发生内瘘堵塞,此外,Huijbregts等[20]报道,内瘘使用后3月、6月、12月及18月通畅率分别是71%、57%、49%和39%。我们中心内瘘堵塞发生率为44.6%[21-23]。
本文属横断面研究,样本量较小;由于部分患者资料缺失,只能通过问卷获取资料,对结果的可靠性有一定的影响。且未观察血管通路对患者远期预后的影响。
总之,通过横断面研究发现,本中心首次血液透析血管通路以无涤纶套导管为主,尽管动静脉内瘘使用率并不低于美国等西方国家,却明显低于中国血液透析血管通路专家共识规定的“内瘘第一”的要求;维持性血液透析患者以自体动静脉内瘘为主(91.8%),并以左桡动脉-头静脉、端端吻合术式居多。动静脉内瘘早期并发症主要是血栓形成,晚期并发症包括内瘘堵塞、动脉瘤样扩张或动脉瘤形成及肢体水肿等。
1 Parienti JJ,Thirion M,Mégarbane B,et al.Femoral vs jugular venous catheterization and risk of nosocomial events in adults requiring acute renal replacement therapy:a randomized controlled trial.JAMA,2008,299(20):2413-2422.
2 Chua HR,Schneider AG,Sherry NL,et al.Initial and extended use of femoral versus nonfemoral double-lumen vascular catheters and catheter-related infection during continuous renal replacement therapy.Am J Kidney Dis,2014,64(6):909-917.
3 Lorente L,Martín MM,Vidal P,et al.Should central venous catheter be systematically removed in patients with suspected catheter related infection? Crit Care,2014,18(5):564.
4 Sabatier C,García X,Ferrer R,et al.Blood culture differential time to positivity enables safe catheter retention in suspected catheter-related bloodstream infection:a randomized controlled trial.Med Intensiva,2015,39(3):135-141.
5 Collins AJ,Foley RN,Chavers B,et al.US Renal Data System 2013 Annual Data Report.Am J Kidney Dis,2014,63(1 Suppl):A7.
6 Mendelssohn DC,Ethier J,Elder SJ,et al.Haemodialysis vascular access problems in Canada:results from the Dialysis Outcomes and Practice Patterns Study (DOPPS II).Nephrol Dial Transplant,2006,21(3):721-728.
7 Hemachandar R.Analysis of Vascular Access in Haemodialysis Patients-Single Center Experience.J Clin Diagn Res,2015,9(10):OC01-04.
8 李剑莹,郝丽,张江淮,等.维持性血液透析血管通路现状及影响因素分析.安徽医科大学学报,2015,50(4):555-557.
9 周参新,蒋华,张萍,等.终末期肾病患者首次血液透析血管通路应用状况的单中心研究.中华肾脏病杂志,2014,30(12):897-902.
10 Pisoni RL,Zepel L,Port FK,et al.Trends in US Vascular Access Use,Patient Preferences,and Related Practices:An Update From the US DOPPS Practice Monitor With International Comparisons.Am J Kidney Dis,2015,65(6):905-915.
11 Tsuchida K,Nagai K,Minakuchi J,et al.Vascular access for long-term hemodialysis/hemodiafiltration patients in Japan.Contrib Nephrol,2015,185:132-137.
12 Murea M,James KM,Russell GB,et al.Risk of catheter-related bloodstream infection in elderly patients on hemodialysis.Clin J Am Soc Nephrol,2014,9(4):764-770.
13 Iyem H.Early follow-up results of arteriovenous fistulae created for hemodialysis.Vasc Health Risk Manag,2011,7:321-325.
14 Sha HL,Luk TL,Tee SC,et al.Our experience in using the brachial venae comitantes as a native vascular access for hemodialysis.Hemodial Int,2016,20(2):293-297.
15 Radoui A,Lyoussfi Z,Haddiya I,et al.Survival of the first arteriovenous fistula in 96 patients on chronic hemodialysis.Ann Vasc Surg,2011,25(5):630-633.
16 中国医院协会血液净化中心管理分会血液净化通路学组.中国血液透析用血管通路专家共识(第1版).中国血液净化,2014,13(8):549-558.
17 Al-Jaishi AA,Lok CE,Garg AX,et al.Vascular access creation before hemodialysis initiation and use:a population-based cohort study.Clin J Am Soc Nephrol,2015,10(3):418-427.
18 Salahi H,Fazelzadeh A,Mehdizadeh A,et al.Complications of arteriovenous fistula in dialysis patients.Transplant Proc,2006,38(5):1261-1264.
19 Salmela B,Hartman J,Peltonen S,et al.Thrombophilia and arteriovenous fistula survival in ESRD.Clin J Am Soc Nephrol,2013,8(6):962-968.
20 Huijbregts HJ,Bots ML,Wittens CH,et al.Hemodialysis arteriovenous fistula patency revisited:results of a prospective,multicenter initiative.Clin J Am Soc Nephrol,2008,3(3):714-719.
21 Klamroth R,Orlovic M,Fritsche I,et al.The influence of thrombophilic risk factors on vascular access survival in chronic dialysis patients in a retrospective evaluation.Vasa,2013,42(1):32-39.
22 Polkinghorne KR,McDonald SP,Atkins RC,et al.Epidemiology of vascular access in the Australian hemodialysis population.Kidney Int,2003,64(5):1893-1902.
23 Sahasrabudhe P,Dighe T,Panse N,et al.Prospective long-term study of patency and outcomes of 505 arteriovenous fistulas in patients with chronic renal failure:Authors experience and review of literature.Indian journal of plastic surgery :official publication of the Association of Plastic Surgeons of India 2014,47(3):362-369.
(本文编辑 律 舟)
Analysis of vascular access in hemodialysis patients
RENHongqi,HEQunpeng,JIAFengyu,LIChuan,XUBin,GONGDehua
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingclinicalschoolofSecondMilitaryMedicalUniversity,Nanjing210016,China
Correspondingauthor:GONGDehua(E-mail:gong_doctor@126.com)
Objective:To analyze the vascular access and its complications in hemodialysis (HD) patients in our center. Methodology:Patients receiving maintence hemodialysis therapy in our center were included in this study. Results:294 patients were enrolled in our study including 189 males (64.3%) and 105 females (35.7%) aged 53.2±15.1 years, and their dialysis duration was 0.3 to 32 years.Initial access was non-cuffed temporary catheters in 235 patients (79.9%) and arteriovenous fistula (AVF) in 56 patients(19.0%). As to vascular access in maintenance hemodialysis stage, the use rate of AVF in patients with HD was 91.8% and tunneled cuffed catheter was 6.1%. Central venous access was preferentially obtained in the internal jugular vein, and the result of catheter-related infections was 0.52/1 000 catheter days in non-cuffed temporary catheters. The main creation site of AVF is radio-cephalic fistula (75.4%). Conclusion:In this cross-sectional study, we found the initial vascular access was mainly non-cuffed temporary catheter, and the mainly use of vascular access is AVF at present. Central venous access is preferentially obtained in the internal jugular vein and has a low rate of catheter-related infections. The main creation site of AVF is radio-cephalic fistula.
hemodialysis vascular access arteriovenous fistulas non-cuffed temporary catheters tunneled cuffed catheter
10.3969/cndt.j.issn.1006-298X.2017.03.007
国家科技支撑计划项目课题(2015BAI09B05),国家“精准医学”重点研发计划项目(2016YFC0904100)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
龚德华(E-mail:gong_doctor@126.com)
2016-06-20
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
