整合素相互作用蛋白Kindlin家族与表皮干细胞增殖分化相关研究进展
2017-07-05施晨璐张云鹏陶茂灿
施晨璐张云鹏陶茂灿
整合素相互作用蛋白Kindlin家族与表皮干细胞增殖分化相关研究进展
施晨璐1张云鹏1陶茂灿2
Kindlin家族;整合素;表皮干细胞
表皮干细胞(epidermal stem cells,ESCs)是皮肤组织特异性干细胞,具有自我更新和强大的增殖能力,有维持表皮自我更新、保持正常表皮结构以及促进创面修复等作用[1]。其增殖分化受多重因素的调控,一方面是其所处的微环境,即干细胞“壁龛”(niche),由各种调控因子等调控干细胞的活动[2];另一方面就是其细胞上分布的表面受体的功能状态[3]。
整合素相互作用蛋白Kindlin是一种新型的黏着斑蛋白,目前已经发现3个家族成员,包括Kindlin-1、Kindlin-2和Kindlin-3[4]。Kindlin家族主要存在于表皮干细胞胞膜上,在细胞与细胞外基质黏附中起重要作用。有研究表明,其通过促进整合素活化、参与整合素的双向信号传递实现表皮干细胞对基底膜的黏附,从而在调节细胞生存、增殖、黏附、分化等方面起着重要作用[5-8]。本文就近年有关Kindlin家族的表达与分布,其调控表皮干细胞增殖分化的作用机制以及对Wnt/茁-catenin信号通路的相关性等综述如下。
1 Kindlin家族的结构与生物学功能
1.1 Kindlin的结构特征Kindlin家族最早发现于1954年,Theresa Kindler发现一例具有先天性的皮肤水疱、皮肤脆性、光敏等临床特征的皮肤疾病患者,并将其命名为Kindler综合征[9]。之后的研究表明,Kindler综合征源于一种特定蛋白质的基因突变,该蛋白质因此被命名为Kindlin-1。目前已知在哺乳动物中有三种Kindlin蛋白:Kindlin-1、Kindlin-2和Kindlin-3,其相对分子质量约为75ku。这3个成员在结构上具有高度同源性,即含有一个典型的FERM结构域(4.1,ezrin,radixin,moesin),该结构域由标记为F1、F2和F3的3个亚结构域组成,它能与跨膜蛋白的胞内段相互作用[10]。FERM结构域是Kindlin最重要的一个结构域,在Kindlin对整合素的识别和活化中具有重要作用[11]。Kindlin的FERM结构域与踝蛋白(talin蛋白,一种与茁整合素胞内段相互作用的黏着斑蛋白)的FERM结构域氨基酸有很高的同源性(>50%)。Kindlin和talin蛋白都能通过FERM结构域中F3亚结构域的磷酸化酪氨酸结合结构域与整合素的亚基结合,并调节其功能,见图1[12-13]。当然,Kindlin的FERM结构域仍具有其自身的特点。例如,在踝蛋白等具有FERM结构域的蛋白质中,FERM结构域均位于N端,而在Kindlin中却位于C端。另外,Kindlin的FERM结构域的另一个特点就是在F2亚结构域中插入了一个底物同源区(pleckstrin-homology,PH)结构域,见图2。这给Kindlin增加了PH结构域功能的同时又保留了FERM结构域的完整性[14]。
1.2 Kindlin的组织分布研究发现,三种Kindlin基因的表达均有显著的组织特异性,在人类及小鼠中表现一致[4,15]。Kindlin-1主要在上皮细胞中表达,如角化细胞和肠上皮细胞,并存在于真皮-表皮连接区与基底膜毗邻的部位,也有少量出现在基层角化细胞的胞膜上和细胞核中[5]。Kindlin-2的表达非常广泛,在除造血细胞外的所有组织细胞,且其在平滑肌和骨骼肌中含量较高,也是唯一表达于胚胎干细胞的亚型[6]。Kindlin-3主要表达于造血系统,如脾、胸腺和淋巴结中,在心、肝、脑、骨骼肌、肾和睾丸中则没有表达[7]。在上皮细胞中,Kindlin-1主要分布于真皮-表皮连接区(dermoepidermal junction,DEJ),并且在基底层角质形成细胞的胞膜也有微弱表达。相反,Kindlin-2定位于基底层角质形成细胞的胞膜,而不在真皮-表皮连接区。在培养的上皮细胞内,Kindlin-1与Kindlin-2都定位于黏着斑。然而在人类和小鼠中均发现Kindlin家族3个成员之间不能相互代偿,每种Kindlin的缺失都可以引起其特异性表型[4]。
1.3 Kindlin与整合素活化整合素(integrin)是位于细胞表面的一类糖蛋白,它是由琢和茁亚单位通过非共价键组成的异二聚体,是细胞表面重要的兼具黏附和信号传导功能的受体[16]。其主要功能是通过其双向信号传导通路,参与细胞和细胞、细胞和细胞外基质的黏附和信号转导。
Kindlin家族与整合素功能密切相关,研究表明,Kindlin失调能够影响整合素的信号通路,造成整合素的异常调节,从而导致细胞-细胞外基质黏附和细胞骨架重塑过程发生严重缺陷[15]。研究表明,在来源于Kindler综合征患者的Kindlin-1缺失的角质细胞系中,尽管有Kindlin-2的表达,但角质细胞仍然表现出整合素茁1功能减弱的一些特点,包括异常的细胞形态、细胞黏附和细胞铺展等,表明Kindlin-1具有调控整合素功能的作用[5]。Kindlin-2定位于细胞-细胞外基质黏附位点,并直接与黏着斑蛋白及migfilin结合,研究发现Kindlin-2或migfilin的下调都会抑制细胞延展[6,13],Kindlin-2和migfilin构成了细胞-基质黏附复合体与肌动蛋白细胞骨架之间的重要连接。而在小鼠Kindlin-3基因敲除的研究中,证实了Kindlin-3是整合素活化所必需的,即使踝蛋白水平正常,缺乏Kindlin-3的血小板和白细胞中整合素也不能被活化[17]。
因此,Kindlin家族在整合素介导的双向信号传递中都具有重要作用,能通过促进整合素的有效活化对细胞的增殖分化等细胞生理过程进行调控。
2 整合素对表皮干细胞的调控
表皮干细胞是指位于表皮基底部,具有不断增殖和分化能力的干细胞,具有可增殖分化为表皮中各种细胞成分,保持皮肤正常的表皮结构的能力。在生理状态下,表皮干细胞按一定的概率与方式进行增殖分化,当机体受到损伤等情况下,干细胞的增殖分化方式会发生相应改变,以适应机体的需要[18]。而这种改变受到严格调控,通过一系列细胞、细胞因子及皮肤其他细胞相互作用完成。
正常情况下,表皮干细胞的增殖和分化一方面受干细胞所处的微环境调控,另一方面受自身表面受体的功能状态的影响。该微环境[2]又称为干细胞“壁龛”(niche),它由基质细胞、细胞外基质及各种调控因子等共同构成,能够保护干细胞不受分化、凋亡以及其他刺激的影响,同时也能够防止由于干细胞过度增殖导致的癌症。表皮干细胞表现出较高的自我更新能力,即再生增殖能力,与其黏附于干细胞巢中紧密相关。研究表明,表皮干细胞主要通过表达整合素实现对基底膜各种成分的黏附[19]。Brakebusch等[20]进行表皮干细胞体外研究发现,当表皮干细胞脱离基底细胞层进行分化时,茁1整合素表达下降并失活,在正常情况下基底以上已分化的表皮干细胞几乎不表达茁1整合素,证明了茁1整合素对表皮干细胞的分化确实具有调控作用。而Piwko-Czuchra等[21]在动物实验中证实在茁1整合素缺失的情况下,层黏连蛋白和其他基底膜成分,例如巢蛋白或IV型胶原蛋白异常沉积在小鼠的真皮层。在电镜下,薄层致密的基底膜出现断裂,年纪较大的老鼠则出现了大片纤维丢失的情况,表明了茁1整合素对层黏连蛋白V的蛋白酶解加工和在基底膜的沉积起到重要作用。
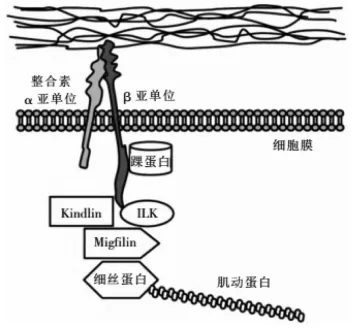
图1 Kindlin蛋白与整合素、踝蛋白与整合素的相互作用[10]
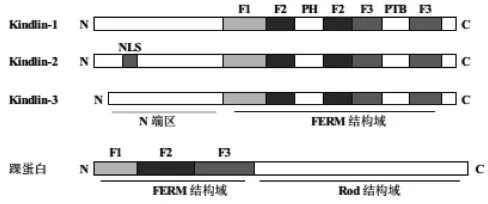
图2 Kindlin家族成员结构示意图[10-12]
3 K ind lin对表皮干细胞的调控
当干细胞“壁龛”发生改变,例如创伤发生时,胞外某些信息如细胞外基质改变等可通过整合素传递给干细胞,以触发跨膜信号转导,调控细胞的基因表达。这一过程可以改变干细胞的分裂方式,激活干细胞的多潜能性,使干细胞朝着特定的方向分化,以适应组织修复的需要[22]。而Kindlin作为一种胞内接头蛋白,能够影响整合素琢和茁两个亚基胞内段的相互作用,从而参与整合素对表皮干细胞的调控[19]。
虽然到目前为止并无有个整合素相互作用蛋白Kindlin在表皮干细胞增殖分化中的作用机制的研究,但根据以上综述,了解整合素相互作用蛋白Kindlin家族能够影响整合素介导的双向信号传递,调节表皮干细胞与细胞外基质的黏附,从而对细胞的增殖分化过程进行调控。
4 展望
随着研究的深入,表皮干细胞的作用日益受到人们的重视,在创伤修复、皮肤再造、基因治疗等方面都有很好的应用前景。整合素是表皮干细胞微环境中最为重要的蛋白之一。整合素相互作用蛋白Kindlin是一种胞内接头蛋白,通过参与整合素的双向信号传递在调节细胞生存、增殖、黏附、分化等方面起着重要作用。
目前已证实由Kindlin能够通过整合素在表皮干细胞增殖分化、黏附迁移中起到重要作用。但是Kindlin如何参与整合素分子从低亲和力转变为高亲和力?整合素如何调控表皮干细胞的发展?为何整合素在皮肤中作用显著而在其它组织器官中作用甚微?除了Kindlin和踝蛋白还有那些蛋白参与整合素的调控作用?这些问题的解决,不但可以丰富我们对Kindlin、整合素以及干细胞增殖的理论认识,而且有助于Kindlin相关疾病的临床诊治。
[1]Lewis CJ.Stem cell application in acute burn care and reconstruction[J].JWound Care,2013,22(1):7-8,10,12-16.
[2]Blanpain C,Fuchs E.Epidermal homeostasis:a balancing act of stem cells in the skin[J].Nat Rev Mol Cell Biol,2009,10(3):207-217
[3]Ordonez P,Di Girolamo N.Limbal epithelial stem cells:Role of the nichemicroenvironment[J].Stem Cells,2012,30(2):100-107.
[4]Rognoni E,Ruppert R,F觟ssler R.The kindlin family:functions,signaling properties and implications for human disease[J].JCell Sci,2016,129(1):17-27.
[5]Margadant C,Kreft M,Zambruno G,et al.Kindlin-1 regulates integrin dynamics and adhesion turnover[J].PLoSOne,2013,8(6):e65341.
[6]Bledzka K,Bialkowska K,Sossey-Alaoui K,et al.Kindlin-2 directly binds actin and regulates integrin outside-in signaling[J].JCell Biol,2016,213(1):97-108.
[7]Moretti FA,Moser M,Lyck R,et al.Kindlin-3 regulates integrin activation and adhesion reinforcementofeffector T cells[J].Proc NatlAcad SciUSA,2013,110(42):17005-17010.
[8]Hart R,Stanley P,Chakravarty P,et al.The kindlin 3 pleckstrin homology domain has an essential role in lymphocyte function-associated antigen 1(LFA-1)integrin-mediated B celladhesion andmigration[J].JBiolChem,2013,288(21):14852-14862.
[9]Kindler T.Congenital poikiloderma with traumatic bulla formation and progressive cutaneous atrophy[J].Br JDermatol,1954,66(3):104-111.
[10]Larjava H,Plow EF,Wu C.Kindlins:essential regulators of integrin signalling and cell-matrix adhesion[J].EMBORep,2008,9(12):1203-1208.
[11]Xu Z,Gao J,Hong J,et al.Integrity of kindlin-2 FE砸M subdomains is required for supporting integrin activation[J]. Biochem Biophys砸esCommun,2013,434(2):382-387.
[12]Patel H,Stavrou I,Shrestha RL,et al.Kindlin1 regulates microtubule function to ensure normalmitosis[J].JMol Cell Bio,2016,8(4):338-348.
[13]Theodosiou M,Widmaier M,B觟ttcher RT,et al.Kindlin-2 cooperates with talin to activate integrins and induces cell spreading by directly binding paxillin[J].Elife,2016,27(5):e10130.
[14]Ali RH,Khan AA.Tracing the evolution of FERM domain of Kindlins[J].Mol Phylogenet Evol,2014,80(1):193-204.
[15]杨玫,陈曦,张水文,等.整合素相互作用蛋白Kindlin家族的生物学功能研究进展[J].解剖学报,2014,46(6):865-869.
[16]Harburger DS,Calderwood DA.Integrin signalling at a glance[J].JCell Sci,2009,122(Pt2):159-163.
[17]Klapproth S,Moretti FA,Zeiler M,et al.Minimal amounts of kindlin-3 suffice for basal platelet and leukocyte functions inmice[J].Blood,2015,126(24):2592-2600.
[18]Ojeh N,Pastar I,Tomic-Canic M,et al.Stem Cells in Skin Regeneration,Wound Healing,and Their Clinical Appl=ications[J].Int JMol Sci,2015,16(10):25476-25501.
[19]李百川,李红丽.整合素调控表皮干细胞增殖分化作用机制的研究进展[J].中国细胞生物学学报,2013,35(9):1392-1396.
[20]Brakebusch C,F覿ssler R.β1 integrin function in vivo:Adhesion,migration and more[J].Cancer Metastasis Rev,2005,24(3):403-411.
[21]Piwko-Czuchra A,Koegel H,Meyer H,et al.β1 integrinmediated adhesion signalling is essential for epidermalprogenitor cell expansion[J].PLoSOne,2009,4(5):e5488.
[22]Choi HR,Byun SY,Kwon SH,et al.Niche interactions in epidermalstem cells[J].World JournalofStem Cells,2015,7(2):495-501.
(收稿:2016-05-12修回:2016-08-22)
1浙江中医药大学第一临床医学院(杭州310053);2浙江省中医院皮肤科(杭州310000)
施晨璐,Tel:18042323402;E-mail:18042323402@163.com
