破裂颅内动脉瘤夹闭术后症状性脑血管痉挛发生的相关因素研究
2017-06-30周建军官测林沈东伟胡方进蓝佛琳
周建军+官测林+沈东伟+胡方进+蓝佛琳

【摘要】 目的:对破裂颅内动脉瘤夹闭术后症状性脑血管痉挛发生的相关因素进行研究。方法:选取2013年3月-2015年3月在笔者所在医院接受破裂颅内动脉瘤夹闭治疗的86例患者作为研究对象,其中术后未出现症状性脑血管痉挛患者为对照组,出现症状性脑血管痉挛患者为观察组,并分析术后症状性脑血管痉挛发生的因素。结果:两组患者年龄、夹闭手术治疗、大脑前动脉瘤、既往颅内动脉瘤破裂史、血钙水平、手术时机选择、Hunt-Hess分级、Fisher分级比较,差异有统计学意义(P<0.05),采用Logistic回归法分析结果显示年龄、夹闭手术治疗、大脑前动脉瘤、既往颅内动脉瘤破裂史、Fisher 3级、Hunt-Hess 4级是独立因子(P<0.01)。结论:破裂颅内动脉瘤夹闭术后症状性脑血管痉挛发生的影响因素有年龄、夹闭手术治疗、大脑前动脉瘤、既往颅内动脉瘤破裂史、Fisher分级、Hunt-Hess分级。
【关键词】 破裂颅内动脉瘤夹闭术; 症状性脑血管痉挛; Logistic回归法; 相关因素
doi:10.14033/j.cnki.cfmr.2017.16.011 文献标识码 B 文章编号 1674-6805(2017)16-0020-02
颅内动脉瘤是常见脑血管疾病,导致患者残疾和死亡率在22%~25%,且逐年呈现上升趋势[1]。研究显示,当动脉瘤破裂首次出血后,可导致15%~20%的死亡率,一半以上的术后存活者会表现出不同程度的残疾,严重影响患者的生活与生命[2]。近年来随着介入技术的快速发展,血管内治疗这一微创治疗手段也广泛被患者与神经外科接受,虽然这一手术安全性较高,但作为微创技术,其手术风险仍然不能夠完全避免,临床并发症的发生率仍然在1/10左右[3],可导致患者术后不可逆残疾与死亡,而症状性脑血管痉挛为破裂颅内动脉瘤夹闭术后较为严重的并发症之一,因此对其发生的相关因素进行分析,积极预防与处理非常重要。本次研究主要以笔者所在医院治疗的86例破裂颅内动脉瘤夹闭术患者为对象,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2013年3月-2015年3月在笔者所在医院接受破裂颅内动脉瘤夹闭治疗的86例患者,根据患者术后是否出现症状性脑血管痉挛分为观察组(36例)与对照组(50例),收集患者的所有临床资料。纳入标准:术前患者均接受DSA或CTA检查,确诊为颅内动脉瘤;明确蛛网膜下腔出血诊断;接受夹闭术治疗,术中证实夹闭成功。排除标准:非动脉瘤性蛛网膜下腔出血患者、夹闭术同时接受血管内栓塞治疗;濒死患者;Hunt-Hess分级达5级。
1.2 方法
对两组患者的临床资料进行回顾性分析,主要包括年龄、发病位置、治疗方式、动脉瘤手术时间、入院时Hunt-Hess分级、CT显示蛛网膜下腔出血的Fisher分级、是否有动脉瘤破裂既往史、血钙水平。比较两组患者上述指标,并对脑血管痉挛发生的相关因素进行分析。
1.3 观察指标及评价标准
基础指标包括患者年龄、性别、职业、籍贯、发病时间等。观察患者术前确定的动脉瘤体积、位置及数量、术前患者血钙水平、手术时机情况。
术前患者Hunt-Hess分级:患者无不适症状,或出现颈项强直、轻微头痛为1级;颈强直,较重头痛,出现动眼神经等脑神经麻痹,未出现其他神经症状为2级;患者出现轻度嗜睡症状、躁动不安或轻度意识障碍为3级;偏瘫、半昏迷状态,出现早期自主神经障碍或去脑强直为4级;严重去脑强直、深度昏迷,濒危状态为5级[4]。
术前改良Fisher分级根据CT诊断判定:经CT未见脑室内出血、出血及脑实质内出血为0级;经CT仅有基底池出血为1级;经CT仅有侧裂池出血或周边脑池出血为2级;经CT发现广泛蛛网膜下腔出血伴脑实质内血肿为3级;经CT可见基底池和周边脑池、侧裂池较厚积血为4级。患者出现上述临床表现后经CT检查,排除脑积水、血肿、再出血,同时排除糖尿病、肺炎、肝肾功能障碍与水电解质紊乱患者[5]。
症状性脑血管痉挛诊断标准:患者意识清醒转向昏迷或嗜睡,蛛网膜下腔出血经治疗或休息后好转又出现进展性加重,患者持续发热,外周血白细胞数持续升高,患者出现偏盲、偏瘫伴随或不伴随感觉减退,出现不同程度的意识障碍、判断与识别能力降低[6]。
1.4 统计学处理
本研究数据采用SPSS 18.0统计学软件进行分析和处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。Logistic回归法分析对数据进行处理,对症状性脑血管痉挛发生的危险因素与保护因素,其中OR>1为危险因素,OR<1为保护因素。
2 结果
2.1 单因素分析
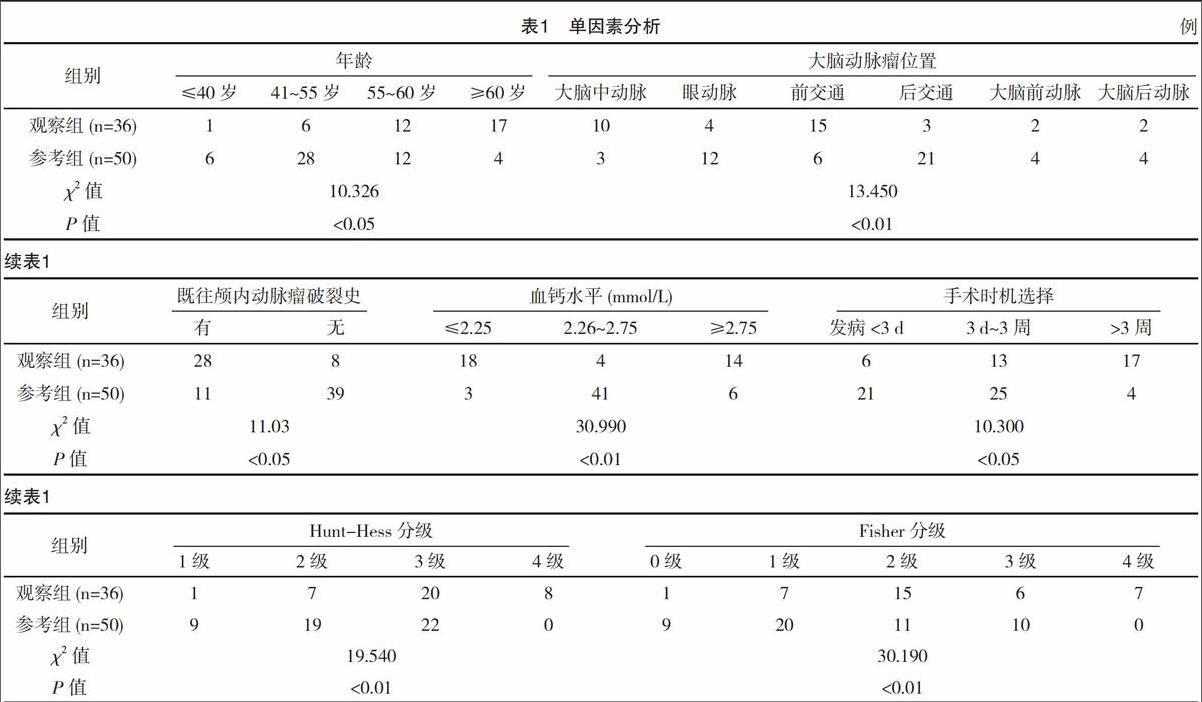
观察组患者年龄、大脑动脉瘤位置、既往颅内动脉瘤破裂史、血钙水平、手术时机选择、Hunt-Hess分级、Fisher分级比较,差异有统计学意义(P<0.05),见表1。
2.2 多因素分析
经多因素分析能够发现年龄、夹闭手术治疗、大脑前动脉瘤、既往颅内动脉瘤破裂史、Fisher 3级、Hunt-Hess 4级是术后症状性脑血管痉挛发生的独立因素,见表2。
3 讨论
颅内动脉夹闭术时破裂可引起蛛网膜下腔出血,进而引起症状性脑血管痉挛。临床证明,这一并发症的发生率在20%~40%,患者表现为脑梗死或脑缺血症状,患者生活质量差,独立行动能力丧失,同时认知功能受损较为严重,部分患者甚至出现死亡,疾病预后较差。症状性脑血管痉挛发生在蛛网膜下腔出血后3 d内为急性期,随后进入慢性痉挛期。急性发病期患者死亡率高于慢性痉挛期,表现为脑血流量降低、颅内压增高及脑灌注压先下降等[7],此时患者的微循环已经受到影响,而慢性期患者神经功能已经损害,药物治疗效果较差,患者死亡率高,因此对破裂颅内动脉瘤夹闭术后症状性脑血管痉挛按发生的相关因素进行分析有着显著的临床价值。
本次研究发现,在症状性脑血管痉挛的发生因素中,年龄≥55岁可作为独立危险因素,随着患者年龄增加血管弹性较差,脏器功能减退,一旦出现脑缺血缺氧,代偿能力差,则脑血管痉挛程度比较严重[8]。夹闭手术也是诱导这一并发症发生的独立因素,这可能是术中对载瘤动脉进行操作时,对血管造成损伤,同时脑组织牵拉、手术暴露等影响下,局部脑灌注减少,诱导缺血损害,而术后蛛网膜下腔积血清洗难度大,也可导致脑血管痉挛。临床学者普遍认为,Hunt-Hess作为动脉瘤分级系统,可预测患者疾病及预后,分级越高则病情越重,相应的预后更差[6],本次研究证明这一点。Fisher分级是依据CT反映出的网膜下腔出血时积血程度分级,这与血管痉挛的发生有着相关性。本次研究结果显示,大脑前动脉瘤患者術后发生脑血管痉挛的概率明显大于其他部位患者,而多隐私分析结果也证实这一点,然而有学者认为在脑血管痉挛的发生中,动脉瘤的位置并无影响作用。另外,本次研究中,既往脑血管破裂史也是导致术后症状性脑血管痉挛的独立因素。
综上所述,破裂颅内动脉瘤夹闭术后症状性脑血管痉挛发生的独立危险因素有年龄、夹闭手术治疗、大脑前动脉瘤、既往颅内动脉瘤破裂史、Fisher分级、Hunt-Hess分级。
参考文献
[1]刘艳,朱明秋,林丽晴,等.尼莫地平防治蛛网膜下腔出血后脑血管痉挛的疗效分析[J].神经损伤与功能重建,2014,9(3):249-250.
[2]高剑峰.显微镜直视下瘤颈夹闭术治疗颅内动脉瘤36例临床分析[J].中国实用神经疾病杂志,2013,16(13):67-68.
[3]张苏立.显微镜下颅内动脉瘤夹闭手术护理30例临床分析[J].岭南急诊医学杂志,2013,18(5):388-389.
[4]王灵芝,柯绍发,扬丽华.颅内动脉瘤介入治疗后脑血管痉挛2例报告[J].中国乡村医药,2012,19(10):49.
[5]张峰,刘建峰,李鹏,等.动脉瘤性蛛网膜下腔出血后症状性脑血管痉挛的相关因素研究进展[J].中国全科医学,2012,15(21):2378-2380.
[6]常谦,刘俊,岑键昌.改良Fisher分级与破裂动脉瘤患者症状性脑血管痉挛的关系[J].实用心脑肺血管病杂志,2012,20(7):1209-1210.
[7]俞学斌,金国良,吴承龙,等.动脉瘤性蛛网膜下腔出血后症状性脑血管痉挛预测指数的临床研究[J].浙江医学,2014,36(5):374-377.
[8]郭文才,吴勇,李锐.颅内动脉瘤性蛛网膜下腔出血术后症状性脑血管痉挛的影响因素分析[J].中国现代医生,2015,53(5):7-9.
