两种麻疹病毒和风疹病毒三重实时荧光RT-PCR检测试剂应用比较的研究
2017-06-27龚甜施勇李健雄张艳妮徐刚
龚甜,施勇,李健雄,张艳妮,徐刚
(江西省疾病预防控制中心,江西南昌330029)
·实验研究·
两种麻疹病毒和风疹病毒三重实时荧光RT-PCR检测试剂应用比较的研究
龚甜,施勇,李健雄,张艳妮,徐刚
(江西省疾病预防控制中心,江西南昌330029)
目的比较评价两种含内质控三重实时荧光RT-PCR检测试剂检测麻疹病毒和风疹病毒结果的差异。方法对江西省市级麻疹风疹实验室上送的麻疹病毒或风疹病毒核酸阳性咽拭子标本进行复核,同时用两种含内质控的麻疹病毒和风疹病毒三重荧光RT-PCR试剂盒检测,并对检测结果进行比较分析。结果麻疹病毒和风疹病毒核酸阳性咽拭子标本符合率分别为95.12%和100.00%;两种试剂检测麻疹病毒特异度和灵敏度均较好;试剂A和试剂B检测风疹病毒特异度较好,灵敏度分别为71.43%和100%;试剂A和试剂B检测人RNase P核酸灵敏度分别为100%和92.73%。结论试剂A在对麻疹病毒核酸检测方面具有较高的敏感度及特异度,有较高应用和推广价值。
麻疹病毒;风疹病毒;三重荧光RT-PCR
2013年江西省麻疹风疹实验室网络在原血清学诊断网络基础上[1],引进了麻疹病毒和风疹病毒荧光RT-PCR检测技术,并在全省进行推广,与全国麻疹风疹实验室网络同步,建立了麻疹病毒(Measles virus,MV)和风疹病毒(Rubella virus,RV)核酸快速诊断实验室网络[2]。本研究使用麻疹病毒和风疹病毒双重实时荧光RT-PCR商品化检测试剂对江西省市级麻疹风疹实验室上送的MV或RV核酸阳性咽拭子标本进行复核,同时为了更有效的监控临床标本的采样质量及因操作失误等所致的假阴性结果出现,本研究还引进余蓓蓓[3]等人关于含使用人RNase P作为内质控的麻疹病毒和风疹病毒三重实时荧光RT-PCR检测方法,并与国内1种含内质控人RNase P核酸麻疹病毒和风疹病毒三重荧光RT-PCR商品化试剂,同时对上述咽拭子标本进行复核检测,进行试剂比较研究。现将研究情况分析如下。
1 材料与方法
1.1 标本来源标本主要来自于江西省市级麻疹风疹实验室根据《全国麻疹监测方案》[4,5]对麻疹风疹疑似病例咽拭子标本进行MV和RV核酸检测的MV或RV核酸阳性咽拭子标本。其中:MV核酸阳性标本41份,RV核酸阳性标本14份。
1.2 MV和RV核酸检测
1.2.1 病毒RNA提取取咽拭子标本200μl,采用Qiagen公司的Reansy Mini kit(lot no:145046864)提取病毒RNA,具体操作步骤参照试剂盒说明书。1.2.2 MV和RV双重荧光RT-PCR商品化检测试剂麻疹病毒/风疹病毒双通道核酸检测试剂盒(PCR-荧光探针法)购自达安基因公司(Lot No:2014003)。相关操作和反应条件按照试剂盒说明书进行。反应在美国ABI荧光PCR仪7500进行。
1.2.3 含内质控MV和RV三重荧光RT-PCR检测方法
1.2.3.1 本实验室引进的含内质控MV和RV三重荧光RT-PCR检测方法引物和探针于上海生工生物工程技术服务有限公司合成,具体序列[3]见表1。

表1 含内质控麻疹病毒和风疹病毒三重荧光RT-PCR检测引物具体序列表
采用ABI公司生产的AgPath-ID(TM)Onestep RT-PCR Kit(lot no:1407156)进行反应体系配制,命名为试剂A,总体积为25μl,相关操作按照试剂盒说明书进行。反应条件:45℃10min,95℃预变性10min,95℃变性15s,60℃延伸1min,(收集荧光信号),共45个循环。反应在美国ABI荧光PCR仪7500进行。
1.2.3.2 含内质控MV和RV三重荧光RT-PCR商品化检测试剂麻疹和风疹病毒核酸检测试剂盒(荧光定量PCR方法)购自国内目前较为常见的公司,命名为试剂B(lot no:20141201)。相关操作和反应条件按照试剂盒说明书进行。反应在美国ABI荧光PCR仪7500进行。
1.3 检测结果判定根据相关试剂盒说明书判定标准对检测结果进行判定。
1.4 统计学分析运用SPSS 19.0软件对研究数据进行分析。
2 结果
2.1 MV和RV双重荧光RT-PCR检测方法41份MV核酸阳性标本,检出39份阳性,阳性符合率均95.12%。RV核酸阳性标本标本14份均为阳性,阳性符合率为100%。
2.2 含内质控MV和RV三重荧光RT-PCR检测方法
2.2.1 MV核酸检测结果比较41份MV核酸阳性标本,两种试剂均检出39份MV核酸阳性,阳性符合率均为95.12%,两种试剂检测结果与MV和RV双重荧光RT-PCR商品化检测试剂一致。见表2。

表2 两种方法检测MV比较
2.2.2 RV核酸检测结果比较试剂A均检出10份RV核酸阳性,阳性符合率均为71.43%;试剂B检出14份RV核酸阳性,阳性符合率为100%。试剂B检测结果与MV和RV双重荧光RT-PCR商品化检测试剂一致。见表3。

表3 两种方法检测RV比较
2.2 人RNase P核酸检测结果比较试剂A均检出55份人RNase P核酸阳性,阳性率为100.00%;试剂B检出51份人RNase P核酸阳性,阳性率为92.73%。见表4。
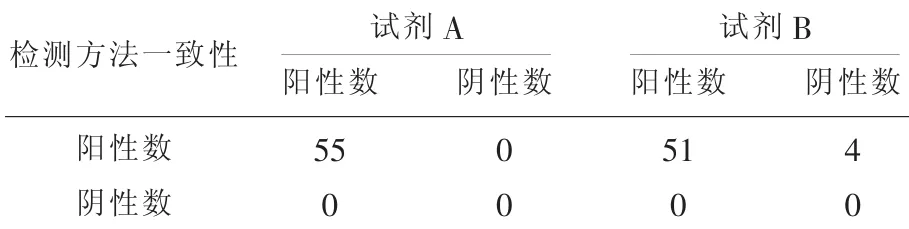
表4 两种方法检测RNase P比较
3 讨论
MV和RV均可引起急性全身性出疹性呼吸道传染病[6],二者在临床症状上较难以区分,因此,MV和RV的鉴别主要依赖于特异性的实验室诊断,尤其是在消除麻疹阶段和达到麻疹消除目标期间,由风疹引起的出疹样病例会更加的凸显。及时、敏感和特异的病原检测方法对于麻疹甚至风疹的消除极为重要的。实时荧光RT-PCR是近年发展起来的一项快速、高灵敏度和高特异性的核酸检测技术,目前,广泛用于病毒等病原微生物核酸的快速检测[7-12]。应用实时荧光RT-PCR法能够及时发现和诊断麻疹,降低麻疹的漏诊率,尤其在麻疹疫情处置中能够在几个小时内即可得到实验室确诊,为麻疹疫情的处理和控制赢取宝贵的时间[13-15]。
通过上述检测发现,江西省麻疹风疹实验室网络MV和RV核酸阳性咽拭子标本符合率分别为95.12%和100.00%;3份MV核酸阳性咽拭子标本经复核为阴性,可能与原始咽拭子标本核酸量少,经过冻融在进行复核,核酸量降至检出限有关。由于江西省麻疹病毒和风疹病毒核酸快速诊断实验室网络于2013年新建立,因此需要加强对标本采集质量和实验室网络质量控制等,为消除麻疹阶段病例的早期诊断提供可靠的实验室证据。
为了避免因人为操作失误而导致产生假阴性检测结果[16],本研究引进含使用人RNase P作为内质控的麻疹病毒和风疹病毒多重荧光RT-PCR检测方法,发现所有标本的人RNase P检测均为阳性,有效的监控了样本中的PCR抑制因素以及由操作误差所造成的假阴性结果;本方法在对麻疹病毒和以人RNase P作为内质控的核酸检测灵敏度和特异度较好,但在风疹病毒检测方面灵敏度低于商品化试剂B,而商品化试剂B在对以人RNase P作为内质控核酸检测方面灵敏度低于本研究引进的方法。另外,本研究引进的方法为实验室自行合成引物和探针,因此,在检测费用方面也仅为商品化试剂的一半。
综上所述,本研究引进的含使用人RNase P作为内质控的麻疹病毒和风疹病毒三重实时荧光RT-PCR检测方法检测费用低,在对麻疹病毒和人RNase P核酸检测具有较高的灵敏度和特异度,具有较高的应用和推广价值。但是还需要进一步改进提高风疹病毒的核酸检测灵敏度。
[1]许松涛,张燕,王慧玲,等.中国2012年麻疹/风疹实验室网络运转情况分析[J].中国疫苗和免疫,2014,20(1):62-66.
[2]龚甜,熊英,张艳妮,等.2013年江西省麻疹/风疹实验室网络运转分析[J].现代预防医学,2015,42(5):841-843.
[3]余蓓蓓,冯燕,徐昌平,等.含内质控多重荧光RT-PCR同时检测麻疹病毒和风疹病毒的研究[J].病毒学报,2010,26(2):109-114.
[4]中国疾病预防控制中心.全国麻疹监测方案[S].2009.
[5]中国疾病预防控制中心.全国麻疹监测方案[S].2014.
[6]Xiong Y,Wang D,Lin W,et al.Age-related changes in serological susceptibility patterns to measles:results from a seroepidemiological study in Dongguan,China[J].Hum Vaccin Immunother,2014,10(4):1097-2003.
[7]杨鹏飞,燕清丽,张丽萍,等.汉坦病毒通用型实时荧光定量RTPCR方法的建立及应用[J].现代预防医学,2016,43(2):321-324. [8]许联红,岳玉林,王永仿,等.双重实时荧光RT-PCR法检测肠道病毒方法的建立及应用[J].重庆医学,2016,45(33):4688-4690.
[9]唐海淑,杜相品,甫尔哈提·吾守尔,等.脊髓灰质炎病毒实时荧光定量RT-PCR方法的应用与发展[J].国际检验医学杂志,2016,37(18):2603-2605.
[10]周其伟,高秀洁,陈华云,等.H7N9禽流感病毒实时荧光RTPCR检测方法的建立与评价[J].热带医学杂志,2015,15(1):36-39.
[11]吕莉琨,杨东靖,李力,等.手足口病柯萨奇病毒A2、A4和A5型SYBR GreenⅠ实时荧光定量RT-PCR检测方法的建立[J].中国病原生物学杂志,2017,12(1):15-19.
[12]刘婷婷,谢芝勋,宋德贵,等.H3N8亚型禽流感病毒实时荧光定量RT-PCR检测方法的建立及应用[J].畜牧与兽医,2015,49 (12):84-89.
[13]Michel Y,Saloum K,Tournier C,et al.Rapid molecular diagnosis of measles virus infection in an epidemic setting[J].J Med Virol,2013,85(4):723-730.
[14]高丹,张国斌,贾妮娜.实时荧光RT-PCR法快速检测麻疹病毒核酸[J].中国卫生检验杂志,2015,25(11):1815-1819.
[15]陈玲霞,姬莉莉,孙建飞.麻疹实验室诊断中ELISA法和实时荧光定量RT-PCR法的比较[J].实用预防医学,2016,23(1):106-108.
[16]Hwang S,Kang B,Hong J,et al.Development of duplex real-time RT-PCR based on Taqman technology for detecting simultaneously the genome of pan-enterovirus and enterovirus 71[J].J Med Virol,2013,85(7):1274-1279.
Study on the Comparative of two types of triplex real-time RT-PCR detection reagent for measles virus and rubella virus
GONG Tian,SHI Yong,LI Jianxiong,ZHANG Yanni,XU Gang.
Jiangxi Provincial Center for Disease Control and Prevention,Nanchang 330029,China.
Objective A comparative evaluation of two kinds of triplex real-time RT-PCR detection reagents containing internal control for the detection of measles virus and rubella virus.Methods Provincial Measles Laboratory Network measles virus and rubella virus nucleic acid positive throat swab specimens were checked,and two kinds of triplex fluorescence quantitative PCR kits(reagent A and B)were compared.Results Measles and rubella virus nucleic acid positive throat swab specimens coincidence rate were 95.12%and 100.00%;the specificity and sensitivity of both reagents were good;the specificity of reagent A and B for detection of rubella virus were good,and their sensitivity were 71.43%and 100%;the sensitivity of reagent A and B for measuring human RNase P RNA were 92.73%and 100%respectively.Conclusions The reagent A has high sensitivity and specificity in the detection of measles virus nucleic acid,and has high application value.
∶Measles virus;Rubella virus;Three realtime RT-PCR
R446.62,R373.1
A
1674-1129(2017)03-0315-03
2016-08-17;
2017-03-10)
10.3969/j.issn.1674-1129.2017.03.007
龚甜,女,1982年生,硕士,病原生物学,主要从事麻疹病毒等传染性病毒分子生物学研究。
