2013年至2015年江西省脊髓灰质炎实验室细胞敏感性监测分析
2017-06-27刘晓庆刘师文肖芳施勇李健雄熊英
刘晓庆,刘师文,肖芳,施勇,李健雄,熊英
(江西省疾病预防控制中心,江西南昌330029)
2013年至2015年江西省脊髓灰质炎实验室细胞敏感性监测分析
刘晓庆,刘师文,肖芳,施勇,李健雄,熊英
(江西省疾病预防控制中心,江西南昌330029)
目的评价江西省疾病预防控制中心脊髓灰质炎(脊灰)实验室2013年至2015年所用细胞系对脊灰病毒的敏感性,为维持无脊灰工作提供可靠的质量保证。方法选择江西省脊灰实验室2015年制备的Sabin株Ⅰ、Ⅱ、Ⅲ型质量控制株,以及国家脊灰实验室提供的合格的无支原体污染的RD和L20B细胞系,采用96孔微量培养板滴定法测定2013年至2015年江西省江西省疾病预防控制中心脊髓灰质炎(脊灰)实验室所用细胞系对脊灰病毒的敏感性。结果江西省脊灰实验室2013~2015年细胞敏感性试验结果:人横纹肌肉瘤细胞(RD)细胞均值及标准差为:Ⅰ型7.32±0.23,Ⅱ型6.97±0.20,Ⅲ型6. 88±0.23;转人脊灰病毒受体的小鼠肺细胞系(L20B)细胞均值及标准差为:Ⅰ型7.03±0.19,Ⅱ型6.93±0.14,Ⅲ型6.62±0.18,与江西省脊灰实验室质量控制标准株(Laboratory quality control standard,LQC)的参考值相比其滴度均波动在±0.5 log10CCID50/0.1ml以内。结论2013年至2015年江西省江西省疾病预防控制中心脊髓灰质炎(脊灰)实验室所用细胞系对脊灰病毒的敏感性良好。
脊髓灰质炎病毒;细胞系敏感性实验;质量控制标准株
按照世界卫生组织(World Health Organization,WHO)要求,全球脊髓灰质炎(脊灰)网络实验室应开展细胞敏感性实验,以保持病毒分离过程中的高度敏感性,维持网络实验室的高质量运转。江西省脊灰实验室也建立了细胞系敏感性实验方法并制备江西省脊灰实验室质量控制株(Laboratory quality control standard,LQC),对实验室所用的人横纹肌肉瘤细胞(Human Rhabdomyo-sarcoma, RD),和转人脊灰病毒受体的小鼠肺细胞系(Mouse Cell Line Expressing the Gene for the Human Cellular Receptor for Poliovirus,L20B)细胞敏感性进行评价。现将2013年至2015年细胞敏感性实验结果进行分析如下。
1 材料与方法
1.1 毒株的选择2005年制备的江西省脊灰实验室质量控制株,每管0.1ml,-70℃冰箱保存。
1.2 细胞无支原体污染的合格RD,L20B细胞系,从国家脊灰实验室获得。
1.3 细胞系敏感性实验用96孔微量培养板滴定法[1]。
1.4 病毒滴度的计算通过Karber公式计算病毒滴度:logCCID50=L-d(S-0.5),其中:L=实验中使用的最低稀释度的log值:d=稀释过程中2个稀释度之间的差(稀释梯度)的log值;S=终判断时实验阳性部分总和(即出现CPE的细胞孔所占的比例之和)
1.5 江西省LQC滴度值SabinⅠ:在RD细胞上为7.16log10CCID50/0.1ml,在L20B细胞上为6.81 log10CCID50/0.1ml。SabinⅡ:在RD细胞上为6.91log10CCID50/0.1ml,在L20B细胞上为6.78 log10CCID50/0.1ml。SabinⅢ:在RD细胞上为6.83log10CCID50/0.1ml,在L20B细胞上为6.68 log10CCID50/0.1ml。评价细胞敏感性时,用LQC做质量控制株,细胞敏感性实验的滴度需与其质量控制株滴度相比较,其滴度波动在±0.5 log10CCID50/0.1ml以内,才可以确定实验结果的有效性。
1.6 统计分析采用SPSS 16.0软件进行统计分析。
2 结果
江西省脊灰实验室2005年建立细胞敏感性实验方法,2005年开始按照国家实验室要求,对实验室所用RD和L20B细胞开展敏感性常规监测,以检验细胞对脊灰病毒的敏感程度以及变化曲线。其结果见表1、表2,RD和L20B细胞各型别细胞敏感性实验曲线见图1、图2。各型别脊灰病毒均值和标准差见表3。
3 讨论
中国脊髓灰质炎(脊灰)监测网络建立以来,在新疆维吾尔自治区、云南省、青海省有一些脊灰野病毒爆发的报告[2~5],2000年10月,中国所在的世界卫生组织(WHO)西太平洋区已被证实为无脊灰区[6],表明我国已经成功阻断了本土脊灰野病毒的循环。但是,这仅是消灭脊灰的一个阶段性成果。中国维持无脊灰状态仍然面临着许多挑战,目前与我国接壤的一些国家仍有脊灰野病毒流行,我国依然存在野病毒输入的危险性;2011年我国新疆维吾尔自治区发生输入性WPV并引起局部传播[7,8]。另外,在我国,使用口服OPV是消灭脊灰的重要策略之一,疫苗衍生脊灰病毒(VDPV)的出现也提示我们对于维持无脊灰工作仍然不能掉以轻心[9]。
由于全球消灭脊灰日期的推近,消灭脊灰的形势越来越严峻,假阴性的病毒分离结果可能会导致非常严重的后果。所以在病毒监测过程中,保持网络实验室脊灰病毒学监测的高质量,使用高敏感的细胞系是分离脊髓灰质炎病毒的第一步,对于进一步鉴定病毒是野病毒还是VDPVs是必不可少的。RD细胞(即人横纹肌肉瘤细胞)和L20B细胞(即转人脊灰病毒受体的小鼠肺细胞系)来源于世界卫生组织(WHO)由中国疾病预防控制中心脊髓灰质炎实验室分发,省疾病预防控制中心脊髓灰质炎实验室建立细胞库[10]。根据WHO脊灰实验手册指导,RD细胞和L20B细胞应用于脊灰细胞敏感性的评价。现因此,脊灰实验室对用于病毒分离的RD和L20B细胞系的敏感性进行常规监测,这是实验室质量保证体系中的重要组成部分[11]。为此,江西省脊灰实验室制备了具有已知滴度的并且滴度稳定受到国家脊灰实验室认可的参考病毒,具体方法参考WHO《脊灰实验室手册》[12],定期进行细胞敏感性的评价。
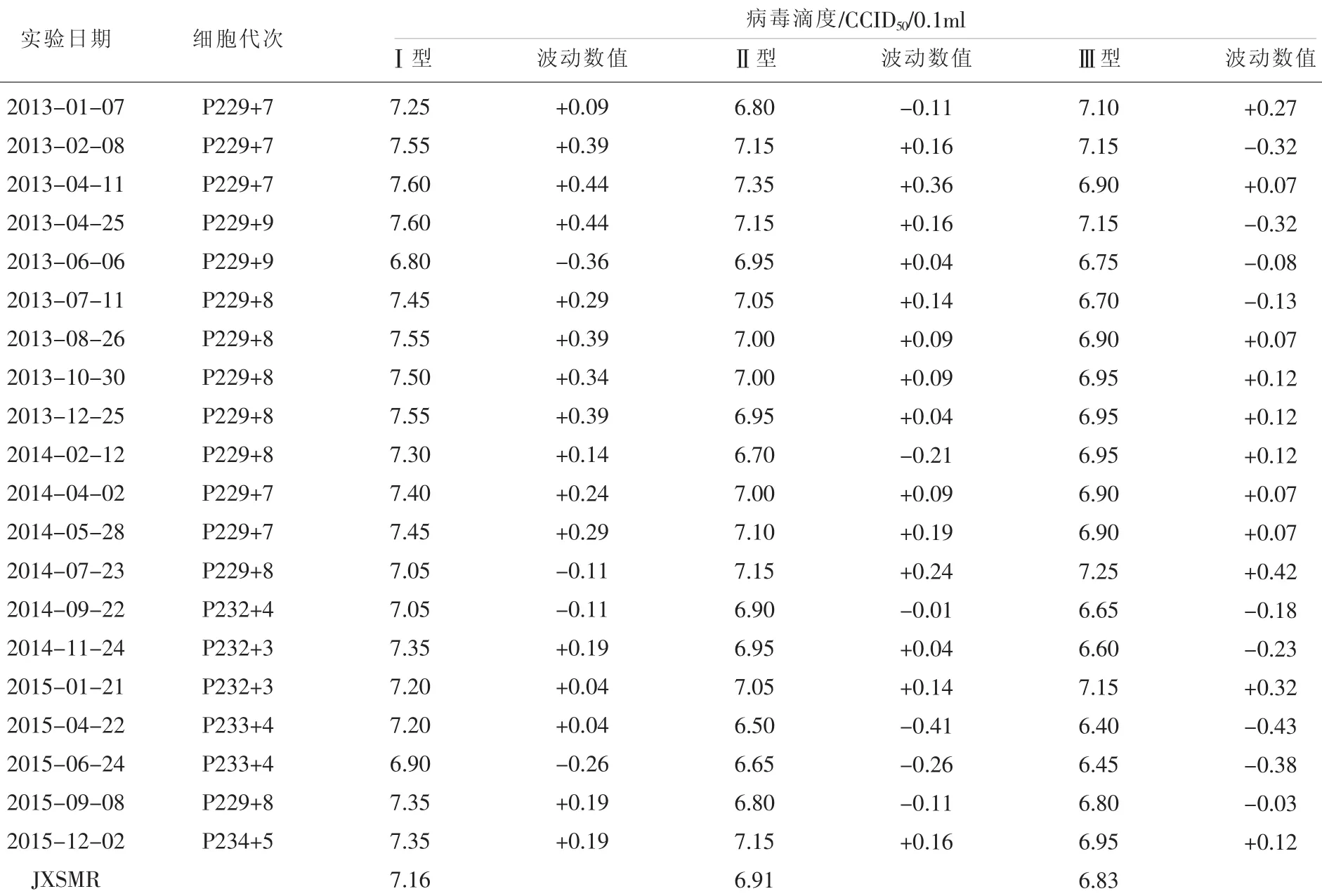
表1 江西省脊灰实验室RD细胞敏感性实验结果
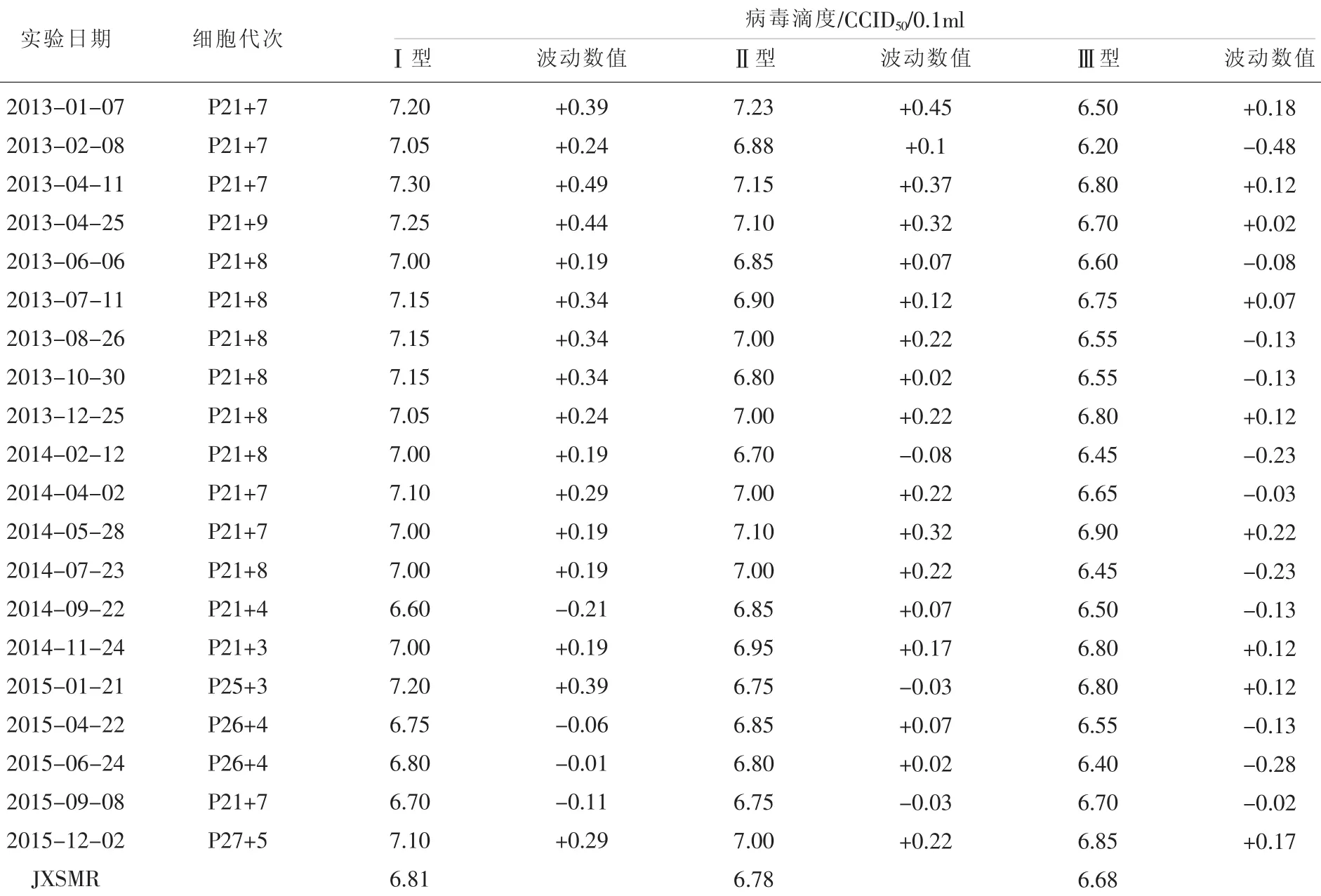
表2 江西省脊灰实验室L20B细胞敏感性实验结果

表3 江西省脊灰实验室2种细胞病毒滴度的均值(x±s)

图1 江西省脊灰实验室RD细胞敏感性实验曲线图

图2 江西省脊灰实验室L20B细胞敏感性实验曲线图
对细胞敏感性结果造成影响的因素有很多,如培养液的质量(如同牛血清、水、pH值)、生产条件(如孵育温度)、支原体污染等,所以需要及时监控和保持记录这些培养条件。当有因素发生变化时,就需要对用于脊灰病毒检测的细胞的敏感性进行评价;同时在实验室进行冻存细胞、复苏细胞和收到新的细胞系时,都要进行敏感性的评价[13]。
江西省按照国家脊灰实验室的要求,自2005年8月以来,制备实验室质量控制标准株后,至今一直使用该标准,对每次复苏的细胞进行细胞敏感性测试,严格遵守至少每3个月测试一次,在结果出来48h内及时向国家脊灰实验室上报实验结果,2013年至2015年共20次的敏感性实验结果期滴度波动幅度均在±0.5log10CCID50/0.1ml以内,均为有效的结果。在进行细胞敏感性测试的同时进行细胞计数,以确保得到准确的敏感性结果,监测结果做到了及时、有效、准确。
保持无脊灰状态的任务是一个既长久又艰巨的任务,我国周边国家野病毒的死灰复燃以及疫苗变异株的流行,对我们能否保持无脊灰状态产生巨大威胁[14,15]。所以我们要保证高质量的监测水平,本研究表明,江西省脊灰实验室RD和L20B细胞敏感性监测结果,与质量控制株LQC的滴度值相比起滴度均波动在±0.5log10CCID50/0.1ml以内,显示江西省脊灰实验室所使用的细胞对脊灰病毒保持正常的敏感性,细胞敏感性的常规监测运转正常,为江西省维持无脊灰状态提供了可靠的质量保证。
[1]WHO.WHO poliovirus laboratory manual[M].4th edition.Geneva:WHO,2004:73-80.
[2]侯晓辉,郑红,方勇,等.中国新疆地区发现脊髓灰质炎Ⅲ型野毒株[J].疾病监测,1995,10(8):229-233.
[3]李杰,郑红,徐闻,等.云南省两例输入性脊髓灰质炎Ⅰ型野病毒病例的分子病毒学检测[J].中国计划免疫,1997,3(2):58-61.
[4]张礼壁,李杰,原稔,等.1996年输入性病例Ⅲ型脊髓灰质炎野病毒的分子病毒学检测[J].中国计划免疫,1997,3(5):195-198.
[5]侯晓辉,张礼壁,方勇,等.青海省1999年脊髓灰质炎I型野毒株的分子病毒学分析[J].中国计划免疫,2000,6(2):67-71.
[6]刘丽萍,郭世成,于子颖.江西省1996~2000年分离脊髓灰质炎疫苗相关株AFP病例分析[J].江西医药,2002,37(4):253-255.
[7]汪海波,温宁,樊春祥,等.中国2010年急性弛缓性麻痹病例监测系统运转情况分析[J].中国疫苗和免疫,2012,18(2):141-142.
[8]余文周,甫尔哈提·吾守尔,汪海波,等.新疆维吾尔自治区2011年输入性脊髓灰质炎野病毒并引起局部传播的调查处置经验和教训[J].中国疫苗和免疫,2013,19(4):361-368.
[9]许文波,张勇,严冬梅,等.Ⅰ型疫苗衍生脊髓灰质炎病毒循环的发现和基因特点[J].中国计划免疫,2005,11(4):252-259.
[10]肖芳,刘丽萍,方晓艳,等.江西省2007年-2012年急性迟缓性麻痹病例监测分析[J].中国卫生检验杂志,2015,25(13):2192-2194.
[11]王东艳,赵蓉,安洪秋,等.脊髓灰灰质炎病毒细胞系敏感性实验方法的建立[J].中国疫苗和免疫,2005,11(6):431-434.
[12]WHO.WHO Poliovirus laboratory manual[M].4th edition.Geneva:WHO,2004:71-77.
[13]王晗,宋长江,马玉杰,等.黑龙江省2006-2013年脊髓灰质炎实验室细胞敏感性实验监测结果分析[J].中国公共卫生管理,2015,31(2):221-222.
[14]刘丽萍,王飞霞,周顺德.江西省2000~2006年急性迟缓性麻痹病例监测分析[J].中国卫生检验杂志,2007,17(9):1594-1595.
[15]刘丽萍,熊英,周顺德.江西省脊髓灰质炎病毒的型内分析[J].中国卫生检验杂志,2005,15(7):883-884.
Cell sensitivity test in Polio laboratory in Jiangxi from 2013 to 2015
LIU Xiaoqing,LIU Shiwen,XIAO Fang,SHI Yong,LI Jianxiong,XIONG Ying.
Jiangxi Provincial Center for Disease Control and Prevention,Nanchang 330029,China.
Objective To evaluate the sensitivity of cell lines to poliovirus used in Jiangxi Provincial Polio Laboratory(JXPPL) and provide the laboratory data for maintaining polio-free status in Jiangxi Province from 2013 to 2015.Methods The LQC of SabinⅠ,Ⅱ,Ⅲcome from Polio laboratory in 2015 in Jiangxi province,as well as the qualified and no mycoplasma pollution RD and L20B cell lines which are provided by the National Polio Laboratory are used.Then the 96-holed Microtest Plate Culture method was applied to detect the sensitivity of Poliovirus used in the lab of Jiangxi Center for Disease Center and Prevention within 2013-2015.Results The mean value and standard deviation of human rhabdomyosarcoma cell line RD was 7.32±0.23 for typeⅠ,6.97±0.20 for typeⅡ,and 6.88±00.23 for typeⅢ;The mean value and standard deviation of the poliovirus-transferred lung cell from mice was 7.03±0.19 for typeⅠ,6.93±0.14 for typeⅡ,and 6.62±0.18 for typeⅢ,Compared with the Laboratory quality control standard,the fluctuation of the titre was within±0.5 log10CCID50/0.1ml in cellular sensitivity test.Conclusion The sensitivity of the cell line to poliovirus used in JXPPL through 2013~2015 was fine.
∶Poliovirus;cell-line sensitivity test;LQC
R512.4
A
1674-1129(2017)03-0308-04
2016-08-22;
2017-03-23)
10.3969/j.issn.1674-1129.2017.03.005
江西省卫生计生委资助课题,编号:20166018
刘晓庆,1986年生,女,硕士,研究方向:检验技师,脊灰病病毒的研究,电话:18079125862,E-mail:liuxiaoqing035@163.com
