2型糖尿病患者右心结构变化的研究
2017-06-27张舒赵洁刘格婧刘永铭
张舒,赵洁,刘格婧,刘永铭
2型糖尿病患者右心结构变化的研究
张舒*,赵洁,刘格婧,刘永铭
目的:探讨2型糖尿病(T2DM)患者右心结构的变化。
方法:T2DM患者194例,其中合并高血压者(T2DM+HP组)97例,血压正常者(T2DM组)97例;同期健康体检者为对照组97例。采用超声心动图测定右心结构并比较其变化。
结果:T2DM+HP组较对照组右心房短轴内径(RA-D1) 增宽,RA-D1及右心房长轴内径(RA-D2) 增加,右心房面积(RAA) 增大,肺动脉内径(PA)增宽,差异均有统计学意义(P均<0.05),但右心室游离壁厚度无明显变化;T2DM组较对照组PA升高(P<0.05),而RA-D2虽升高,但差异无统计学意义(P=0.061)。直线相关分析:大多数右心结构指标(RV-D1、RVOT1、PA、RA-D1、RA-D2、RAA)与体质指数(r=0.123~0.380)、腰臀比(r=0.136~0.325)正相关,P均<0.05;RA-D2、RAA与尿微量白蛋白排泄率(UAER)的自然对数(lnUAER)呈正相关(r=0.172, 0.130),P<0.05;PA与舒张压、舒张早期二尖瓣最大充盈速度与舒张早期二尖瓣环最大速度比值(E/E’)正相关(r=0.154,0.172)而与E/A负相关(r=-0.118),P<0.05。多元回归显示性别、体质指数与RV-D1、RVOT1、RA-D1、RA-D2、RAA独立相关,体质指数、舒张压与PA独立相关,lnUAER与RAA独立相关。
结论:T2DM+HP患者右心室基底部增宽,右心房内径和面积增大,肺动脉增宽,T2DM患者右心结构改变较轻。血压、体质指数以及UAER升高与糖尿病患者右心结构改变关系密切。
糖尿病, 2型;心脏;超声心动描记术
(Chinese Circulation Journal, 2017,32:594.)
Framingham研究[1]发现,糖尿病患者心力衰竭患病率是非糖尿病患者的2~5倍,近年来糖尿病与心脏结构功能的关系引起了广泛重视,研究发现糖尿病可引起左心结构功能损害[2],但糖尿病是否影响右心结构功能国内外报道均较少,而且结果差异较大[3]。糖尿病往往合并高血压,高血压对左心结构功能的影响众所周知[4];但高血压对右心结构的影响仍然存在争论[3,5]。探讨糖尿病右心结构的变化及合并高血压对其影响,对于全面了解糖尿病心肌病的发生发展规律以及阐明糖尿病合并心力衰竭的病理过程具有重要的意义。为此,我们对2型糖尿病(T2DM)患者进行研究,观察右心结构变化并分析其影响因素。
1 资料与方法
研究对象:连续选取2009-04至2014-09兰州大学第一医院老年病科住院血压正常且无高血压病史的2型糖尿病者(T2DM组)97例,年龄(59.9±10.8)岁(40~85岁),糖尿病病程 6.0(2.0,10.0)年;2型糖尿病合并高血压者(T2DM+HP组)97例,年龄(60.0±11.0)岁(42~84岁),糖尿病病程3.0(0.5,8.0)年,高血压病程4.0(1.0,10.0)年;同期健康体检者(对照组)97例,年龄(59.5±11.3)岁(40~84岁)。三组患者性别、年龄组成差异无统计学意义(P>0.05)。糖尿病诊断符合1999年世界卫生组织(WHO)标准,高血压诊断符合1999年WHO/国际高血压联盟(ISH)标准。经询问病史、体格检查、实验室及影像检查排除下列疾病:心脏瓣膜病、先天性心脏病、心肌病、心包疾病和严重心律失常,任何原因所致心功能衰竭;肺源性心脏病、慢性阻塞性肺疾病、肺间质纤维化、肺栓塞、睡眠呼吸暂停综合征;慢性肾脏病、慢性肝病、贫血、甲状腺功能减退或亢进者以及晚期肿瘤。
实验室检查:使用美国LX20 型全自动生化仪检测空腹血糖(FPG)、血总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C);糖化血红蛋白(HbA1c)测定使用免疫乳胶凝集抑制法;尿微量白蛋白测定使用免疫比浊法,根据8 h尿量计算尿微量白蛋白排泄率(UAER);N末端B型利钠肽原(NT-proBNP)测定使用电化学发光法,试剂购自瑞士Roche公司。
右心结构的测量:采用美国GE公司LOGIQ7超声诊断仪,参照2006年欧洲心脏病学会心脏结构定量检查建议进行[6]:采用肋弓下切面测定收缩期和舒张期右心室游离壁厚度(RV-FWs、RV-FWd);于心尖部四腔切面测定舒张期右心室基底部内径(RV-D1)、中部内径(RV-D2)以及基底部至心尖部长度(RV-D3);于心尖部四腔切面测定右心房短轴内径(RA-D1)和长轴内径(RA-D2)以及右心房面积(RA-A);于胸骨旁短轴切面心底部水平测定右心室流出道内径[RVOT1(主动脉瓣上);RVOT2(肺动脉瓣环水平)];于肺动脉瓣下测定肺动脉内径(PA)。
左心结构和功能测定:在胸骨旁长轴二尖瓣尖水平切面,用2D引导下的M型超声,测量左心室舒张末期内径(LVIDd)、舒张末期室间隔厚度(IVSTd)、舒张末期后壁厚度(PWTd)[5]。心功能测定参考2009年美国和欧洲左心室舒张功能心脏超声测量指南[7]:(1)二尖瓣血流频谱:于心尖四腔切面二尖瓣瓣尖水平,使用脉冲多普勒,测量舒张早期最大充盈速度(E峰)、舒张晚期最大充盈速度(A峰),并计算E峰与A峰的比值(E/A)。(2)组织多普勒及其衍生参数:选心尖部四腔切面,分别测量二尖瓣环侧壁和室间隔部舒张早期最大速度(E'L、E'S),并计算E/E'L、E/ E'S及E/ E'L和E/ E'S的平均值(E/E')。(3)左心室射血分数(LVEF):采用双平面改良Simpson法进行测量。
统计学分析:用SPSS19.0软件进行统计分析。计量资料用正态分布资料)或M(P25,P75)(非正态分布资料)表示。NT-proBNP及UAER为非正态分布,经转换为其自然对数lnNT-proBNP及lnUAER后接近正态分布。两组间比较采用t检验(正态分布资料)或Wilcoxon秩和检验(非正态分布资料),两两比较采用LSD-t检验(方差齐时)或Dunnett-t检验(方差不齐时)。指标间分析采用直线相关分析(正态分布资料)、Spearman秩相关(非正态分布资料)及多元线性回归。P<0.05为差异有统计学意义。
2 结果
患者一般临床资料(表1):T2DM组及T2DM +HP组体质指数、收缩压、舒张压、心率、FPG、HbA1c及lnUAER均高于对照组(P<0.05),HDL-C低于对照组;T2DM+HP组体质指数、收缩压、舒张压、lnUAER均高于T2DM组(P均<0.05),糖尿病病程低于T2DM组(P<0.05),其他两组间差异无统计学意义。
表1 三组患者一般临床资料比较(n=)
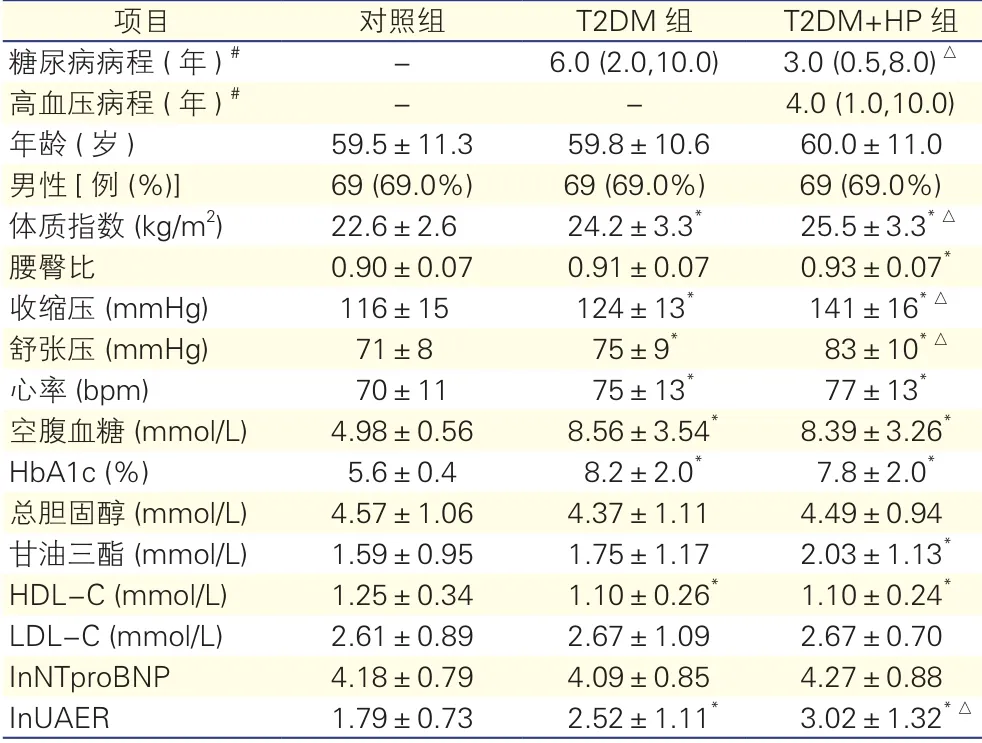
表1 三组患者一般临床资料比较(n=)
注:T2DM:2型糖尿病;T2DM+HP:2型糖尿病合并高血压;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;HbA1c:糖化血红蛋白;InNT-proBNP:N末端B型利钠肽原的自然对数值;InUAER:尿微量白蛋白排泄率的自然对数值;-:无。与对照组比较*P<0.05;与T2DM组比较△P<0.05。1 mmHg=0.133 kPa。#:中位数(P25,P75)
项目对照组T2DM组T2DM+HP组糖尿病病程 (年)#-6.0 (2.0,10.0)3.0 (0.5,8.0)△高血压病程 (年)#--4.0 (1.0,10.0)年龄 (岁)59.5±11.359.8±10.660.0±11.0男性[ 例 (%)]69 (69.0%)69 (69.0%)69 (69.0%)体质指数 (kg/m2)22.6±2.624.2±3.3*25.5±3.3*△腰臀比0.90±0.070.91±0.070.93±0.07*收缩压 (mmHg)116±15124±13*141±16*△舒张压 (mmHg)71±875±9*83±10*△心率 (bpm)70±1175±13*77±13*空腹血糖 (mmol/L)4.98±0.568.56±3.54*8.39±3.26*HbA1c (%)5.6±0.48.2±2.0*7.8±2.0*总胆固醇 (mmol/L)4.57±1.064.37±1.114.49±0.94甘油三酯 (mmol/L)1.59±0.951.75±1.172.03±1.13*HDL-C (mmol/L)1.25±0.341.10±0.26*1.10±0.24*LDL-C (mmol/L)2.61±0.892.67±1.092.67±0.70 InNTproBNP4.18±0.794.09±0.854.27±0.88 InUAER1.79±0.732.52±1.11*3.02±1.32*△
T2DM患者右心结构变化(表2):T2DM+HP组RV-D1、RVOT1、PA、RA-D1、RA-D2、RAA高于对照组(P<0.05)。T2DM组PA高于对照组(P<0.05),而RA-D2升高,但差异无统计学意义(P=0.061)。
表2 超声心动图测量三组右心结构比较(n=97)
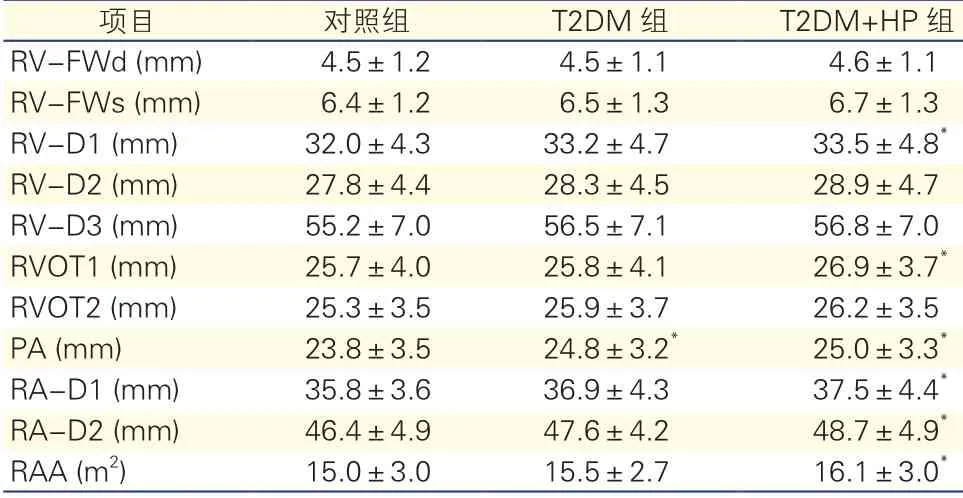
表2 超声心动图测量三组右心结构比较(n=97)
注:T2DM:2型糖尿病;T2DM+HP:2型糖尿病合并高血压;RVFWd:右心室游离壁厚度(舒张期); RV-FWs:右心室游离壁厚度(收缩期);RV-D1:右心室基底部内径; RV-D2:右心室中部内径; RV-D3:右心室基底部至心尖部长度;RVOT1:右心室流出道内径(主动脉瓣上);RVOT2:右心室流出道内径(肺动脉瓣环水平);PA:肺动脉内径(肺动脉瓣下);RA-D1:右心房短轴内径;RA-D2:右心房长轴内径;RAA:右心房面积。与对照组比较*P<0.05
项目对照组T2DM组T2DM+HP组RV-FWd (mm)4.5±1.24.5±1.14.6±1.1 RV-FWs (mm)6.4±1.26.5±1.36.7±1.3 RV-D1 (mm)32.0±4.333.2±4.733.5±4.8*RV-D2 (mm)27.8±4.428.3±4.528.9±4.7 RV-D3 (mm)55.2±7.056.5±7.156.8±7.0 RVOT1 (mm)25.7±4.025.8±4.126.9±3.7*RVOT2 (mm)25.3±3.525.9±3.726.2±3.5 PA (mm)23.8±3.524.8±3.2*25.0±3.3*RA-D1 (mm)35.8±3.636.9±4.337.5±4.4*RA-D2 (mm)46.4±4.947.6±4.248.7±4.9*RAA (m2)15.0±3.015.5±2.716.1±3.0*
右心结构的影响因素分析:将所有研究对象作为整体进行直线相关分析。结果显示: RV-D1、RVOT1、RA-D1、RA-D2、RAA与性别(男)呈正相关;RV-D1、RVOT1、PA、RA-D1、RA-D2、RAA与体质指数、腰臀比、LVIDd等正相关;RAD2、RAA与InUAER等呈正相关;PA与舒张压、E/E’等呈正相关,与E/A等负相关。详见表3。
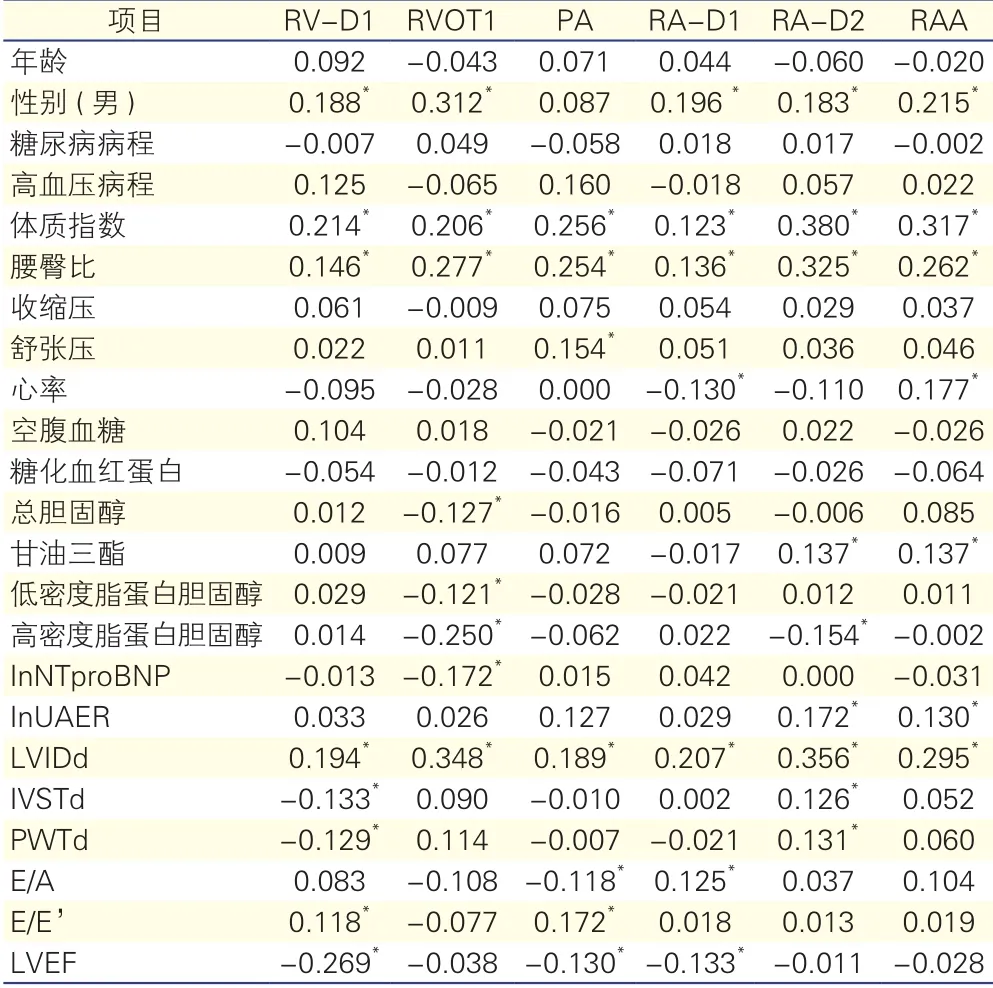
表3 右心结构与临床指标的直线相关分析(Pearson相关系数r或Spearman秩相关相关系数rs)
多元线性回归结果显示性别、体质指数与RVD1、RVOT1、RA-D1、RA-D2、RAA独立相关,PA与体质指数、舒张压独立相关, RAA与lnUAER独立相关,详见表4。
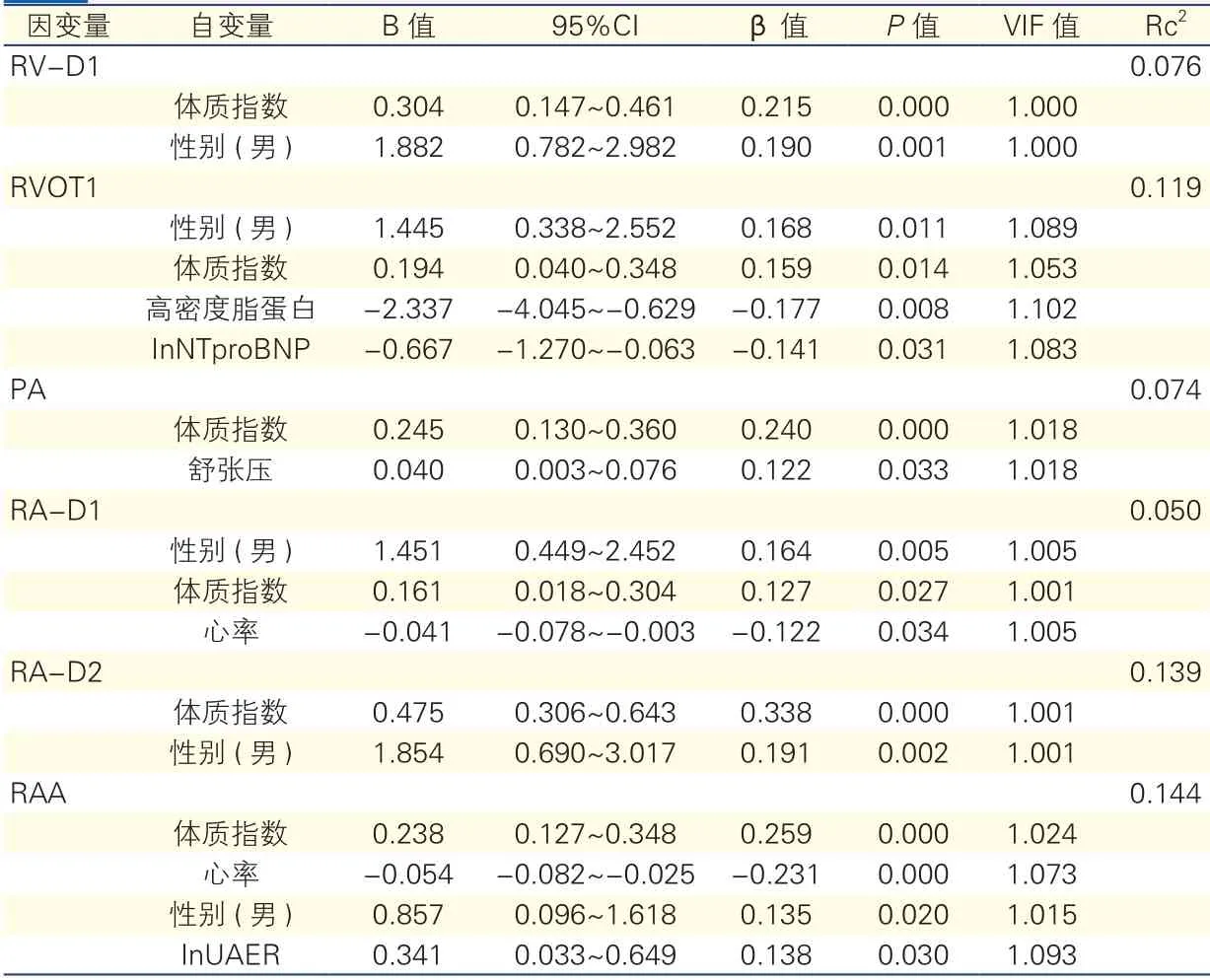
表4 右心结构与临床指标的多元线性回归
3 讨论
糖尿病可引起人体多种器官结构和功能的损害,其中心血管系统损害较为突出,早在40多年前就有学者提出了糖尿病心肌病的概念。动物实验发现,糖尿病不仅导致左心结构改变而且可导致右心室内径增加[8],但一些临床研究显示2型糖尿病患者右心室结构与对照组之间无统计学差异[9,10],即使以核磁共振心脏显影等“金标准”为方法的研究也有类似报导[5];甚至也有相反的报导,Widya等[11]发现,T2DM组右心室容积均低于对照组,且在控制体质指数和脉压后上述差异依旧存在。
临床常见影响右心结构的因素或疾病众多,选择不同的研究对象可能会得出不同的结论。本研究采用病例对照研究的办法,以减少年龄、性别等因素对结果的影响,并且通过仔细的临床检查排除了影响心脏结构尤其是右心结构的常见疾病。本研究发现,T2DM+HP患者RVD、RAD及RAA增大、PA增宽;而T2DM患者PA增宽,RAD有增高倾向。
高血压可导致右心室室壁增厚、内径增大,已有较多研究[3,4],但仍然存在争论。本研究发现
T2DM+HP组右心室、右心房的大多数指标(RV-D1、RVOT1、PA、RA-D1、RA-D2、RAA)均高于对照组,而不合并高血压的T2DM患者只有PA较对照组升高,RAD有增高趋势。因此,高血压是导致糖尿病患者右心改变的重要原因。近年来研究发现超重/肥胖可致右心室肥厚、右心室容积增加[12,13],本研究发现体质指数与右心室、右心房以及肺动脉结构的多个参数呈正相关,提示超重/肥胖是T2DM右心改变的重要因素,而T2DM往往合并超重/肥胖。多元线性回归分析提示性别是多项右心结构指标(RV-D1、RVOT1、RA-D1、RAD2、RAA)的独立相关因素,与Chahal等[5]的研究及Tadic等[14]的研究中右心结构在不同性别的表现一致,说明右心结构有性别间的差异。糖尿病心肌病发病机制复杂,血管内皮功能障碍是其重要环节之一。UAER反映广泛的微血管损害及系统性内皮功能障碍[15,16],与糖尿病心脏结构、功能变化关系密切[17,18],也与心血管疾病预后相关[19-21],而高血压会加重糖尿病患者UAER。本研究发现糖尿病RAA与InUAER正相关,独立于血压、性别、体重指数等因素,提示血管内皮功能障碍及糖尿病微血管病变是右心结构改变的重要原因。T2DM对左心的影响报导较多,研究发现T2DM可导致左心室向心性重构或肥厚、左心房增大、心脏舒张功能下降,与UAER以及糖尿病病程正相关[2,22],本研究也有相似发现[23]。因此,从UAER的角度看,糖尿病患者左右心结构改变有着相似的病理基础。
理论上讲,左右心之间可以通过血流动力学改变而互相影响。T2DM患者左心室舒张功能下降已经得到较为广泛的认可,舒张功能下降可导致血流动力学改变。E/E’是反应左心室舒张功能的重要指标,2000年以后应用于临床,E/E’升高表示心脏舒张功能减退。本研究简单相关分析发现,E/E’与PA以及RV-D1正相关,提示T2DM患者左心室功能减退可能影响右心结构,但多元回归中上述相关性消失,因此,T2DM患者右心结构改变与左心功能改变的关系还需要进一步研究。
[1] Kannel WB, McGee DL. Diabetes and cardiovascular disease. The Framingham study. JAMA, 1979, 241: 2035-2038.
[2] Devereux RB, Roman MJ, Paranicas M, et al. Impact of diabetes on cardiac structure and function: the strong heart study. Circulation, 2000, 101: 2271-2276.
[3] Tadic M, Ivanovic B, Cuspidi C. Metabolic syndrome and right ventricle: an updated review. Eur J Intern Med, 2013, 24: 608-616.
[4] 周方明, 祝之明, 于军, 等. 2型糖尿病合并原发性高血压患者的动态血压及脉压和左心室结构功能的关系, 中国循环杂志, 2002, 17: 31-34.
[5] Chahal H, Johnson C, Tandri H, et al. Relation of cardiovascular risk factors to right ventricular structure and function as determined by magnetic resonance imaging (results from the multi-ethnic study of atherosclerosis). Am J Cardiol, 2010, 106: 110-116.
[6] Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification. Eur J Echocardiogr, 2006, 7: 79-108.
[7] Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur J Echocardiogr, 2009, 10: 165-193.
[8] van den Brom CE, Bosmans JW, Vlasblom R, et al. Diabetic cardiomyopathy in Zucker diabetic fatty rats: the forgotten right ventricle. Cardiovasc Diabetol, 2010, 9: 25.
[9] Kosmala W, Colonna P, Przewlocka-Kosmala M, et al. Right ventricular dysfunction in asymptomatic diabetic patients. Diabetes Care, 2004, 27: 2736-2738.
[10] Kosmala W, Przewlocka-Kosmala M, Mazurek W. Subclinical right ventricular dysfunction in diabetes mellitus--an ultrasonic strain/ strain rate study. Diabet Med, 2007, 24: 656-663.
[11] Widya RL, van der Meer RW, Smit JW, et al. Right ventricular involvement in diabetic cardiomyopathy. Diabetes Care, 2013, 36: 457-462.
[12] Abel ED, Litwin SE, Sweeney G. Cardiac remodeling in obesity. Physiol Rev, 2008, 88: 389-419.
[13] Wong CY, O'Moore-Sullivan T, Leano R, et al. Association of subclinical right ventricular dysfunction with obesity. J Am Coll Cardiol, 2006, 47: 611-616.
[14] Tadic. MV, Ivanovic BA, Petrovic M. Is gender responsible for everything? The relationship between sex and right ventricular remodeling in metabolic syndrome. Echocardiography, 2013, 30: 778-785.
[15] Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, et al. Albuminuria reflects widespread vascular damage: the Steno hypothesis. Diabetologia, 1989, 32: 219-226.
[16] Taddei S, Virdis A, Mattei P, et al. Lack of correlation between microalbuminuria and endothelial function in essential hypertension patients. J Hyertens, 1995, 13: 1003-1008.
[17] Enomoto M, Ishizu T, Seo Y, et al. Myocardial dysfunction identified by three-dimensional speckle tracking echocardiography in type 2 diabetes patients relates to complications of microangiopathy. J Cardiol, 2016, 68: 282-287
[18] Zhen Z, Chen Y, Shih K, et al. Altered myocardial response in patients with diabetic retinopathy: an exercise echocardiography study. Cardiovasc Diabetol, 2015, 14: 123-130.
[19] Astor BC, Hallan SI, Miller ER, et al. Glomerular filtration rate, albuminuria, and risk of cardiovascular and all-cause mortality in the US population. Am J Epidemiol , 2008, 167: 1226-1234.
[20] Hallan S, Astor B, Romundstad S, et al. Association of kideney function and albuminuria with cardiovascular mortality in older vs younger individuals: The HUNT ⅡStudy. Arch Intern Med, 2007, 167: 2490-2496.
[21] Gerstein HC, Mann JF, Yi Q. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA, 2001, 2001: 421-426.
[22] Adler AI, Stevens RJ, Manley SE, et al. Development and progression of nephropathy in type 2 diabetes: the United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int, 2003, 63: 225-232.
[23] 侯亚利, 刘永铭, 马苏美, 等. 2型糖尿病患者心脏功能变化的研究. 中国糖尿病杂志, 2011, 25: 834-837.
The Changes of Right Heart Structure in Patients With Type 2 Diabetes Mellitus
ZHANG Shu**, ZHAO Jie, LIU Ge-jing, LIU Yong-ming.
Department of Geriatrics, Lanzhou University First Hospital, Lanzhou (730000), Gansu, China
LIU Yong-ming, Email: cardtonm@263.com
Objective: To explore the changes of right heart structure in patients with type 2 diabetes mellitus (T2DM).
Methods: A total of 194 T2DM patients were recruited in our research including those complicated with hypertension (HP). The patients were divided into 2 groups: T2DM+HP group and T2DM group, n=97 in each group. In addition, there was a Control group composed by 97 healthy subjects from regular physical examination at the same period of time. Right heart structure was assessed and compared by echocardiography in all participants.
Results: The pulmonary artery diameter (PAD), right atrial short axis diameter (RA-D1), right atrial long axis diameter (RA-D2) and right atrial area (RAA) were different among 3 groups, all P<0.05. Right ventricular (RV) basal diameter (RV-D1) and RV out flow tract diameter (RVOT1) were similar among different groups, P=0.066 and P=0.059. Compare with Control group, T2DM+HP group had increased RA-D1, RA-D2, RAA and PAD, all P<0.05, while right ventricular free wall thickness was similar between 2 groups; T2DM group showed increased PAD, P<0.05, while RA-D2 was similar, P=0.061. Linear correlation analysis indicated that RV-D1, RVOT1, PA, RA-D1, RA-D2 and RAA were positively related to BMI (r=0.123-0.380) and waist-to-hip ratio (r=0.136-0.325), all P<0.05; RA-D2 and RAA were positively related to natural logarithm of urinary albumin excretion rate (lnUAER) (r=0.172 and r=0.130), P<0.05; PAD was positively related to diastolic bloodpressure and E/E’ (r=0.154 and r=0.172), negatively related E/A (r=-0.118), P<0.05. Multi regression analysis presented that gender and BMI were independently related to RV-D1, RVOT1, RA-D1, RA-D2 and RAA; BMI and diastolic blood pressure were independently related to PAD; lnUAER was independently related to RAA.
Conclusion: T2DM+HP patients had broadened PA and RV basal part, increased RA-D and RAA; the changes of right heart structure were relatively mild in T2DM patients. Elevated blood pressure, BMI and UAER were closely related to the changes of right heart structure in T2DM patients.
Diabetes mellitus, type 2 ; Heart; Echocardiography
2016-06-25)
(编辑:常文静)
730000 甘肃省兰州市,兰州大学第一医院 老年病科
张舒 硕士研究生 主要从事老年医学研究 Email:zhangshu9081@163.com 通讯作者:刘永铭 Email: cardtonm@263.com*现工作于西安市第五医院内科**Now working in Xi' an City Fifth Hospital
R54
A
1000-3614(2017)06-0594-05
10.3969/j.issn.1000-3614.2017.06.015
