主动脉瓣狭窄患者经导管主动脉瓣置换术后短期超声心动图和血N末端B型利钠肽原浓度变化特点分析
2017-06-27赵振燕宋光远张文佳张倩牛冠男周政张昊裴汉军王建德肖明虎杨跃进吴永健
赵振燕,宋光远,张文佳,张倩,牛冠男,周政,张昊,裴汉军,王建德,肖明虎,杨跃进,吴永健
临床研究
主动脉瓣狭窄患者经导管主动脉瓣置换术后短期超声心动图和血N末端B型利钠肽原浓度变化特点分析
赵振燕,宋光远,张文佳,张倩,牛冠男,周政,张昊,裴汉军,王建德,肖明虎,杨跃进,吴永健
目的:探讨主动脉瓣狭窄患者经导管主动脉瓣置换(TAVR)术后6个月内心功能、主动脉瓣跨瓣压差及血流速度特点,以明确TAVR术后心功能、主动瓣跨瓣压差的变化规律,为临床治疗提供指导信息。
方法:2013-12至2015-12连续入选常规外科换瓣手术禁忌或美国胸外科医师学会(STS)评分高危、在我院成功行TAVR治疗的49例重度主动脉瓣狭窄患者。在TAVR治疗前后、术后1个月及6个月时,所有患者接受超声心动图检查和血N末端B型利钠肽原(NT-proBNP)检测,记录左心室射血分数、主动脉瓣平均跨瓣压差、最大跨瓣压差、最大跨瓣血流速度和血NT-proBNP浓度。TAVR术前左心室射血分数<50%的患者分入心功能不全组,左心室射血分数≥50%的患者分入心功能正常组,观察两组患者TAVR术后心功能和NT-proBNP浓度变化。
结果:49例患者中,心功能不全组15例(30.6%),心功能正常组34例(69.4%)。TAVR治疗后7 d内,所有患者的左心室射血分数[(56.0±14.6)% vs (52.5±13.8)%]、主动脉瓣平均跨瓣压差[(11±5) mmHg(1 mmHg=0.133 kPa) vs(58±18) mmHg]、最大跨瓣压差[(21.7±9.5)mmHg vs (93.0±28.6) mmHg]、最大跨瓣血流速度[(2.3±0.5)m/s vs (4.8±0.7)m/s]、血NT-proBNP浓度[1 831(1 098~3 363)pg/ml vs 3 842(1 763~8 664) pg/ml]、主动脉瓣瓣口面积[(1.57±0.43)cm2vs (0.58±0.23)cm2]较术前均有明显改善,差异均有统计学意义(P均<0.05)。术后6个月内,患者的左心室射血分数仍持续上升,尤以心功能不全组为著;主动脉瓣平均跨瓣压差、最大跨瓣血流速度、NT-proBNP浓度较术后持续下降,纽约心脏协会心功能分级持续改善,差异均有统计学意义(P均<0.05)。
结论:TAVR是外科手术禁忌或STS评分高危的重度主动脉瓣狭窄患者的一种有效治疗方式,在6个月内可明显且持续改善患者的心功能,左心功能不全患者改善尤为明显。关键词 主动脉瓣狭窄;心脏瓣膜假体植入;超声心动描记术
(Chinese Circulation Journal, 2017,32:575.)
主动脉瓣狭窄(AS)是一种隐匿性心血管疾病,一旦症状进展,预后极其不佳。尽管外科主动脉瓣置换术是重度AS患者的标准治疗方案,但很多患者因为心功能差、合并其他系统疾病或体质虚弱,并不适宜接受常规外科主动脉瓣置换术治疗[1]。对于不能行外科手术治疗的严重AS患者,经导管主动脉瓣置换(TAVR)术较药物治疗能改善生存率[2]。在手术高危患者中,尽管接受TAVR治疗的患者脑血管事件发生率增加,但1年生存率与接受外科主动脉瓣置换术治疗的患者相似[3,4]。目前国际上已将TAVR作为心外科瓣膜置换术高危患者或有禁忌证患者的首选治疗方式,但针对这类患者TAVR术后心功能的变化特点和规律的报道较少。为全面认识TAVR术后患者心功能、主动脉瓣跨瓣压差、跨瓣血流速度、血N末端B型利钠肽原(NT-proBNP)浓度等指标的变化特点,本研究在区分心功能不全和心功能正常患者的情况下,观察两类患者上述指标的动态变化规律和特点。
1 资料与方法
研究对象:2013-12至2015-12,在我院连续入选常规外科换瓣手术禁忌或美国胸外科医师学会(STS)评分高危、成功行TAVR治疗的重度AS患者(经皮主动脉瓣生物瓣膜为杭州启明医疗器械有限公司提供的Venus-A瓣膜),共50例,因其中1例患者在术中转为外科开胸手术,最终纳入有效病例49例。
重度AS诊断标准和心功能分组标准:符合2014美国心脏协会(AHA)/美国心脏病学会(ACC)关于瓣膜病诊疗指南规定诊断标准[5],即主动脉瓣最大血流速度>4.0 m/s,平均跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa),一般情况下主动脉瓣瓣口面积≤1.0 cm2。根据2016年欧洲心脏病学会(ESC)急、慢性心力衰竭诊断和治疗指南[6],按TAVR术前左心室射血分数(LVEF)将49例患者分为两组:LVEF<50%为心功能不全组(n=15),LVEF≥50%为心功能正常组(n=34)。
术后观察和随访:对行TAVR治疗的患者常规于术前、术后7 d内、术后1个月及6个月时行超声心动图检查,测定主动脉瓣平均跨瓣压差、最大跨瓣血流速度、左心室射血分数等,同时检测生化全套、血常规、NT-proBNP浓度。超声心动图检查指定专人负责,静息状态使用Philips iE 33型彩色多普勒超声诊断仪,配备经胸探头S5-1,探头频率2.5~3.5 MHz。于心尖五腔心切面以连续多普勒测量主动脉瓣最大跨瓣血流速度、平均跨瓣压差;二维Simpson法测量LVEF。
统计学处理:所有数据用统计学软件包SPSS 20.0处理。计量资料以均数±标准差或中位数(四分位间距)表示,计数资料采用百分比或者率(%)表示,计量资料的比较采用两独立样本的t检验或者秩和检验,治疗前后比较采用配对t检验,计数资料采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
2 结果
2.1 患者的基线临床资料(表1)
49例患者中,心功能不全组15例(30.6%),心功能正常组34例(69.4%)。女性患者占42.9%(21/49)。患者年龄范围54~92岁,平均年龄(75.8±6.6)岁。纽约心脏协会(NHYA)心功能Ⅱ级者占10.2%(5/49),Ⅲ级者占65.3%(32/49),Ⅳ级者占24.5%(12/49)。
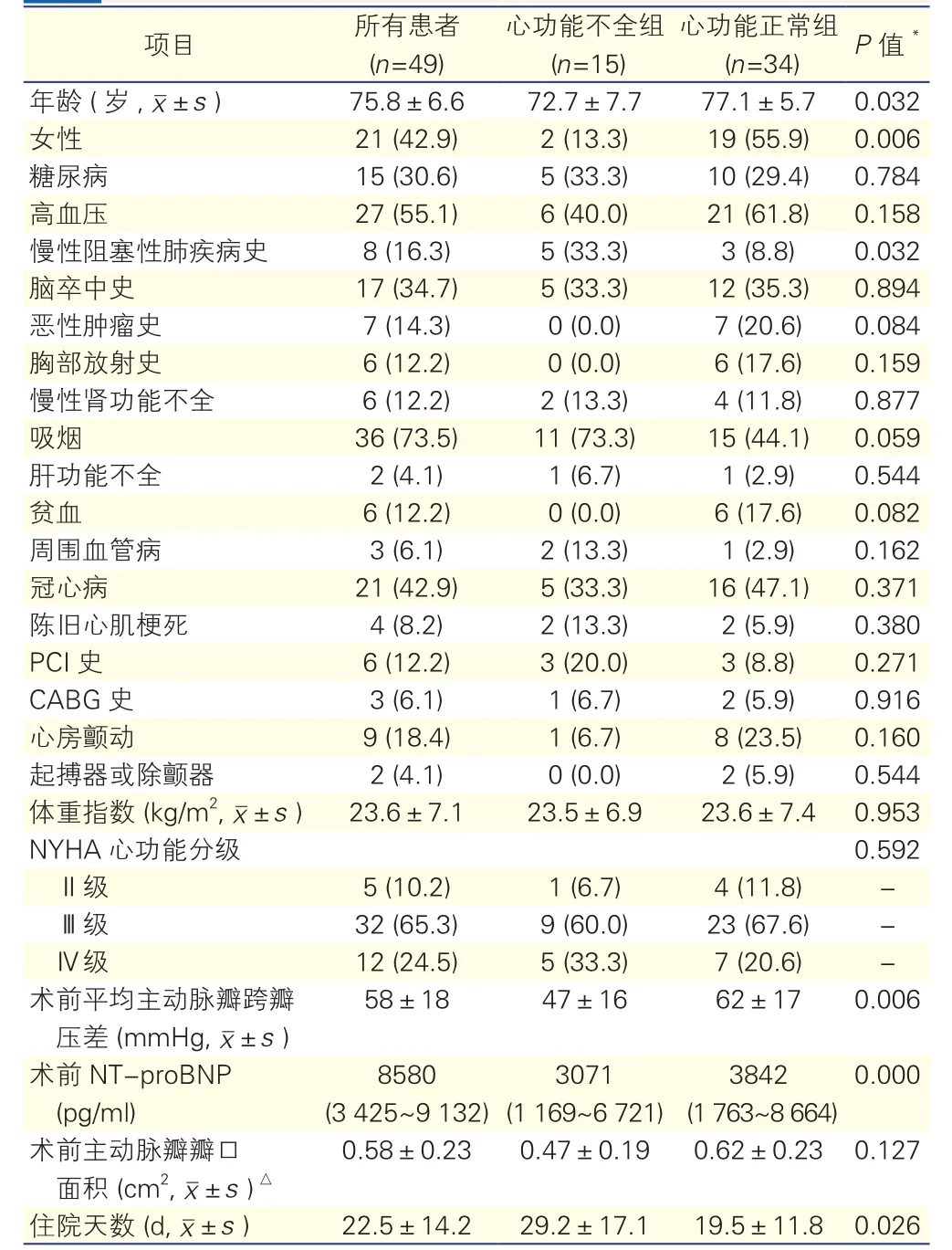
表1 患者的基线临床资料[例(%)]
心功能不全组患者较心功能正常组年龄较小[(72.7±7.7)岁 vs (77.1±5.7)岁,P =0.032]、男性比例较高(86.7% vs 44.1%,P=0.006),合并慢性阻塞性肺病病史者较多(33.3% vs 8.8%,P=0.032)、住院时间较长[(29.2±17.1)d vs (19.5±11.8)d,P=0.026]、NT-proBNP浓度更高[8 580(3 425~ 9 132)pg/ml vs 3 071(1 169~6 721)pg/ml,P=0.000]。与心功能不全组患者相比,心功能正常组患者主动脉瓣跨瓣压差更大[(47±16)mmHg vs (62±17)mmHg,P=0.006],合并肿瘤者更多,但差异无统计学意义(0.0% vs 20.6%,P=0.084)。心功能不全组和心功能正常组患者术前的平均主动脉瓣瓣口面积无明显差异(P>0.05)。
2.2 两组患者TAVR治疗前后心功能的变化情况(图1)
心功能不全组[(40.4±15.1)% vs (34.6±7.8)%]和心功能正常组[(62.9±7.3)% vs (60.4±6.5)%]术后7 d内平均LVEF较术前均明显升高,差异均有统计学意义(P均<0.05)。术后1个月时,心功能不全组患者平均LVEF提高至 (48.6±12.6)%,与术后7 d相比差异有统计学意义(P<0.05);心功能正常组患者平均LVEF升高至(63.2±6.6)%,但与术后7 d相比差异无统计学意义(P>0.05)。术后6个月时,心功能不全组患者的平均LVEF达到(54.7±10.6)%,较术后1个月时明显升高(P<0.05);心功能正常组患者的LVEF较术后1个月时略有升高,但差异无统计学意义(P>0.05)。与术前相比,两组患者TAVR治疗后NYHA心功能分级均明显好转,差异均有统计学意义(P均<0.001)。
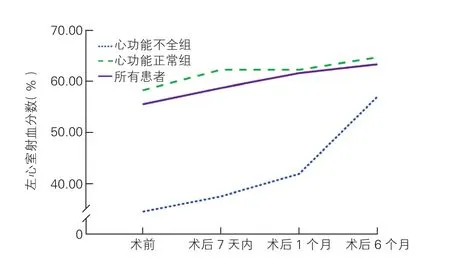
图1 两组患者TAVR治疗前后左心室射血分数的变化情况
2.3 两组患者TAVR治疗前后血NT-proBNP浓度的变化情况(图2)
心功能不全组[1 874(1 446~3 120) pg/ml vs 8 580(3 425~9 132) pg/ml]和心功能正常组[1 688(723~3 435) pg/ml vs 3 071 (1 169~6 721) pg/ml]术后7 d内平均NT-proBNP浓度均快速下降,与术前相比差异均有统计学意义(P均<0.05)。术后1个月时,两组患者的平均NT-proBNP浓度分别为1 530(843~2 373)pg/ml和721(418~1 828)pg/ml,较术后7 d内继续下降,差异均有统计学意义(P均<0.05)。术后6个月时,两组NT-proBNP浓度较术后1个月继续大幅下降,差异均有统计学意义(P<0.05)。
2.4 两组患者TAVR治疗前后主动脉瓣瓣口面积的变化情况
所有患者术后的平均主动脉瓣瓣口面积较术前明显改善[(1.57±0.43)cm2vs (0.58±0.23)cm2,P<0.05]。心功能不全组[(1.54±0.53)cm2vs(0.47±0.19)cm2]和心功能正常组[(1.54±0.53)cm2vs (0.62±0.23)cm2]TAVR治疗后的主动脉瓣瓣口面积与术前相比均扩大,差异均有统计学意义(P均<0.05)。
2.5 两组患者TAVR治疗前后主动脉平均瓣跨瓣压差、最大跨瓣压差和血流速度的变化情况(图3)
两组患者的主动脉瓣平均跨瓣压差、最大跨瓣压差、最大跨瓣血流速度在术后7 d内明显下降,与术前比较均有统计学意义(P<0.05);术后1个月时,两组患者的主动脉瓣平均跨瓣压差、最大跨瓣压差、最大跨瓣血流速度仍继续下降,但仅心功能正常组较术后7 d明显下降,分别为[(8.6±3.3) mmHg vs(11.9±4.7) mmHg]、[(18.9±5.6) mmHg vs (22.4±9.5)mmHg]、[(2.2±0.3)m/s vs (2.3±0.5)m/s],差异均有统计学意义(P均<0.05)。术后6个月时,两组患者的主动脉瓣最大跨瓣血流速度较术后1个月均继续下降,差异均有统计学意义(P均<0.05);两组患者的主动脉瓣跨瓣压差也继续下降,但与1个月对比差异均无统计学意义(P均>0.05)。从趋势上看,两组患者的主动脉瓣跨瓣压差、最大跨瓣血流速度术后7 d内均明显快速下降,术后1个月时仍保持较快的下降速度,但术后1个月后主动脉瓣跨瓣压差和血流速度下降缓慢,逐渐趋于稳定状态。
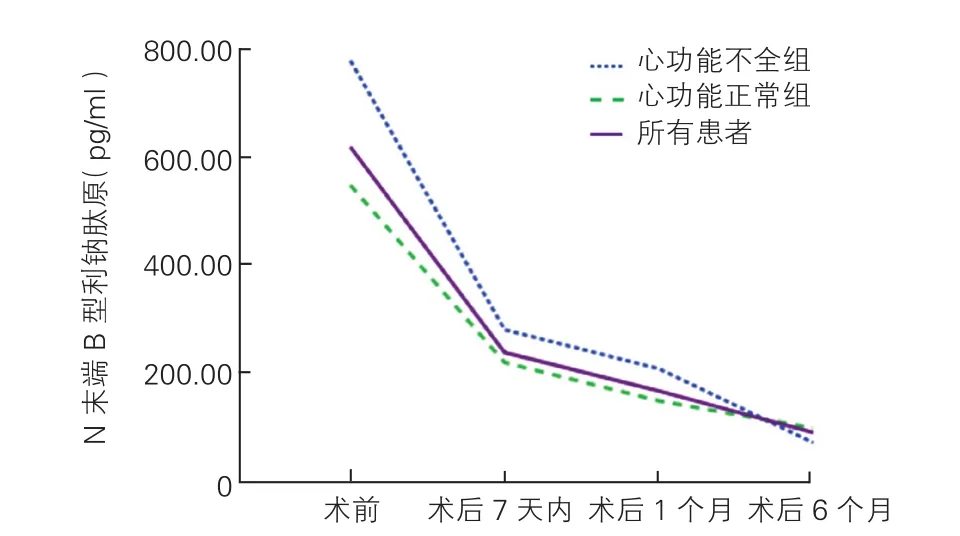
图2 两组患者TAVR治疗前后血NT-proBNP浓度的变化趋势图
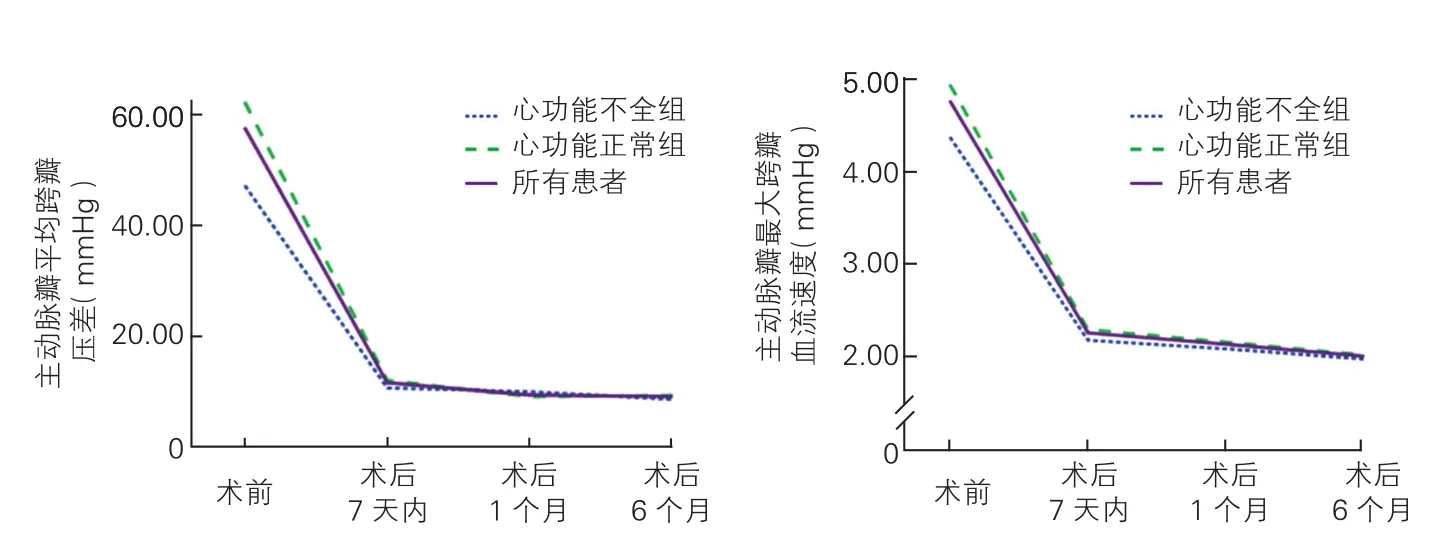
图3 两组患者TAVR治疗前后主动脉瓣平均跨瓣压差和最大跨瓣血流速度的变化趋势图
3 讨论
目前国际上已将TAVR治疗作为心外科瓣膜置换术高危患者或有禁忌证患者的首选治疗方式[7],但关于患者TAVR术后心功能、主动脉瓣跨瓣压差和血流速度的特点及变化规律报道较少,且缺乏国人自己的报道。本研究在区分心功能不全和正常的情况下,观察患者手术前后心功能、血NT-proBNP浓度、主动脉瓣跨瓣压差和最大跨瓣血流速度的变化特点。本研究主要结论:首先,TAVR治疗可有效改善严重AS患者的心功能;其次,TAVR治疗7 d内,患者的主动脉瓣口狭窄解除,瓣口面积扩大,跨瓣压差和最大跨瓣血流速度、血NT-proBNP浓度均快速下降,心功能好转,且在6个月内持续改善。
本研究中TAVR患者的平均年龄为(75.8±6.6)岁,与PARTNER研究和CoreValve研究相似,均属于高龄患者,但另外两项研究中患者年龄更高,可能与入选标准不同有关,而本研究中年轻患者多合并肿瘤或者胸部放射史。本研究中心功能Ⅲ级和Ⅳ级患者占89.8%(43/49),与PARTNER研究类似(92.2%)[3],提示患者的心功能差、心力衰竭(心衰)严重;心功能不全组患者的住院时间较心功能正常组更长(P=0.026),提示心衰越重,恢复时间亦更长。心功能正常组患者的主动脉瓣跨瓣压差更大(P=0.006),原因是主动脉瓣跨瓣压差大小与心肌收缩力强弱和每搏输出量多少有关[8]。
根据心衰诊断和治疗指南规定[6],心衰、心功能分级的客观评价指标有NT-proBNP浓度和LVEF。在心衰患者中,NT-proBNP浓度高低与心衰严重程度平行,NT-proBNP浓度在病情缓解或有效治疗后可好转或回落至正常水平[9]。本研究中,心功能不全组患者的平均NT-proBNP浓度明显高于心功能正常组(P=0.000)。TAVR术后,所有患者的动脉瓣狭窄解除,心室和心房压力下降,心功能正常组和心功能不全组患者的NT-proBNP浓度都迅速下降,在术后7 d内下降最快,术后6个月内持续下降,术后1个月后下降速度减缓,部分患者在术后1个月时恢复至正常范围。心功能不全组和心功能正常组患者术后7 d内LVEF均明显改善;术后1个月时,心功能正常组患者的LVEF较术后7 d时变化不明显甚至降低,推测与心功能正常组患者LVEF改善空间有限有关,此外也与TAVR并发症影响心功能有关,如3度房室传导阻滞需植入永久起搏器;术后6个月时,患者的LVEF整体持续升高,表明心功能仍有改善空间,尤其对于左心功能不全患者,虽然解除了瓣膜狭窄,但因狭窄造成的心肌病变仍存在,需长期治疗和维护才能继续改善心衰。本研究同时也提示,左心功能不全患者在术后1个月时心功能恢复明显,术后6个月时平均水平恢复至正常。PARTNER系列研究和CoreValve研究提示,经TAVR治疗后,NYHA心功能分级Ⅰ~Ⅱ级的患者明显增多,并且可稳定持续2年[10,11]。
本研究中AS患者经TAVR治疗后,主动脉瓣瓣口面积扩大,心功能不全组和心功能正常组患者换瓣后的瓣口面积相似,这与既往研究报道相同:PARTNER研究显示,TAVR术后患者的瓣口面积从基线(0.6±0.2)cm2至术后30 d时扩大至(1.5±0.5)cm2[11,12]。因为瓣口面积与每搏输出量相关[8],且跨瓣压差与流量、血流速度高度相关,因此,平均跨瓣压差与最大血流速度变化趋势图类似。本研究中,因为主动脉瓣瓣口狭窄解除,两组患者的平均跨瓣压差、最大跨瓣压差、最大跨瓣血流速度在术后7 d内明显下降;术后1个月时,上述3项指标仍保持较快的下降速度,但仅心功能正常组较术后7 d明显下降,但术后1个月后平均跨瓣压差、最大跨瓣压差和血流速度下降缓慢,逐渐趋于稳定状态,推测与瓣膜支架形状相对固定有关。PARTNER Ⅰ和PARTNERⅡ研究表明,TAVR术前至术后30 d,患者的主动脉瓣瓣口面积明显增加,主动脉瓣平均跨瓣压差明显下降[(44.5±15.5)mmHg vs (11.1±6.9) mmHg,P<0.01],且对比外科主动脉瓣置换术组,TAVR组患者在各个时间点的主动脉瓣瓣口面积和跨瓣压差改善更明显,并且这些改变可以持续2年[10-12]。
本研究的局限性:首先,由于时间限制,本研究样本量较少,且缺乏长期的随访,可能导致结果出现偏差。其次,我们仅测量了术前和术后7 d内的主动脉瓣瓣口面积,缺乏对瓣口面积的长期变化特点观察。尽管PARTNER研究2年结果显示,瓣膜框架结构无明显变化(变形),但对于生物瓣膜的持久性、长期安全性和有效性需要进一步研究和随访。第三,未详细探讨TAVR术后个别患者心功能下降的原因,其中大部分与合并症和并发症相关,有待进一步探讨。
总之,本研究证实,对于因为心功能差、合并症或体质虚弱而不能行外科手术治疗的严重AS患者,TAVR是一种有效改善心功能的治疗方式。TAVR治疗对左心功能不全患者的改善程度比心功能正常者更明显,但心功能不全者心功能完全恢复正常需一段时间,提示术后继续要按照心衰治疗原则治疗才能尽快恢复心功能。TAVR术后患者的主动脉瓣瓣口面积扩大,进而引起跨瓣血流速度及压差下降,术后6个月左右趋于稳定。鉴于该领域国内尚无大规模开展的研究,希望本研究对临床实践有一定的指导意义。
[1] O'Brien SM, Shahian DM, Filardo G, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 2--isolated valve surgery. Ann Thorac Surg, 2009, 88(Suppl): S23-S42.
[2] Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med, 2010, 363: 1597-1607.
[3] Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011, 364: 2187-2198.
[4] Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med, 2014, 370: 1790-1798.
[5] Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol, 2014, 63: 2438-2488.
[6] Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2016, 18: 891-975.
[7] Otto CM, Kumbhani DJ, Alexander KP, et al. 2017 ACC expert consensus decision pathway for transcatheter aortic valve replacement in the management of adults with aortic stenosis: a report of the American College of Cardiology task force on clinical expert consensus documents. J Am Coll Cardiol, 2017 Jan 4. PMID: 28063810.
[8] Burwash IG, Thomas DD, Sadahiro M, et al. Dependence of Gorlin formula and continuity equation valve areas on transvalvular volume flow rate in valvular aortic stenosis. Circulation, 1994, 89: 827-835.
[9] Bergler-Klein J, Gyongyosi M, Maurer G. The role of biomarkers in valvular heart disease: focus on natriuretic peptides. Can J Cardiol, 2014, 30: 1027-1034.
[10] Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aorticvalve replacement in intermediate-risk patients. N Engl J Med, 2016, 374: 1609-1620.
[11] Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011, 364: 2187-2198.
[12] Kodali S, Thourani VH, White J, et al. Early clinical and echocardiographic outcomes after SAPIEN 3 transcatheter aortic valve replacement in inoperable, high-risk and intermediate-risk patients with aortic stenosis. Eur Heart J, 2016, 37: 2252-2262.
Short-term Echocardiography and Blood NT-proBNP Changes in Aortic Stenosis Patients After Transcatheter Aortic Valve Replacement
ZHAO Zhen-yan, SONG Guang-yuan, ZHANG Wen-jia, ZHANG Qian, NIU Guan-nan, ZHOU Zheng, ZHANG Hao, PEI Han-jun, WANG Jian-de, XIAO Ming-hu, YANG Yue-jin, WU Yong-jian.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China Corresponding Author: WU Yong-jian, Email: fuwaiwyj@163.com
Objective: To explore the cardiac function and outcomes in patients of aortic stenosis (AS) after transcatheter aortic valve replacement (TAVR) within 6 months in order to provide the guidance for clinical treatment.
Methods: A total of 49 consecutive severe AS patients with surgical contradiction or STS high risk score and received successful TAVR in our hospital from 2013-12 to 2015-12 were studied. Echocardiography and blood levels of NT-proBNP were examined at pre- and 1 month, 6 months after TAVR. Left ventricular ejection fraction (LVEF), aortic valve mean gradient (MG), peak gradient (PG) and peak velocity (PV) were recorded. Based on pre-operative LVEF, the patients were divided into 2 groups: Cardiac dysfunction group, LVEF<50%, n=15 (30.6%) and Normal cardiac function group,LVEF≥50%, n=34 (69.4%). Post-operative cardiac function and blood levels of NT-proBNP were compared between 2 groups.
Results: In all 49 patients, the following parameters were significantly improved within 7 days after TAVR: LVEF (56.0±14.6) % vs (52.5±13.8)%, MG (11±5) mmHg vs (58±18) mmHg, PG (21.7±9.5) mmHg vs (93.0±28.6) mmHg, PV (2.3±0.5) m/s vs (4.8±0.7) m/s, blood NT-proBNP level [1831 (1098-3363)] pg/ml vs [3842 (1763-8664)] pg/ml and aortic valve area (1.57±0.43) cm2vs (0.58±0.23) cm2all P<0.05. Within 6 months after TAVR, LVEF was continuously increasing especially in Cardiac dysfunction group; MG, PV and NT-proBNP level were continuously decreasing, NYHA grade was continuously improving, all P<0.05.
Conclusion: TAVR was an effective treatment in AS patients with surgical contradiction or STS high risk score; it may continuously improve cardiac function, especially in patients with left heart dysfunction.
Aortic valve stenosis; Heart valve prosthesis implantation; Echocardiography
2017-02-16)
(编辑:朱柳媛)
十二五国家科技支撑计划(2015BAI12B02)
100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 冠心病诊治中心(赵振燕、宋光远、张文佳、张倩、牛冠男、周政、张昊、裴汉军、杨跃进、吴永健),心脏超声诊治中心(王建德、肖明虎)
赵振燕 主治医师 博士研究生 主要从事冠心病和经导管主动脉瓣置换术相关临床研究 Email: zhaozhenyan-82@163.com通讯作者:吴永健 Email: fuwaiwyj@163.com
R54
A
1000-3614(2017)06-0575-05
10.3969/j.issn.1000-3614.2017.06.011
