沉默信息调节因子2同源蛋白1在甲状腺乳头状癌组织中的表达及其临床意义
2017-06-24董玲玲玉素甫买买提郭雅文王昶文黄韬克力木阿不都热依木
董玲玲 玉素甫·买买提 郭雅文 王昶文 黄韬 克力木·阿不都热依木
·论著·
沉默信息调节因子2同源蛋白1在甲状腺乳头状癌组织中的表达及其临床意义
董玲玲 玉素甫·买买提 郭雅文 王昶文 黄韬 克力木·阿不都热依木
目的 研究沉默信息调节因子2同源蛋白1(SIRT1)在甲状腺乳头状癌组织中的表达及其临床意义。方法 采用免疫组织化学法和组织芯片技术检测88例甲状腺乳头状癌组织中SIRT1的表达,分析SIRT1蛋白的表达情况及其与甲状腺乳头状癌临床病理特征的关系。结果 SIRT1阳性染色主要集中在细胞核中,呈黄色或者棕色颗粒。根据免疫组织化学染色评分,88例甲状腺乳头状癌组织中SIRT1阳性率为48.9%。χ2检验结果显示,SIRT1表达与颈部淋巴结转移、TNM分期显著相关(P<0.05),SIRT1表达与年龄、性别、肿瘤大小、癌灶多少、甲状腺包膜浸润不相关(P>0.05)。Logistic回归分析显示,SIRT1阳性是甲状腺乳头状癌颈部淋巴结转移的独立危险因素(P<0.05)。结论 SIRT1可能参与甲状腺乳头状癌的发生发展和颈部淋巴结转移,并可能成为甲状腺乳头状癌颈部淋巴结转移的治疗靶点。
沉默信息调节因子2同源蛋白1; 甲状腺乳头状癌; 颈部淋巴结转移; 免疫组织化学法; 组织芯片
沉默信息调节因子2-相关酶类(silent information regulator 2-related enzymes,Sirtuins)是第三类组蛋白去乙酰化酶,Sirtuin家族(包括SIRT1~SIRT7)的酶活性均依赖于NAD+,但酶活性、底物蛋白和细胞功能均不一致,其中沉默信息调节因子2同源蛋白1 (silent mating type information regulation 2 homolog 1,SIRT1) 同时具有致癌和抑癌作用,目前是Surtuin家族的研究热点[1]。SIRT1蛋白主要定位于细胞核中,在哺乳动物多种组织如肝脏、胰腺中表达,在DNA损伤修复 、抵抗应激 、肿瘤发生等方面发挥作用[2]。SRIT1在乳腺癌、前列腺癌、胰腺癌中表达上调[3-5],参与癌症的发生、发展,在皮肤癌、口腔鳞状上皮癌中表达下调,抑制癌症的生长、浸润和转移[6-7]。Herranz等[8]研究发现,SIRT1在甲状腺癌中表达上调,与肿瘤蛋白c-MYC水平相适应,促进甲状腺癌的生长,加快肿瘤进程。甲状腺癌中最常见的病理类型是甲状腺乳头状癌,其预后与临床病理特征显著相关[9]。我们采用免疫组织化学法和组织芯片技术,检测甲状腺乳头状癌组织中SIRT1的表达水平,并分析SIRT1与临床病理特征的关系及临床意义。
对象与方法
一、对象
88点甲状腺乳头状癌组织芯片购自上海国家生物芯片工程中心。组织芯片是在每个甲状腺乳头状癌组织中取一个直径1.5 mm的标本组成的组织微阵列。甲状腺乳头状癌患者88例,年龄14~91岁,中位年龄47.0岁,病历资料完整。术前经B超引导下穿刺证实为甲状腺乳头状癌或者影像学检查高度怀疑甲状腺恶性肿瘤,术前均无头颈部手术史、放化疗史及其他恶性肿瘤病史。所有患者均行甲状腺切除联合颈部中央区淋巴结清扫,术后病理检查均证实为甲状腺乳头状癌,病理分期采用美国癌症联合委员会2010年第7版TNM分期法。
二、方法
1.免疫组织化学检测:免疫组化定性检测甲状腺乳头状癌组织中SIRT1 的表达,鼠抗人SIRT1单克隆抗体及辣根过氧化物酶标记羊抗小鼠IgG购自美国CST公司。操作步骤:(1)组织芯片置于恒温箱(60℃)60分钟,二甲苯脱蜡,梯度乙醇水化,蒸馏水室温浸泡30分钟,0.1 mol/L 磷酸盐缓冲液(PBS)冲洗5分钟,共3次;(2)滴加3%H2O2,37℃孵育60分钟,PBS冲洗5分钟,共3次;(3)置于0.01 mol/L枸橼酸盐缓冲液(PH6.0)中,高压锅内快速煮沸,室温下自然冷却,PBS冲洗5分钟,共3次;(4)10%正常山羊血清抗原封闭,37℃孵育60 分钟,PBS冲洗5分钟,共3次;(5)滴加SIRT1单抗,4℃过夜,PBS冲洗5 分钟,共3次;(6)滴加二抗,37℃孵育60 min,PBS冲洗5分钟,共3次;(7)滴加亲和素标记辣根过氧化物酶工作液,37℃孵育20分钟,PBS冲洗5分钟,共3次;(8)二氨基联苯胺(DAB)显色5~10分钟,苏木素复染2分钟,梯度乙醇脱水,中性树脂封片、镜检。已知阳性组织切片作为阳性对照,以PBS代替一抗作为阴性对照。
2.免疫组化结果判定 :根据切片阳性细胞率和阳性细胞着色强度记分相乘判定SIRT1结果。SIRT1着色强度:不着色记0分,浅黄为1分,深黄或者棕黄记3分,浅深黄之间记2分;阳性细胞率:≤25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分,两者得分相乘≤6分的判定为SIRT1阴性,8~12分判定为SIRT1阳性。
三、统计学方法
应用SPSS 22.0软件对数据进行分析,采用χ2检验和Fisher精确概率法分析组间差异。采用Logistic二元回归模型和Log-rank检验行风险因素的单因素、多因素分析。P<0.05为差异有统计学意义。
结 果
1.SIRT1在甲状腺乳头状癌组织中的表达:SIRT1阳性着色主要集中在细胞核中,呈黄色或者棕色颗粒。根据免疫组织化学染色评分对88例甲状腺乳头状癌患者进行分组,SIRT1阴性45例,SIRT1阳性43例,SIRT1阳性率48.9%。
2.SIRT1的表达与甲状腺乳头状癌临床病理特征的关系见表1。结果显示,SIRT1的表达与甲状腺乳头状癌颈部淋巴结转移(P<0.05)和临床分期(P<0.05)显著相关。在48例淋巴结转移阴性患者中,SIRT1阴性32例,SIRT1阳性16例,SIRT1阳性率33.3%。在40例淋巴结转移阳性患者中,SIRT1阴性13例,SIRT1阳性27例,SIRT1阳性率67.5%,SIRT1阳性的患者颈部淋巴结转移较多见(62.8%)。在49例临床分期Ⅰ~Ⅱ的患者中,SIRT1阴性32例,SIRT1阳性17例,SIRT1阳性率34.7%,在39例临床分期Ⅲ~Ⅳ的患者中,SIRT1阴性13例,SIRT1阳性26例,SIRT1阳性率66.7%,SIRT1阳性的患者临床分期相对较晚(60.5%)。在88例甲状腺乳头状癌患者中,年龄<45岁41例,≥45岁47例,男32例,女56例,SIRT1的表达在年龄组间比较差异无统计学意义(均P>0.05)。本组病例中,肿瘤直径≤2 cm 42例,SIRT1阳性率47.6%,肿瘤直径>2 cm 46例,SIRT1阳性率50%,单个癌灶患者76例,SIRT1阳性率50.0%,多个癌灶患者12例,SIRT1阳性率41.7%,甲状腺包膜未浸润患者80例,SIRT1阳性率48.8%,甲状腺包膜浸润患者8例,SIRT1阳性率50.0%,χ2检验结果显示,SIRT1的表达与肿瘤大小、癌灶多少、甲状腺包膜浸润均无统计学意义(P>0.05)。
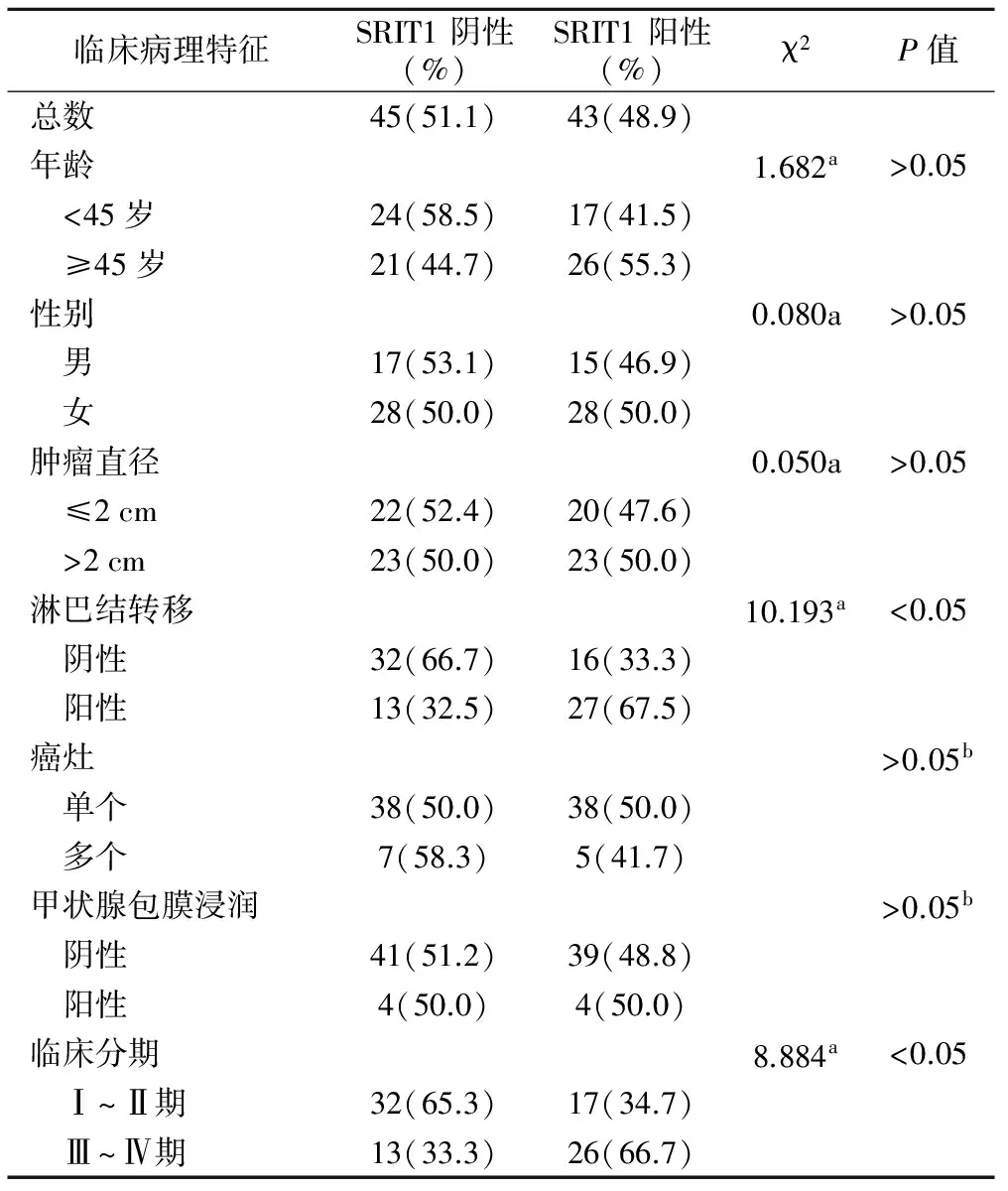
表1 SRIT1与甲状腺乳头状癌临床病理特征的关系
注:a,皮尔逊卡方;b,Fisher精确概率法
3.甲状腺乳头状癌颈部淋巴结转移风险因素的单因素、多因素分析 :采用Logistic二元回归模型分析甲状腺乳头状癌颈部淋巴结转移的风险因素,结果见表2,SIRT1阳性是甲状腺乳头状癌颈部淋巴结转移的独立危险因素[P<0.05;相对风险(HR)=3.918;95%可信区间(CI):1.581~9.711],年龄、性别、肿瘤大小、癌灶多少、甲状腺包膜浸润对甲状腺乳头状癌颈部淋巴结转移的影响无统计学意义(P>0.05)。
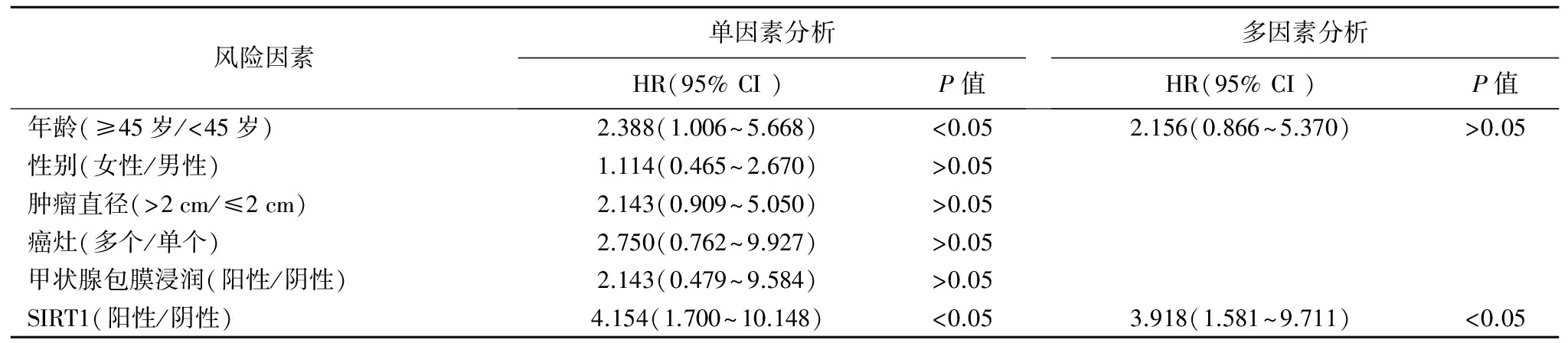
表2 甲状腺乳头状癌颈部淋巴结转移风险因素的单因素、多因素分析
讨 论
SIRT1在不同组织肿瘤的发生、发展过程中存在两面性,这可能与肿瘤细胞的组织特异性以及复杂的细胞内信号转导通路有关[1]。一方面,p53蛋白是p53抑癌基因编码的蛋白质,细胞周期相关转录因子E2F1调控细胞周期和细胞凋亡,内源性的SIRT1 蛋白通过对p53蛋白、E2F1的去乙酰化,阻碍DNA损伤及致癌应激引起的凋亡,发挥致癌作用[1-10]。另一方面,NF-κB参与免疫应答和肿瘤形成,内源性的SIRT1蛋白可以通过抑制NF-κB转录活性达到抑制肿瘤生长的目的[1]。在胰腺癌细胞系,SIRT1抑制剂EX-527,显示一定的抗肿瘤作用[11]。在甲状腺乳头状癌细胞中,Kweon等[12]研究发现,当癌细胞遭遇基因毒性损伤,SIRT1通过Sirt1-Foxp3-Bax/p21信号通路下调Bax,上调p21,保护癌细胞免于凋亡。林新恭等[13]报道,SIRT1在甲状腺乳头状癌组织中的表达显著高于SIRT1在癌旁正常甲状腺组织中的表达,推测SIRT1高表达在甲状腺乳头状癌的发生发展过程中起重要作用。
本研究采用免疫组化方法检测88例甲状腺乳头状癌组织中SIRT1的表达,SIRT1阳性率为48.9%,低于相关文献报道[13],可能与本研究免疫组化评分标准相对严格有关。本研究结果显示,SIRT1阳性患者颈部淋巴结转移率较SIRT1阴性患者高,SIRT1阳性患者的临床分期普遍较晚,与文献报道一致[13-14],证实SIRT1在甲状腺乳头状癌的发展过程中起重要作用。本研究结果显示,SIRT1的表达与甲状腺乳头状癌患者的年龄、性别、肿瘤大小、癌灶多少、包膜浸润无关,与吴文艺等[14]的研究报道一致,提示SIRT1的表达与甲状腺乳头状癌患者的年龄、性别、肿瘤大小、癌灶多少、包膜浸润无关。为了排除混杂因素影响,我们采用Logistic二元回归模型分析颈部淋巴结转移的风险因素,单因素和多因素分析结果显示,SIRT1阳性是甲状腺乳头状癌颈部淋巴结转移的独立危险因素,推测SIRT1高表达有助于甲状腺乳头状癌发生颈部淋巴结转移。吴文艺等[14]在人类甲状腺乳头状癌组织和配对的癌旁组织中检测SIRT1 mRNA和SIRT1蛋白表达,结果显示在甲状腺乳头状癌组织中SIRT1 mRNA和SIRT1蛋白的表达水平显著高于癌旁组织中SIRT1 mRNA和SIRT1蛋白的表达水平,SIRTl mRNA及SIRT1蛋白在甲状腺乳头状癌淋巴结转移阳性组中的表达显著高于淋巴结转移阴性组的表达,因此可以推测,SIRT1高表达促进甲状腺乳头状癌早期出现颈部淋巴结转移。
Zhao等[5]研究表明,在胰腺癌组织中检测SIRT1 mRNA和SIRT1蛋白水平,SIRT1高表达与年龄>60岁、肿瘤直径>4 cm、TNM分期较晚、淋巴结转移或者肝转移密切相关,在胰腺癌细胞系中使用siRNA阻碍SIRT1的合成,胰腺癌细胞增殖周期被阻滞,增殖及浸润减少,凋亡增加,癌肿形成被抑制。结合本研究结果,进一步证实 SIRT1不仅参与肿瘤的发生、生长,而且在肿瘤的淋巴结转移及远处转移过程中发挥重要作用。
上皮细胞间充质转化是上皮细胞通过特定程序转化成具有间质表型细胞的生物学行为,上皮细胞间充质转化与肿瘤细胞的侵袭和迁移密切相关[15]。Palmirotta等[16]报道,SIRT1在胰腺导管腺癌、肝细胞性肝癌、胃癌、乳腺癌、前列腺癌中均参与上皮细胞间充质转化,促进并维持癌细胞的活力和侵袭能力。Byles等[17]发现,在前列腺癌体外实验和体内实验中,沉默SIRT1可以显著上调E-cadherin,增加细胞间黏附力,从而降低前列腺癌的浸润和转移。我们推测,在甲状腺乳头状癌中,SIRT1促进肿瘤浸润和转移可能与上皮细胞间充质转化有关,这一机制有待进一步研究。
综上所述,SIRT1促进甲状腺乳头状癌的发生、发展及颈部淋巴结转移,并可能成为甲状腺乳头状癌颈部淋巴结转移的治疗靶点。
[1] Chalkiadaki A,Guarente L.The multifaceted functions of sirtuins in cancer[J].Nat Rev Cancer,2015,15(10):608-624.
[2] Chang HC,Guarente L.SIRT1 and other sirtuins in metabolism[J].Trends Endocrinol Metab,2014,25(3):138-145.
[3] Lee H,Kim KR,Noh SJ,et al.Expression of DBC1 and SIRT1 is associated with poor prognosis for breast carcinoma[J].Hum Pathol,2011,42(2):204-213.
[4] Nakane K,Fujita Y,Terazawa R,et al.Inhibition of cortactin and SIRT1 expression attenuates migration and invasion of prostate cancer DU145 cells[J].Int J Urol,2012,19(1):71-79.
[5] Zhao G,Cui J,Zhang JG,et al.SIRT1 RNAi knockdown induces apoptosis and senescence,inhibits invasion and enhances chemosensitivity in pancreatic cancer cells[J].Gene Ther,2011,18(9):920-928.
[6] Ming M,Shea CR,Guo X,et al.Regulation of global genome nucleotide excision repair by SIRT1 through xeroderma pigmentosum C[J].Proc Natl Acad Sci U S A,2010,107(52):22623-22628.
[7] Chen IC,Chiang WF,Huang HH,et al.Role of SIRT1 in regulation of epithelial-to-mesenchymal transition in oral squamous cell carcinoma metastasis[J].Mol Cancer,2014,13:254.
[8] Herranz D,Maraver A,Canamero M,et al.SIRT1 promotes thyroid carcinogenesis driven by PTEN deficiency[J].Oncogene,2013,32(34):4052-4056.
[9] 吴娟,冯红芳,李祥,等.1358例甲状腺结节的临床与病理特征分析[J].临床外科杂志,2016,24(3):197-200.
[10]Yi J,Luo J.SIRT1 and p53,effect on cancer,senescence and beyond[J].Biochim Biophys Acta,2010,1804(8):1684-1689.
[11]Kozako T,Suzuki T,Yoshimitsu M,et al.Anticancer agents targeted to sirtuins[J].Molecules,2014,19(12):20295-20313.
[12]Kweon KH,Lee CR,Jung SJ,et al.Sirt1 induction confers resistance to etoposide-induced genotoxic apoptosis in thyroid cancers[J].Int J Oncol,2014,45(5):2065-2075.
[13]林新恭,吴文艺,张丽婷,等.HIC1和SIRT1的异常表达与甲状腺乳头状癌的关系研究[J].中国医科大学学报,2015,44(11):995-998.
[14]吴文艺,张丽婷,傅德强,等.沉默信息调节因子2相关酶1在甲状腺乳头状癌组织中的表达及其意义[J].中华实验外科杂志,2015,32(4):877-880.
[15]Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial-mesenchymal transition[J].Nat Rev Mol Cell Biol,2014,15(3):178-196.
[16]Palmirotta R,Cives M,Della-Morte D,et al.Sirtuins and cancer:role in the epithelial-mesenchymal transition[J].Oxid Med Cell Longev,2016,3031459.
[17]Byles V,Zhu L,Lovaas JD,et al.SIRT1 induces EMT by cooperating with EMT transcription factors and enhances prostate cancer cell migration and metastasis[J].Oncogene,2012,31(43):4619-4629.
(本文编辑:杨泽平)
Expression and clinical significance of SIRT1 in papillary thyroid carcinoma
DONGLingling,Yusufu·Maimaiti,GUOYawen,etal.
(DepartmentofBreastandThyroidSurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China)
Objective To investigate silent mating type information regulation 2 homolog 1(SIRT1)expression and its clinical significance in papillary thyroid carcinoma.Methods We used immunohistochemistry and tissue microarray technique to detect the expression of SIRT1 in 88 papillary thyroid carcinoma tissues.Results SIRT1 positive staining was mainly located in cell nucleus,showed yellow and brown granulated.According to immunohistochemistry scoring,SIRT1 positive rate in the 88 papillary thyroid carcinoma tissues was 48.9%.χ2test showed that SIRT1 expression was significantly associated with cervical lymph node metastasis and TNM stage(P<0.05),and no statistical relationships were found between SIRT1 expression and age,gender,tumor size,cancer lesion number or thyroid capsule invasion(P>0.05).Logistic regression analysis showed SIRT1 was an independent risk factor to cervical lymph node metastasis(P<0.05).Conclusion SIRT1 may be involved in the tumorigenesis and cervical lymph node metastasis in papillary thyroid carcinoma,and may become a new target therapeutic drug to cervical lymph node metastases.
SIRT1; papillary thyroid carcinoma; cervical lymph node metastasis; immunohistochemistry; tissue microarray
10.3969/j.issn.1005-6483.2017.03.014
华中科技大学自主创新基金资助项目(0118530088)
430022 武汉,华中科技大学同济医学院附属协和医院乳腺甲状腺外科(董玲玲、郭雅文、王昶文、黄韬);新疆维吾尔自治区人民医院微创外科(玉素甫·买买提、克力木·阿不都热依木)
克力木·阿不都热依木,Email:klm6075@163.com
2016-10-19)
