腹腔镜肝切除术治疗小肝癌临床分析
2017-06-24宋举贤陈健李建伟范毓东王小军郑树国
宋举贤 陈健 李建伟 范毓东 王小军 郑树国
·论著·
腹腔镜肝切除术治疗小肝癌临床分析
宋举贤 陈健 李建伟 范毓东 王小军 郑树国
目的 探讨腹腔镜肝切除术(LH)治疗小肝癌的临床疗效。方法 回顾分析2007年1月~2013年12月第三军医大学西南医院102例行LH治疗小肝癌患者的临床资料。结果 102例患者中中转开腹4例,中转开腹率为 3.9%,并发症发生率为29.4%,手术时间(189.6±76.9)分钟,术中失血量(284.6±278.6)ml,术中输血率为3.9%,全肠外营养使用率为6.9%,住院时间为(16.1±5.5)天。中位随访时间为44.5个月,1年、3年总体生存率为95.3%、82.6%,相应的总体无瘤生存率为80.4%、58.2%。亚组分析中肝前下段组和肝后上段组在围手术期数据和随访结果比较,差异均无统计学意义(P>0.05)。结论 LH创伤小,恢复快,并发症发生率低,腹腔镜肝切除术在肝前下段和肝后上段切除具有相同的近期和远期效果。
腹腔镜肝切除术; 小肝癌; 微创
肝切除术一直被推荐为治疗小肝癌(hepatocellular carcinoma,HCC)的一线选择。传统开腹肝切除创伤大,出血多,并发症发生率和手术死亡率均较高[1]。腹腔镜手术的近期效果优于开腹手术,远期效果与开腹手术一致[2-3],肝癌的微创治疗优势明显。目前国内腹腔镜肝切除手术(laproscopic hepatectomy,LH)的文献虽多,但样本量较少且大多集中于肝前下段(Ⅱ、Ⅲ、Ⅳb、Ⅵ段)的病灶局部切除、楔形切除或者半肝切除,对于肝后上段(Ⅰ、Ⅳa、Ⅶ、Ⅷ段)的腹腔镜手术鲜有报道[4]。我们2007年开展腹腔镜手术以来,顺利完成学习曲线,逐渐发展至全肝段的精细解剖性切除。现对2007年1月~2013年12月102例行LH治疗小肝癌患者的临床资料进行回顾性分析。
对象与方法
一、对象
HCC患者102例,男87例,女15例,年龄22~74岁,平均年龄49岁。所有患者均无特异性临床症状,仅有5例因肝硬化进展及乙肝病毒复制增高出现明显乏力、纳差,其余为乙肝复诊或体检时发现。诊断依据:术前明确的肝病史、实验室检验结果及相关影像学资料,包括上腹部增强CT、超声造影或肝肿瘤特异性磁共振,并经过术后病理检查确诊。乙肝病毒感染100例,病理证实的肝硬化91例。巴塞罗那临床肝癌分期:0期42例,A期60例。Child-Pugh分级:A级99例,B级3例。东部肿瘤协作组评分标准:0分83例,1分17例,2分2例。肿瘤数量:单发96例,2个6例。根据肝脏的Couinaud分段法,结合术前CT检查及术中确认统计每个肿瘤的位置,当肿瘤位于肝段之间时以占有体积较大的计算:Ⅰ段2例,Ⅱ段10例,Ⅲ段16例,Ⅳ段17例,Ⅴ段13例,Ⅵ段29例,Ⅶ段8例,Ⅷ段13例。
在亚组分析中按肿瘤切除部位分为肝前下段组和肝后上段组。肝后上段组是在完成LH学习曲线后开展,病例数少,为保证基线资料的方差齐性(P>0.05),两组根据年龄(5年内),肝癌确诊日期(同年内),手术治疗日期(同年内)和BCLC分期(相同或相似)进行了1∶1匹配,最终完成配对46例,其中肝前下段组(23例)和肝后上段组(23例)。
纳入组标准:(1)年龄18~75岁;(2)原发性肝癌诊断明确;(3)肝内单发肿瘤,最大直径≤3 cm,未侵犯门静脉、肝动静脉及下腔静脉,无淋巴结或肝外转;(4)肝功能(Child-Pugh分级A或B,ICG-R15<30%,无凝血功能障碍,血小板计数>50×109/L和凝血酶原时间延长<5 s);(5)之前未进行肝动脉化疗栓塞、射频消融、无水酒精注射手术、索菲拉尼、化疗等抗肿瘤治疗;(6)ECOG评分≤2分。
排除标准:(1)重度门脉高压征(有胃底或食管静脉曲张破裂出血史、严重脾功能亢进或难治性腹水);(2)病理学检查证实为胆管细胞性、混合细胞性肝癌、切缘阳性者及非肝脏原发性肿瘤。
二、方法
1.手术方法:患者常规取仰卧位,气管插管,静脉复合全身麻醉。根据肿瘤的位置适当垫高右侧背部、悬吊右臂,必要时整体向左或向右倾斜15~45°。穿刺针建立12~14 mmHg气腹,于脐周刺入腹腔镜孔,然后依次完成其他操作孔。探查腹腔脏器,检查有无肿瘤转移或侵犯,使用术中超声进一步明确肝脏情况及肿瘤部位,结合影像资料及术中探查结果决定手术方式。原则上尽量行解剖性肝段切除,对于无法行解剖性肝段切除者,切缘至少距离肿瘤边缘1 cm。预置腹腔镜下全肝血流阻断带,离断预切除肝脏周围的韧带。超声刀离断肝实质,钛夹或者hem-o-lok夹闭直径>3 mm的管道,单极、双极电凝处理肝断面,必要时血管缝线缝扎止血,如涉及较大肝蒂或肝静脉则使用腔内直线切割闭合器。切除后检查标本确认肿瘤完整切除后患者继续接受治疗直到复查正常后出院。
2.随访:以治疗时间为0点,术后每3个月随访1次,内容包括增强CT检查、肝功能、甲胎蛋白(AFP)、相关病毒定量、胸片及临床评估。当肝内复发难以鉴定时增加超声造影或磁共振肝肿瘤特异性检测。怀疑肝外转移时,将进行进一步全身检查。一旦确认复发或转移,将由主管医生、病理科医生和影像学医生根据患者的临床表现和实际情况提出建议,予以肝切除术、再次LH或射频消融、肝动脉化疗栓塞等,最终治疗由患者作出决定。所有检查和治疗均在我院完成。随访时间截至2016年12月31日。
三、统计学处理
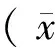
结 果
1.围手术期结果:102例患者中4例(Ⅴ段1例,Ⅲ段、Ⅵ段各1个病灶1例、Ⅷ段1例, Ⅴ段、Ⅷ段肝蒂之间1例)因肿瘤位置特殊、肝硬化程度重而中转开腹行传统肝切除术,总体中转开腹发生率为 3.9%。9例患者因肿瘤紧贴肝蒂或两个病灶位于不同肝段行半肝切除(左半肝7例,右半肝2例)。39例患者行解剖性肝段切除,63例患者行肿瘤局部切除。按肿瘤切除部位划分肝前下段组70例,肝后上段组23例。术后病理检查均显示肿瘤包膜完整且切缘为阴性无肿瘤残留,其中高分化11例,中度分化82例,低分化9例。术后总体不良事件如下:肝功能不全1例,顽固性腹水3例,胸腔积液16例,肺部感染5例,肝断面积液并感染2例,术后出血3例,总体并发症发生率为29.4%。右侧胸腔积液是最常见的术后并发症,其中7例患者经保守治疗无效后行胸腔穿刺引流术后治愈;1例患者右半肝切除术后出现肝功能不全,经保守治疗无效再次行肝移植术治愈;3例顽固性腹水患者经补充血浆白蛋白、利尿及腹腔穿刺引流术后治愈,3例患者出现术后出血,予以保守治疗后治愈。住院期间均无死亡病例。
总体手术时间为(189.6±76.9)分钟,术中失血量(284.6±278.6)ml,术中输血率为3.9%(4/102),全肠外营养使用率为6.9%,住院时间(16.1±5.5)天。亚组分析中,肝前下段组并发症发生率为13.0%(3/23),肝后上段组并发症发生率为21.3%(5/23),两组比较差异无统计学意义(P>0.05);两组手术时间、术中失血量、术中输血率、全肠外营养使用率、住院时间分别为(189.7±76.0)、(198.2±69.9)分钟,(279.1±209.8)、(243.9±162.2)ml,4.3%、 0,4.3%、8.7%,(14.8±3.0)天、(19.1±8.9)天,差异均无统计学意义(P>0.05)。
2.随访结果:随访时间34.5~63.0个月,中位随访时间44.5个月。46例患者随访期内出现复发,其中43例出现肝内复发,2例患者出现肝外脏器转移(骨转移和腹壁转移),无肝内转移病灶,1例患者出现肝外脏器的转移(腹腔多发转移)同时合并肝内转移。死亡33例,其中肝癌复发和肝外转移死亡32例,术后2年死于心肌梗塞1例。1年、3年总体生存率为95.3%、82.6%,相应的总体无瘤生存率为80.4%、58.2%。肝前下段组和肝后上段组1年、3年生存率和无瘤生存率比较,差异均无统计学意义(P>0.05)。
讨 论
原发性肝癌是全球最常见的恶性肿瘤之一,其发病原因主要与乙肝病毒感染和肝硬化相关[5-6]。对于小肝癌的治疗国际上尚无统一标准,由于入选标准和技术的差异,其治疗方式仍有争议,国际上得到普遍认可的是巴塞罗那临床肝癌系统[7-8],主张对于0期和A1期的患者使用肝切除术,而对于A2-A4期行肝移植术、无水酒精注射术和射频消融术。对于A2-A4期使用射频消融术或者无水酒精注射术代替肝切除术的基本原理是减少围手术期死亡率和保护肝硬化患者的肝功能。有效的抗病毒治疗已成为可能[9],手术创伤导致肝功能衰竭死亡的肝硬化并发症已大幅下降。肝切除术对肿瘤的大小、数目或大血管侵犯没有限制,使其具有更广泛地适用性。LH是我国目前小肝癌治疗最有效、最具可行性的治疗手段之一[10]。
肝切除的手术方式有传统开腹手术和腹腔镜肝癌切除术。LH相对于传统开腹手术,创伤小,恢复快,并发症发生率低[11],与射频消融术比较,具有更长的无瘤生存时间[12]。亚组分析中经过配对研究,对比分析前下段组和后上段组并发症发生率、手术时间、术中失血量、术中输血率、全肠外营养使用率、住院时间、术后1、3年生存率和相应无瘤生存率的差异,均无统计学意义。相对于解剖更困难的后上段,腹腔镜肝切除术同样安全有效。
腹腔镜肝切除术是在传统肝切除术基础上发展而来,已由当初的仅适用于左肝外叶或部分肝段表浅组织的不规则切除,拓展应用于更为复杂、疑难的解剖性肝段切除。主要体现在穿刺孔的建立布局、入肝血流的阻断以及腔镜下缝合技术。
穿刺孔的建立需要个体化设计[13]。在此过程中一般需要5个穿刺孔,其中包括1个10 mm镜孔、2个12 mm主操作孔和2个5 mm辅助孔。镜孔应遵循充分暴露切缘和不妨碍操作者的原则,例如左半肝手术选择肚脐左侧,对于特殊肝段如Ⅳa、Ⅶ、Ⅷ段或需要解剖第二肝门的应向头侧调整,2个12 mm主操作孔根据术者和助手习惯位于镜孔两侧,5 mm辅助孔位于最远端,其设置的基本要点是沿预切除区域呈扇形展开。在实际操作中随着肿瘤部位、手术入路、技术积累和操作习惯等因素影响,穿刺孔的数量可能有所增减,位置也会互相替换或改变,如进行头侧入路解剖第二肝门时,会选择剑突下作为主操作孔以方便缝合和器械的进出。同时我们时常会再设置一个5 mm的穿刺孔,用于预置肝门阻断带控制入肝血流。腹腔镜手术的微创性,还应考虑穿刺孔用于术后放置引流管或者互相连接扩大作为出标本口,使其更加美观。
由于复杂的结构及丰富的血液供应,失血量的控制成为肝切除术中的严重问题[14]。Pringle手法简单、安全。在腹腔镜手术中,有学者根据其特点改进了这一经典的手法[15],具体为分离出第一肝门后放置肝门阻断带,并于另外的5 mm穿刺孔中引出备用,当需要阻断肝门时收紧阻断带以控制入肝血流,阻断时间同常规开腹手术。腹腔镜下Pringle手法的广泛应用,使其突破了关键的技术瓶颈,操作者可以进行复杂肝部分的切除,手术方式由前下段切除向后上段突破,甚至进行解剖性肝段切除。
随着技术的进步,超声刀、超声吸引装置、多功能手术解剖器、微波刀、射频辅助肝切除等器械的应用使得肝脏解剖更加精细化,而单双极电凝、连发钛夹、Hem-o-lock、生物夹、腔内切割闭合器等简化了肝脏内管道的处理,减少了出血。由于肝脏特殊的解剖结构,在切除的过程中仍不可避免会遇到出血不止的情况,因此,对于管道特别是血管的缝扎和修补十分重要。腹腔镜的特殊环境要求操作者改变传统的缝合方式,由于腹腔镜器械较长、Trocar孔固定使得腔镜下的穿刺与打结不如开腹状态下流畅,同时由于显微视野下需要在一些相对狭小的空间或者特殊角度缝合更增加了腔镜环境下缝合技术的难度。在腔镜开展的初期,大部分中转开腹的原因均是由于无法控制的出血,缝合技术在其中具有关键作用。
[1] Katz SC,Shia J,Liau KH,et al.Operative blood loss independently predicts recurrence and survival after resection of hepatocellular carcinoma[J].Ann Surg,2009,249(4):617-623.
[2] Ishizawa T,Gumbs AA,Kokudo N,et al.Laparoscopic segmentectomy of the liver:from segment I to VIII[J].Ann Surg,2012,256(6):959-964.
[3] Cheung TT,Poon RT,Yuen WK,et al.Long-term survival analysis of pure laparoscopic versus open hepatectomy for hepatocellular carcinoma in patients with cirrhosis:a single-center experience[J].Ann Surg,2013,257(3):506-511.
[4] Buell JF,Cherqui D,Geller DA,et al.The international position on laparoscopic liver surgery:The Louisville Statement,2008[J].Ann Surg,2009,250(5):825-830.
[5] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[6] Wang X,Lin SX,Tao J,et al.Study of liver cirrhosis over ten consecutive years in Southern China[J].World J Gastroenterol,2014,20(37):13546-13555.
[7] Huang J,Yan L,Cheng Z,et al.A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria[J].Ann Surg,2010,252(6):903-912.
[8] Bruix J,Sherman M.American Association for the Study of Liver D.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020-1022.
[9] Papatheodoridis GV,Chan HL,Hansen BE,et al.Risk of hepatocellular carcinoma in chronic hepatitis B: assessment and modification with current antiviral therapy[J].J Hepatol,2015,62(4):956-967.
[10]吴孟超.肝癌外科治疗的近期进展[J].中国普外基础与临床杂志,2006,13(2):125-128.
[11]Nguyen KT,Marsh JW,Tsung A,et al.Comparative benefits of laparoscopic vs open hepatic resection:a critical appraisal[J].Arch Surg,2011,146(3):348-356.
[12]Song J,Wang Y,Ma K,et al.Laparoscopic hepatectomy versus radiofrequency ablation for minimally invasive treatment of single,small hepatocellular carcinomas[J].Surg Endosc,2016,30(10):4249-4257.
[13]Martin RC,Scoggins CR,McMasters KM.Laparoscopic hepatic lobectomy:advantages of a minimally invasive approach[J].J Am Coll Surg,2010,210(5):627-634,634-636.
[14]Couinaud C.[Liver lobes and segments:notes on the anatomical architecture and surgery of the liver ][J].Presse Med,1954,62(33):709-712.
[15]Rotellar F,Pardo F,Bueno A,et al.Extracorporeal tourniquet method for intermittent hepatic pedicle clamping during laparoscopic liver surgery:an easy,cheap,and effective technique[J].Langenbecks Arch Surg,2012,397(3):481-485.
(本文编辑:杨泽平)
Clinical analysis of laparoscopic hepatectomy for small hepatocellular carcinoma
SONGJuxian,CHENJian,LIJianwei,etal.
(DepartmentofHepatobiliarySurgery,theforty-fourthHospitalofPLA,Guiyang550000,China)
Objective To evaluate the clinical effect of laparoscopic hepatectomy for small hepatocellular carcinoma.Methods We retrospectively analyzed the medical records of 102 patients undergoing laparoscopic hepatectomy for small hepatocellular carcinoma from January 1,2007 to December 31,2013 at the Southwest Hospital Affiliated to the Third Military Medical University.Results Four patients were converted to laparotomy,and the rate of conversion to laparotomy was 3.9%.The overall complication rate was 29.4%.The total operative time was(189.6±76.9)min,intraoperative blood loss(284.6±278.6)ml,intraoperative blood transfusion rate was 3.9%(4/102),total parenteral nutrition utilization rate was 6.9%(7/102)d and hospital stay was(16.1±5.5)d.The median follow-up time was 44.5 months,1-,and 3-year overall survival rate were 95.3% and 82.6%.The corresponding overall disease-free survival rate:80.4%,58.2%.In the subgroup analysis,there was no statistically significant difference between the anterolateral liver segment group(Ⅱ,Ⅲ,Ⅳb,Ⅴ,and Ⅵ)and the posterosuperior liver segment group(Ⅰ,Ⅳa,Ⅶ,and Ⅷ)in the perioperative data and follow-up results(P>0.05).Conclusion
Laparoscopic hepatectomy had the advantages of small trauma,quick recovery and low incidence of complications.Laparoscopic hepatectomy had the same short-term and long-term effects in the anterolateral liver segment and posterosuperior liver segment resection.
laparoscopic hepatectomy; small hepatocellular carcinoma; minimally invasive treatment
10.3969/j.issn.1005-6483.2017.03.005
550000 贵阳,解放军第44医院肝胆外科(宋举贤); 第三军医大学西南医院全军肝胆外科研究所(陈健、李建伟、范毓东、王小军、 郑树国)
郑树国,Emai:Shuguozh@163.com
2017-02-25)
