VDUP1对乳腺癌细胞MCF-7增殖及迁移的影响
2017-06-24李建华徐利强倪修文孙亚云毛惠娜吴瑾惠
李建华, 徐利强, 倪修文, 孙亚云, 毛惠娜, 吴瑾惠
(嘉兴市中心血站, 浙江 嘉兴 314000 )
VDUP1对乳腺癌细胞MCF-7增殖及迁移的影响
李建华, 徐利强, 倪修文△, 孙亚云, 毛惠娜, 吴瑾惠
(嘉兴市中心血站, 浙江 嘉兴 314000 )
目的: 探讨过表达/沉默维生素D3上调蛋白1(vitamin D3 up-regulated protein 1,VDUP1)基因对人乳腺癌细胞系MCF-7增殖和迁移能力的影响及相关作用机制。 方法: 通过基因过表达/干扰技术上调/下调乳腺癌细胞系MCF-7中VDUP1基因的表达;实时荧光定量PCR检测细胞中VDUP1的mRNA表达水平;CCK-8法、BrdU实验和Transwell细胞迁移实验分别用于检测细胞增殖和迁移能力;Western blot检测细胞中Akt、p-Akt、GSK3β和p-GSK3β的蛋白水平。 结果: 基因过表达/干扰技术可上调/下调乳腺癌细胞系MCF-7中VDUP1基因的表达;过表达VDUP1基因后,MCF-7的细胞活力、DNA合成和细胞迁移能力显著降低(P<0.05),而沉默VDUP1基因后,MCF-7的细胞活力、DNA合成和细胞迁移能力则显著升高(P<0.05)。此外,过表达VDUP1基因可下调p-Akt和p-GSK3β的蛋白水平(P<0.05),而沉默VDUP1基因的结果则相反。 结论: 改变VDUP1基因表达水平可影响MCF-7细胞的增殖和迁移能力,其作用机制可能与Akt/GSK3β信号通路有关。
维生素D3上调蛋白1; MCF-7细胞; 细胞增殖; 细胞迁移; Akt/GSK3β信号通路
乳腺癌的发生发展是一个多基因参与,多阶段的复杂演化过程,其中涉及到多种原癌基因及抑癌基因等的异常表达[1-3];深入探讨其中涉及的基因功能,不仅有助于深化对乳腺癌发病机制的认识,且有助于筛选乳腺癌诊疗的新靶点。
维生素D3上调蛋白1(vitamin D3 upregulated protein 1,VDUP1)基因,即硫氧还蛋白(thioredoxin,TRX)结合基因,位于人染色体1q21上[4]。已有大量文献报道VDUP1作为一种抑癌基因,在包括肝癌[4]、乳腺癌[5]等多种肿瘤中表达异常。研究表明,VDUP1是维持细胞内部微环境稳定的一种多功能蛋白,作为TRX的内源性抑制剂,VDUP1可通过抑制TRX的活性广泛参与调控细胞的增殖、凋亡及分化等病理生理过程[6-8]。然而有关VDUP1对乳腺癌细胞的具体作用研究甚少。本实验采用基因过表达/干扰技术上调/下调乳腺癌细胞系MCF-7中VDUP1基因的表达,而后通过CCK-8法、BrdU实验和Transwell细胞迁移实验检测MCF-7细胞的增殖及迁移能力的变化,初步探讨VDUP1基因对MCF-7细胞相关生物学功能的影响,此外采用Western blot检测相关蛋白表达的变化,进一步讨论VDUP1基因调控MCF-7细胞的相关机制。
材 料 和 方 法
1 材料
人乳腺癌细胞系MCF-7(中科院细胞库);VDUP1过表达质粒及对照质粒(Gene Copoeia);VDUP1 siRNA及阴性对照siRNA(上海吉玛制药技术有限公司);胰蛋白酶和CCK-8试剂(Sigma);BrdU细胞增殖分析试剂盒(Chemicon);DMEM培养基及Opti-MEM培养基(Gibco);Transwell小室(Corning);Lipofectamine 2000及相关转染试剂(Invitrogen);抗Akt、糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、p-Akt、p-GSK3β抗体和HRP标记的抗兔 II 抗(Santa Cruz)。
2 方法
2.1 细胞培养 人乳腺癌细胞系MCF-7常规贴壁培养于含10%胎牛血清的DMEM培养基中,培养条件为5% CO2、37 ℃恒温培养箱;待细胞生长至培养瓶的约80%时,胰蛋白酶常规进行消化,传代。
2.2 细胞转染 取对数生长期的细胞接种于6孔板中(密度为2×108/L),待细胞生长融合至60%~80%,换无血清的培养基同步化12 h,随后进行转染。组别设置为空白对照(control)组、阴性对照(negative control siRNA,Neg)组、VDUP1 siRNA干扰组(siRNA组)、空质粒(vector,Vec)组和VDUP1过表达组(VDUP1组)。将质粒溶解于Opti-MEM培养基中孵育5 min,同时另取Lipofectamine 2000溶入Opti-MEM培养基中孵育5 min;而后将两者轻柔混合,室温静置20 min。然后将混合物加入各组细胞中,置于培养箱中培养6 h后,更换为正常细胞培养基继续培养48 h。提取细胞蛋白测定转染效率并进行后续实验分析。
2.3 CCK-8法和BrdU法检测各组细胞的增殖水平 接种细胞于96孔板中(每孔2×103个),处理后加培养基继续培养22 h,随后向每孔加入10 μL CCK-8试剂,置于37 ℃、5% CO2恒温培养箱中继续培养2 h。于450 nm波长处检测各孔吸光度(A)值,每组设3个复孔。另设单孔只加入培养基不加入MCF-7细胞作为空白对照,计算各组细胞的细胞活力。另接种细胞至96孔板中(每孔1×103个),处理后加培养基继续培养24 h,随后加入BrdU,共培养24 h。培养结束后倒出培养液,加入100 μL固定液,室温孵育30 min,洗板3次。5% FBS封闭30 min。加入甲酰胺100 ℃下变性5 min,冷却洗涤后加入抗小鼠BrdU单抗,阴性对照组加PBS。苏木素衬染,显微镜下计数,重复实验6次。
2.4 实时荧光定量PCR(qPCR)检测转染细胞中VDUP1的mRNA表达 收集各组细胞,总RNA的提取按照Trizol说明书进行,所提RNA经紫外分光光度法测定A260值,并进行定量。建立反转录反应。VDUP1的上游引物为5’-ACTCGTGTCAAAGCCGTTAGGA-3’,下游引物为5’-AGCTCAAAGCCGAACTTGTACTCA-3’; GAPDH为内参照,其上游引物为5’-CTCTGCTCCTCCTGTTCGAC-3’,下游引物为5’-GCGCCCAATACGACCAAATC-3’。PCR扩增条件为:90 ℃ 10 s; 92 ℃ 15 s, 60 ℃ 15 s, 74 ℃ 15 s, 40个循环。反应结束后,标准曲线和扩增曲线由PCR仪器自动生成,所得结果直接在荧光定量操作系统中进行比较分析,目标基因的相对定量用2-ΔΔCt法计算。
2.5 Transwell细胞迁移实验 胰酶消化收集各组细胞后,用培养基重悬细胞后将细胞接种于Transwell小室的上室中(密度2×108/L),同时在Transwell小室的下室内加入常规培养基,置于37 ℃、5% CO2培养箱中继续培养24 h。取出后,弃去上室培养液,用5%戊二醛4 ℃固定15 min;PBS冲洗3次,并用棉签擦除上室表面的细胞,然后加0.1%结晶紫染色,PBS漂洗后置于倒置显微镜下观察并拍照,计数染色细胞的个数(每组细胞计数5个视野取均值)。
2.6 Western blot检测相关蛋白的表达 离心收集各组经相应处理的细胞,提取总蛋白并用BCA试剂盒测定蛋白浓度进行定量,每道加入80 μg蛋白进行SDS-PAGE,待蓝色loading buffer泳出后,将蛋白电转至PVDF膜上,用含5% 脱脂牛奶的PBS缓冲液封闭90 min,加入相应比例的 I 抗,4 ℃孵育过夜;复温后再加入相应 II 抗,室温孵育2 h,化学发光法显影,定影并冲洗胶片。所得结果经ImageJ软件行蛋白半定量灰度分析。
3 统计学处理
所有数据采用SPSS 15.0统计软件进行统计分析。实验数据采用均数±标准差(mean±SD)表示,组间采用单因素方差分析(one-way ANOVA),各组均数间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 qPCR检测VDUP1的mRNA表达水平
各组细胞经转染后,采用qPCR检测VDUP1的mRNA表达水平。结果显示,与control组相比,VDUP1组中VDUP1的表达明显升高,而siRNA组中VDUP1的 mRNA表达显著降低,提示细胞转染成功,见图1。
2 过表达/沉默VDUP1基因后MCF-7细胞增殖能力的变化
过表达/沉默VDUP1基因后,采用CCK-8法检测细胞活力变化。结果表明,与control 组相比,过表达VDUP1基因后,MCF-7细胞的活力显著降低;而沉默VDUP1基因后,MCF-7细胞的活力显著升高。BrdU实验结果表明,过表达VDUP1基因后,MCF-7细胞的DNA合成显著低于对照组;而沉默VDUP1基因后,MCF-7细胞的DNA合成显著高于对照组,见图2。

Figure 1.The mRNA expression levels of VDUP1 in the MCF-7 cells after transfected with plamid/siRNA. Mean±SD.n=6.*P<0.05vscontrol group.
图1 MAF-7细胞中转染质粒/siRNA后VDUP1的 mRNA表达水平
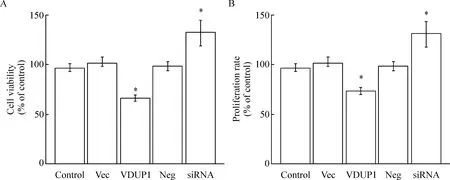
Figure 2.The effects ofVDUP1 over-expression/knockdown on the proliferation of the MCF-7 cells. A: the cell viability was detected by CCK-8 assay; B: the cell proliferation was determined by BrdU assay. Mean±SD.n=3.*P<0.05vscontrol group.
图2 过表达/沉默VDUP1基因对MCF-7细胞增殖的影响
3 过表达/沉默VDUP1基因后MCF-7细胞的迁移能力变化
过表达/沉默VDUP1基因后,Transwell迁移实验检测MCF-7细胞迁移能力的变化。过表达VDUP1基因可显著降低MCF-7细胞的迁移能力,而沉默VDUP1基因则显著增加其迁移能力,见图3。
4 过表达/沉默VDUP1基因后MCF-7细胞中Akt/GSK3β信号通路活性的变化
过表达/沉默VDUP1基因后,Western blot法检测细胞中Akt/GSK3β信号通路活性的变化。结果显示:与control组相比,过表达VDUP1基因后,MCF-7细胞中p-Akt和p-GSK3β的蛋白水平显著降低;而沉默VDUP1基因后,p-Akt和p-GSK3β的蛋白表达水平则显著增加,见图4。

Figure 3.The effects ofVDUP1 over-expression/knockdown on the migration ability of the MCF-7 cells. Mean±SD.n=6.*P<0.05vscontrol group.
图3 过表达/沉默VDUP1基因对MCF-7细胞迁移能力的影响
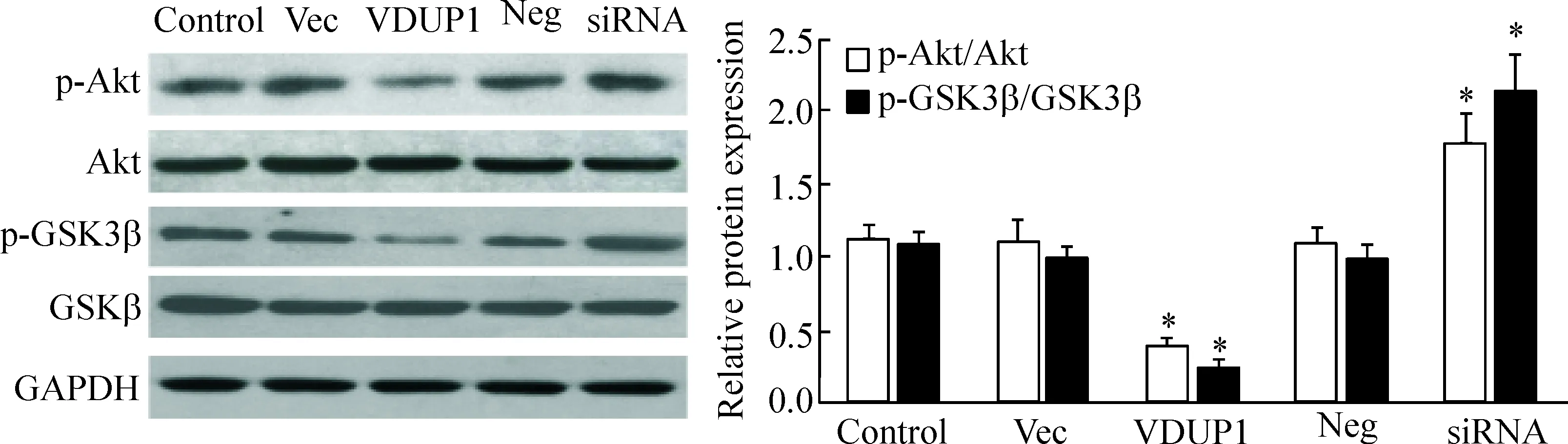
Figure 4.The effects ofVDUP1 over-expression/knockdown on the protein levels of p-Akt and p-GSK3β in the MCF-7 cells. Mean±SD.n=6.*P<0.05vscontrol group.
图4 过表达/沉默VDUP1基因对MCF-7细胞中p-Akt和p-GSK3β蛋白水平的影响
讨 论
关于VDUP1基因在肿瘤中的作用,早期的研究显示其是一种抑癌基因;随着研究的深入,研究者们发现VDUP1是TRX的内源性抑制剂,不仅广泛参与调控细胞的增殖、凋亡及分化等病理生理过程,还具有免疫调节作用,并参与炎症反应及体内抗氧化应激反应[9-11]。本研究在分子水平上,通过构建过表达/沉默VDUP1基因的人乳腺癌MCF-7细胞探讨VDUP1基因对MCF-7细胞增殖及迁移的作用。结果发现,当过表达VDUP1基因时,MCF-7细胞的增殖与迁移能力显著降低,而当沉默VDUP1基因后,MCF-7细胞的增殖与迁移能力则显著增加,提示VDUP1基因可能与乳腺癌的发生发展有着密切的关系。
关于VDUP1调控细胞病理生理过程的作用机制,大量研究表明,VDUP1是一种细胞内信号分子,其作用主要是通过TRX来发挥的;VDUP1可与TRX活性区的2个半胱氨酸残基相结合,抑制TRX的活性[12-13]。TRX是一种强力抗氧化剂,可通过抑制细胞凋亡信号ASK1-JNK/p38 MAPK信号通路调控细胞凋亡[14];且抑制TRX-1还可促进Akt/GSK3β的活化,进而发挥心肌保护效应[15]。此外也有研究提示,VDUP1可通过抑制Akt的磷酸化调控人晶状体上皮细胞的自噬[16]。Akt/GSK3β通路广泛存在于细胞中,通过其磷酸化调控下游细胞增殖、凋亡及代谢等相关蛋白的表达,进而促进肿瘤细胞的增殖、加快细胞周期进程、调控肿瘤细胞耐药性的发生[17-19]。本实验结果显示过表达VDUP1后,MCF-7细胞中p-Akt和p-GSK3β的蛋白表达显著降低,而沉默VDUP1则p-Akt和p-GSK3β的蛋白表达显著增加,提示VDUP1基因调控MCF-7细胞增殖及迁移可能与Akt/GSK3β信号通路有关,但是VDUP1与Akt/GSK3β信号通路之间的具体关系还有待进一步深入的研究。
综上所述,本研究在分子水平上,通过构建过表达/沉默VDUP1基因的人乳腺癌MCF-7细胞探讨VDUP1的功能。结果发现,过表达VDUP1基因可抑制MCF-7细胞的增殖和迁移能力,沉默VDUP1基因则促进MCF-7细胞的增殖和迁移能力,其作用机制可能与Akt/GSK3β信号通路有关。这提示,VDUP1基因可能与乳腺癌的发生发展有着密切的关系,有望成为乳腺癌诊疗的新靶点。
[1] Bychkovsky BL, Lin NU. Imaging in the evaluation and follow-up of early and advanced breast cancer: When, why, and how often?[J]. Breast, 2017, 31:318-324.
[2] Kleibl Z, Kristensen VN. Women at high risk of breast cancer: Molecular characteristics, clinical presentation and management[J]. Breast, 2016, 28:136-144.
[3] Luen S, Virassamy B, Savas P, et al. The genomic landscape of breast cancer and its interaction with host immunity[J].Breast, 2016, 29:241-250.
[4] Kwon HJ, Won YS, Suh HW, et al. Vitamin D3 upregulated protein 1 suppresses TNF-α-induced NF-κB activation in hepatocarcinogenesis[J]. J Immunol, 2010, 185(7):3980-3989.
[5] Solanas M, Moral R, Garcia G, et al. Differential expression of H19 and vitamin D3 upregulated protein 1 as a mechanism of the modulatory effects of high virgin olive oil and high corn oil diets on experimental mammary tumours[J]. Eur J Cancer Prev, 2009, 18(2):153-161.
[6] Lu J, Holmgren A. The thioredoxin antioxidant system[J]. Free Radic Biol Med, 2014, 66:75-87.
[7] Huang W, Nie W, Zhang W, et al. The expression status of TRX, AR, and cyclin D1 correlates with clinicopathological characteristics and ER status in breast cancer[J]. Onco Targets Ther, 2016, 9:4377-4385.
[8] Kim SY, Suh HW, Chung JW, et al. Diverse functions of VDUP1 in cell proliferation, differentiation, and diseases[J]. Cell Mol Immunol, 2007, 4(5):345-351.
[9] Cai Z, Liu J, Bian H, et al. Astragaloside IV ameliorates necrotizing enterocolitis by attenuating oxidative stress and suppressing inflammation via the vitamin D3-upregulated protein 1/NF-κB signaling pathway[J]. Exp Ther Med, 2016, 12(4):2702-2708.
[10]蔡绍曦, 高 枫, 丁彦青, 等. 维生素D3上调蛋白1在哮喘嗜酸粒细胞中的表达及其与细胞活化的关系[J]. 中国病理生理杂志, 2007, 23(6):1120-1124.
[11]Kwon HJ, Hong SK, Yoon WK, et al. Vitamin D3 up-regulated protein 1 controls the priming phase of liver regeneration[J]. J Vet Sci, 2013, 14(3):257-262.
[12]Spindel ON, World C, Berk BC. Thioredoxin interacting protein: redox dependent and independent regulatory mechanisms[J]. Antioxid Redox Signal, 2012, 16(6):587-596.
[13]Chen Z, Lopez-Ramos DA, Yoshihara E, et al. Thioredoxin-binding protein-2 (TBP-2/VDUP1/TXNIP) regulates T-cell sensitivity to glucocorticoid during HTLV-I-induced transformation[J]. Leukemia, 2011, 25(3):440-448.
[14]Jin R, Gao Y, Zhang S, et al. Trx1/TrxR1 system regulates post-selected DP thymocytes survival by modulating ASK1-JNK/p38 MAPK activities[J]. Immunol Cell Biol, 2015, 93(8):744-752.
[15]Perez V, D Annunzio V, Mazo T, et al. Ischemic postconditioning confers cardioprotection and prevents reduction of Trx-1 in young mice, but not in middle-aged and old mice[J]. Mol Cell Biochem, 2016, 415(1-2):67-76.
[16]Zhou J, Yao K, Zhang Y, et al. Thioredoxin binding protein-2 regulates autophagy of human lens epithelial cells under oxidative stress via inhibition of Akt phosphorylation[J]. Oxid Med Cell Longev, 2016, 2016:4856431.
[17]徐立群, 张荣华, 邹 莹, 等. 参慈胶囊联合顺铂通过PI3K/AKT/mTOR信号通路逆转人肺腺癌顺铂耐药的机制研究[J]. 中国病理生理杂志, 2017, 33(3): 500-504.
[18]Shen H, Li L, Yang S, et al. MicroRNA-29a contributes to drug-resistance of breast cancer cells to adriamycin through PTEN/AKT/GSK3β signaling pathway[J]. Gene, 2016, 593(1):84-90.
[19]Su YJ, Lin WH, Chang YW, et al. Polarized cell migration induces cancer type-specific CD133/integrin/Src/Akt/GSK3β/β-catenin signaling required for maintenance of cancer stem cell properties[J]. Oncotarget, 2015, 6(35):38029-38045.
(责任编辑: 卢 萍, 罗 森)
Effects of VDUP1 on proliferation and migration of human breast cancer MCF-7 cells
LI Jian-hua, XU Li-qiang, NI Xiu-wen, SUN Ya-yun, MAO Hui-na, WU Jin-hui
(JiaxingBloodCenter,Jiaxing314000,China.E-mail:nixiuwen322904@163.com)
AIM: To investigate the effect of vitamin D3 up-regulated protein 1 (VDUP1) gene over-expression/knockdown on the proliferation and migration of human breast cancer MCF-7 cells and its related mechanisms.METHODS: Gene over-expression/interference techniques were used to up-regulate/down-regulate the expression of VDUP1 in the MCF-7 cells. The mRNA expression of VDUP1 was detected by qPCR. CCK-8, BrdU and Transwell assays were used to measure the cell viability, proliferation and migration, respectively. The protein levels of Akt, p-Akt, GSK3β and p-GSK3β were determined by Western blot.RESULTS: The mRNA expression of VDUP1 was up-regulated after transfection withVDUP1 over-expression plasmid (P<0.05), and down-regulated after transfection withVDUP1 siRNA (P<0.05). Over-expression ofVDUP1 significantly inhibited MCF-7 cell proliferation and migration (P<0.05), while knockdown ofVDUP1 enhanced cell proliferation and migration (P<0.05). Furthermore, over-expression ofVDUP1 up-regulated the protein levels of p-Akt and p-GSK3β (P<0.05). Inverse results were obtained after knockdown ofVDUP1. CONCLUSION: The viability and migration ability of MCF-7 cells are inhibited by over-expression ofVDUP1 but enhanced byVDUP1 knockdown, which may be related with Akt/GSK3β pathway.
Vitamin D3 up-regulated protein 1; MCF-7 cells; Cell proliferation; Cell migration; Akt/GSK3β pathway
1000- 4718(2017)06- 1060- 05
2017- 04- 01
2017- 04- 24
R730.23
A
10.3969/j.issn.1000- 4718.2017.06.017
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0573-83386959; E-mail: nixiuwen322904@163.com
