6-羟多巴损伤黑质导致弓状核离子钙接头蛋白1和阿片-促黑素皮质素原表达的变化*
2017-06-24张毅敏宋海岩蔡君艳王志勇
张毅敏, 连 辉, 宋海岩, 周 立, 蔡君艳, 王志勇△
(1 新乡医学院河南省医用组织再生重点实验室, 河南 新乡 453003; 2东南大学附属中大医院, 江苏 南京 210009)
6-羟多巴损伤黑质导致弓状核离子钙接头蛋白1和阿片-促黑素皮质素原表达的变化*
张毅敏1, 连 辉1, 宋海岩1, 周 立1, 蔡君艳2, 王志勇1△
(1新乡医学院河南省医用组织再生重点实验室, 河南 新乡 453003;2东南大学附属中大医院, 江苏 南京 210009)
目的: 观察6-羟多巴(6-OHDA)损伤大鼠黑质(SN)后下丘脑弓状核(Arc)中酪氨酸羟化酶(TH)、离子钙接头蛋白1(Iba1)和阿片-促黑素皮质素原(POMC)的表达变化,为帕金森病(PD)患者消瘦的发生机制提供线索。方法: 20只SD大鼠随机分为6-OHDA大鼠组(双侧SN内注射6-OHDA)和对照组(注射等体积生理盐水)。免疫荧光染色和Western blot检测SN内TH,以及Arc内TH、Iba1和POMC的表达。结果: 与对照组比较,6-OHDA大鼠组体重无明显变化,但腹膜后脂肪重量从(7.550±0.670) g减少到(3.895±0.465) g (P<0.01)。SN内TH阳性细胞数量从56±5减少至14±2 (P<0.05);蛋白表达水平从0.75±0.11降低至0.41±0.09 (P<0.01)。Arc中TH阳性细胞数量从21±2减少到10±3 (P<0.05);Iba1阳性细胞数量从12±2增加到30±5 (P<0.05);POMC阳性细胞数量从16±4增加到31±2 (P<0.05)。下丘脑内TH蛋白的表达水平从0.35±0.05降低到0.21±0.02 (P<0.01);Iba1蛋白的表达水平从0.23±0.06增加至0.51±0.04 (P<0.01);POMC的蛋白表达水平从0.37±0.05 增加至0.65±0.03 (P<0.01)。结论: Arc中TH、Iba1和POMC表达变化可能与PD脂肪减少存在一定的联系。
6-羟多巴; 弓状核; 酪氨酸羟化酶; 离子钙接头蛋白1; 阿片-促黑素皮质素原
帕金森病(Parkinson’s disease,PD)是一种以黑质(substantia nigra,SN)中多巴胺能神经元损伤为特征的神经退行性疾病[1-2],体重减轻是PD病人常见的非运动功能障碍之一,PD病人体重减轻原因为体脂的减少[3]。弓状核(arcuate nucleus,Arc)是间脑内调控能量代谢的重要神经核团,也是接受外周调节代谢相关激素浓度变化信号的第一级感受神经核团[4]。Arc中,阿片-促黑素皮质素原(pro-opiomelanocortin,POMC)广泛分布,是调控外周脂肪分解、产热以及摄食的重要递质。研究证明,Arc的POMC能神经元受到多巴胺的直接调控,这一调控作用通过多巴胺受体(dopamine receptor,DR)实现[5]。同时,中枢免疫系统也参与了调节机体能量代谢,最近的研究发现,肥胖小鼠模型中,小胶质细胞损伤并吞噬Arc的POMC能神经元,是小鼠模型肥胖发生的机制之一[6-7]。本研究的目的是利用6-羟多巴(6-hydroxydopamine,6-OHDA)损伤大鼠双侧黑质的PD模型,观察Arc中酪氨酸羟化酶(tyrosine hydroxylase,TH)、POMC以及胶质细胞标志蛋白离子钙接头蛋白1(ionized calcium binding adapter molecule 1,Iba1)的变化,以期为PD病人消瘦发生机制提供线索。
材 料 和 方 法
1 实验动物及分组
成年健康SD品系雌性大鼠20只,体重220~250 g(新乡医学院实验动物中心提供)。大鼠每笼4只喂养,室温24 ℃,湿度45%。3 d后根据随机数字表分为对照组与6-OHDA组(n=10),6-OHDA组大鼠分别在双侧SN内注射2 μL 6-OHDA,其中5只做免疫荧光染色,5只做Western blot检测。
2 方法
2.1 6-OHDA大鼠模型的制备和鉴定 大鼠用10%水合氯醛腹腔注射麻醉后,固定于脑立体定位仪上,剪去头皮上部毛发,在常规消毒下,于头颅正中切开头皮和皮下组织,确定前囟坐标,参照大鼠脑立体定位图谱,确定两侧SN坐标:前囟尾侧4.4 mm,矢状缝两侧1.2 mm,硬膜下7.8 mm。进行标记定位后,牙科钻在相应部位钻透颅骨,勿损伤硬脑膜。用10 μL Hamilton微量进样器吸取6-OHDA 4 μL (4 g/L),每孔2 μL,缓慢进针至预定深度,1 μL/min 注入,注射完毕留针5 min后,1 mm/min缓慢退出,缝合皮肤。对照组大鼠用同样的方法在两侧SN给予等体积的生理盐水。术后前3 d每只大鼠腹腔注射青霉素钠2.0×105U,以预防感染。术后6周2组大鼠分别以转棒实验进行行为学检测。
两组大鼠在术后的第1个月每天称量体重,之后每周称量1次。6-OHDA注射双侧黑质6 周后,称量两组的摄食量。每只大鼠都饲养在一个独立的、干净的鼠笼中观察24 h,并记录摄食量。
2.2 SN和Arc的Nissl染色 6 周后,分别取2组大鼠各5只,依次用10%水合氯醛腹腔注射麻醉,4%多聚甲醛灌流固定,取大脑,在同种固定液中后固定24 h,然后依次用15%和30%的蔗糖溶液梯度脱水48 h,-80 ℃冰箱中放置30 min后,根据大鼠脑图谱确定SN和Arc的位置,做冰冻连续冠状切片,片厚20 μm。切片入蒸馏水洗涤2 min,Nissl染液染3 min,蒸馏水洗涤1 min后,依次脱水、透明、封片,显微镜下观察Arc中的Nissl小体。
2.3 SN和Arc的免疫荧光染色 切片经微波抗原修复15 min,5%的山羊血清封闭30 min,SN处滴加TH小鼠单克隆抗体(1∶5 000; Sigma),Arc处分别滴加TH小鼠单克隆抗体、Iba1兔多克隆抗体(1∶200; WAKO)和POMC小鼠多克隆抗体(1∶50; Abcam),4 ℃孵育过夜后,SN处滴加Alexa Fluro 488标记山羊抗小鼠IgG(1∶500,碧云天生物技术有限公司);Arc处滴加Alexa Fluro 488标记山羊抗小鼠IgG和Cy3标记山羊抗兔IgG(1∶500,碧云天生物技术有限公司)等体积的混合液,室温反应1 h,抗荧光淬灭封片剂封片。荧光显微镜下观察SN中TH,以及Arc中TH、Iba1与POMC的共表达,计数每个视野中阳性细胞的数量。
2.4 Western blot检测SN中TH和下丘脑中的TH、Iba1及POMC的表达 按上述方法麻醉其余大鼠,冰上直接断头快速地取出大鼠SN以及下丘脑的脑组织。常规提取组织中蛋白质,BCA法检测蛋白浓度。2组蛋白各取样40 μg进行SDS-PAGE,电转移至NC膜,裁剪目的条带。5%的脱脂奶粉封闭1 h,SN的条带上加TH小鼠单克隆抗体(1∶10 000; Sigma),下丘脑的相应条带分别加TH小鼠单克隆抗体(1∶10 000)、Iba1兔多克隆抗体(1∶500; WAKO)和POMC小鼠多克隆抗体(1∶200; Abcam),4 ℃过夜;HRP标记的山羊抗小鼠IgG (1∶1 000; 碧云天生物技术有限公司)孵育TH和POMC 1 h,HRP标记的山羊抗兔IgG (1∶1 000; 碧云天生物技术有限公司)孵育Iba1 1 h,ECL显色。应用Fluorchem 2.0系统进行光密度测定,以目的条带与内参照GAPDH的平均光密度的比值表示蛋白水平,进行分析。
3 统计学处理
采用GraphPad Prism软件进行统计学分析。实验数据以均数±标准差(mean±SD)表示。两组间数据统计分析使用t检验,以P<0.05为差异有统计学意义。
结 果
1 6-OHDA大鼠组SN的病变特点
TH是儿茶酚胺合成过程中的限速酶,SN中TH阳性神经元大多是多巴胺能的,因此TH可以看做是SN中多巴胺能神经元的标志。将6-OHDA注入SN 6周后,与对照组相比较,免疫荧光染色可见6-OHDA大鼠组SN中每个视野(×200)的TH阳性神经元数量从56±5减少至14±2 (P<0.05),见图1; Western blot分析可见SN中TH的蛋白表达水平从0.75±0.11降低至0.41±0.09 (P<0.01),见图2;行为学检测观察到6-OHDA组大鼠在转棒上停留的时间从(85.7±6.3) s缩短到(44.9±11.1) s (P<0.01),见图3。上述结果说明造模成功。
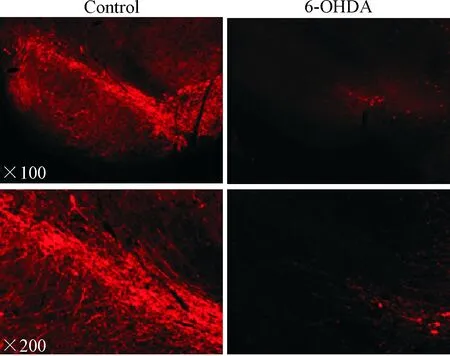
Figure 1.The immunoreactivity of tyrosine hydroxylase (TH) in the substantia nigra (SN) of control and 6-OHDA rats.
图1 2组大鼠SN中TH免疫荧光染色结果
对2组大鼠的体重和摄食量观察可见,6-OHDA大鼠的体重略低于对照组,但差异未见统计学显著性,同时摄食量的差异也无统计学显著性。但是,腹膜后脂肪含量从(7.550±0.670) g减少到(3.895±0.465) g,差异有统计学显著性(P<0.01),见图4。
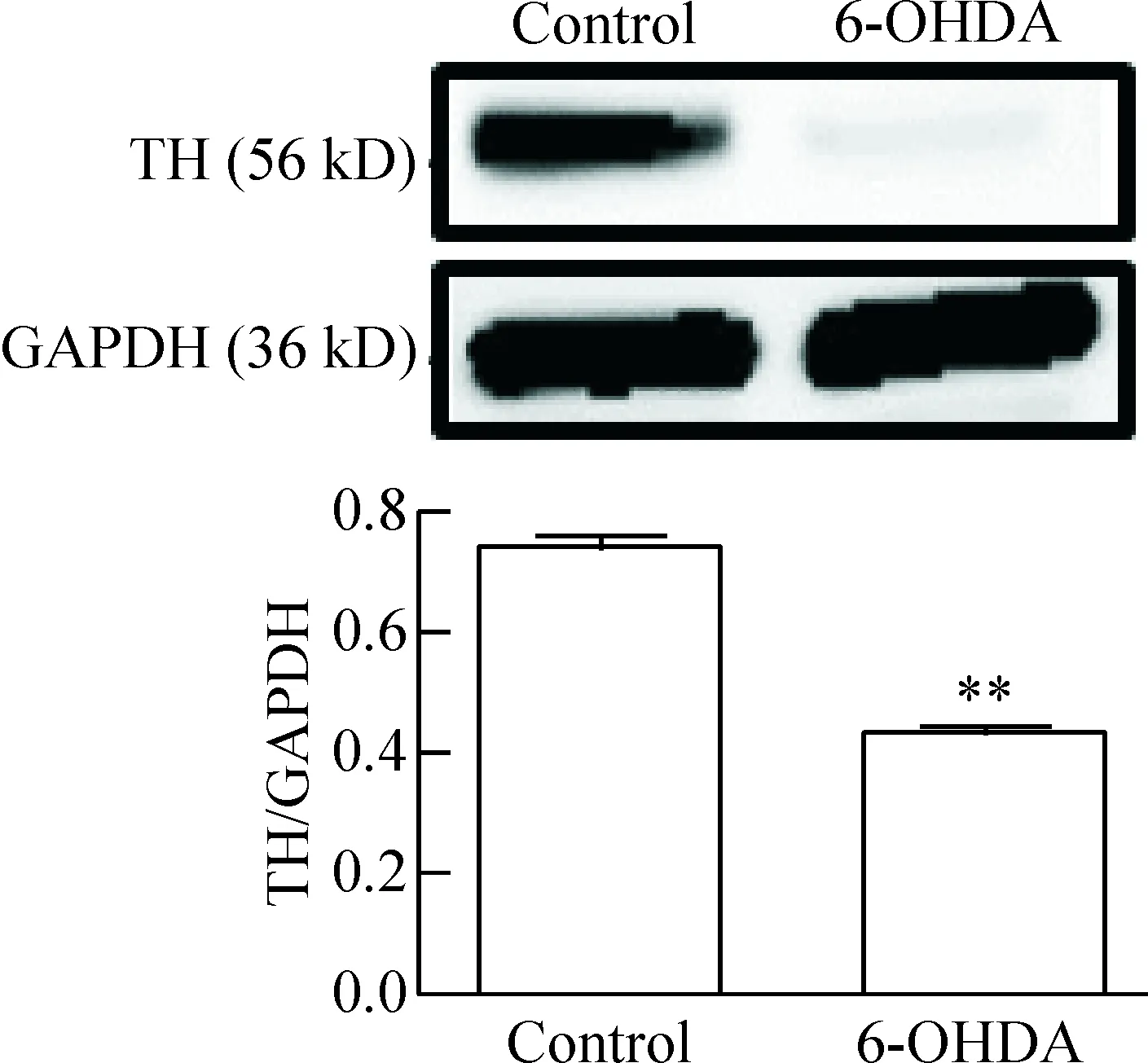
Figure 2.The protein expression of tyrosine hydroxylase (TH) in the substantia nigra (SN) of control and 6-OHDA rats detected by Western blot. Mean±SD.n=5.**P<0.01vscontrol group.
图2 Western blot检测2组大鼠SN中TH蛋白的表达
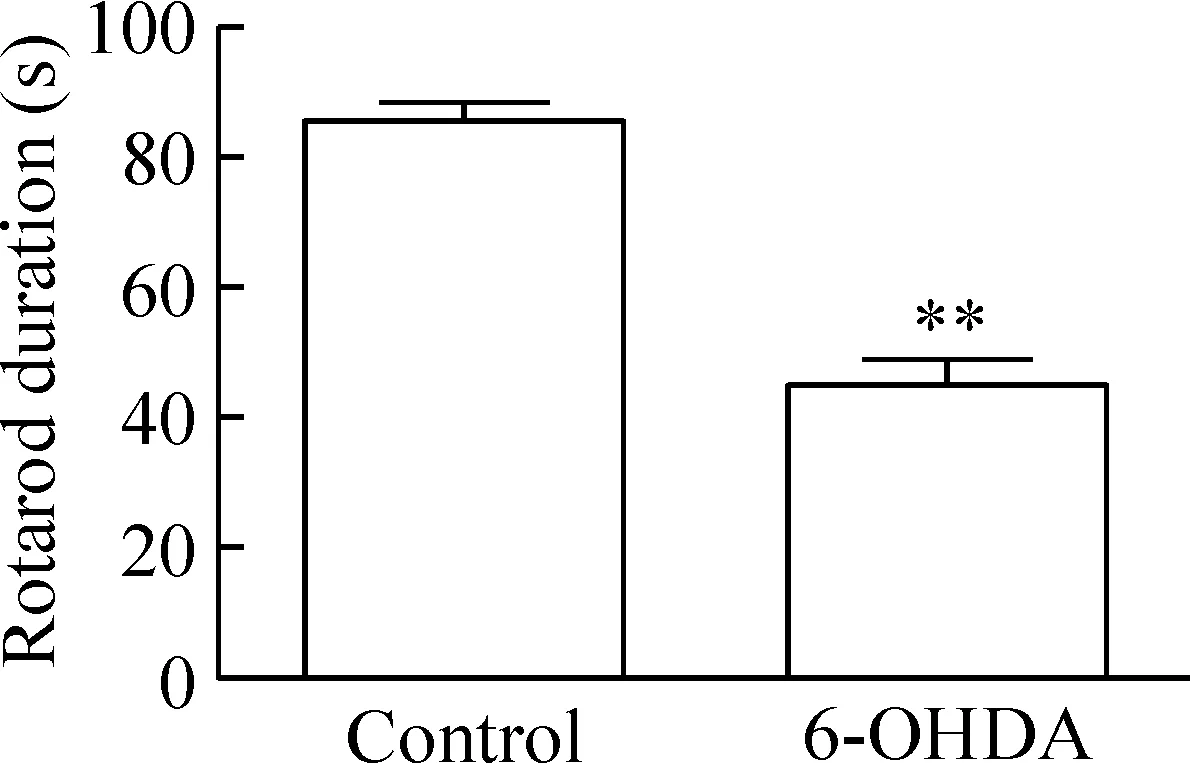
Figure 3.The time spent on the rotarod in control and 6-OHDA rats. Mean±SD.n=10.**P<0.01vscontrol group.
图3 2组大鼠在转棒上停留时间的比较
2 Arc中TH、Iba1和POMC阳性神经元的分布
尼氏染色可见,6-OHDA大鼠组与对照组之间的神经元无明显变化。免疫荧光染色可见,TH分布于神经元的细胞体和突起;POMC分布于神经元的细胞体,且在POMC阳性的神经元周围有大量Iba1阳性细胞表达。与对照组相比较,6-OHDA组Arc中每个视野(×200) TH阳性的神经元和纤维密度明显减少,同时Iba1阳性的细胞数量从12±2增加到30±5(P<0.05),POMC阳性的神经元数量从16±4增加到31±2 (P<0.05),见图5、6。
3 下丘脑TH、Iba1和POMC蛋白水平的变化
6-OHDA注入SN 6周后,下丘脑TH的蛋白表达水平从0.35±0.05降低到0.21±0.02 (P<0.01),Iba1的蛋白表达水平从0.23±0.06 增加至0.51±0.04 (P<0.01),POMC的蛋白表达水平从0.37±0.05增加至0.65±0.03 (P<0.01),见图7。
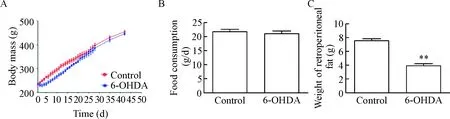
Figure 4.The body mass (A), food consumption (B) and retroperitoneal fat weight (C) in control and 6-OHDA rats. Mean±SD.n=5~10.**P<0.01vscontrol group.
图4 两组大鼠体重、摄食量以及腹膜后脂肪重量比较
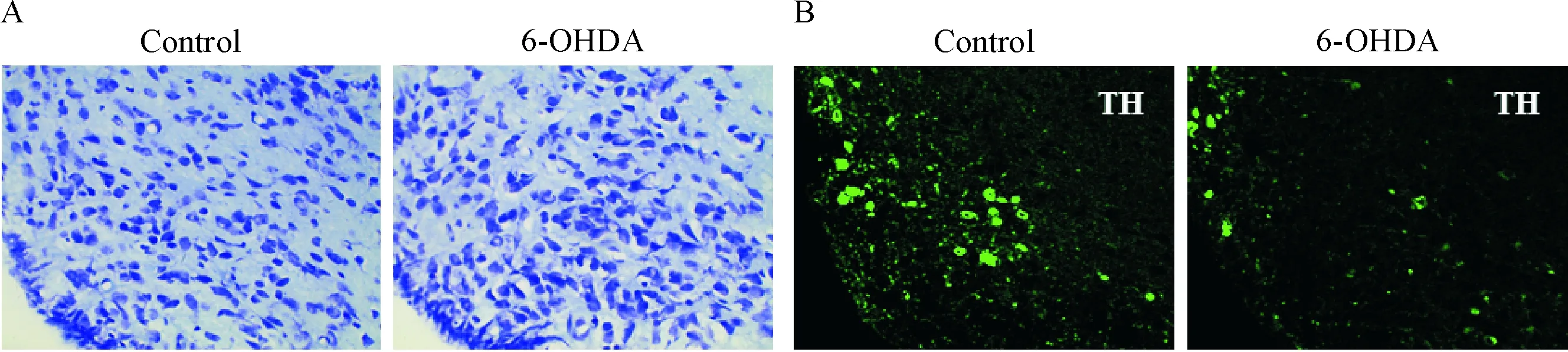
Figure 5.Nissl staining (A) and the tyrosine hydroxylase (TH) immunoreactivity (B) in the arcuate nucleus (Arc) of control and 6-OHDA rats (×200).
图5 2组大鼠Arc Nissl染色和TH免疫荧光染色结果
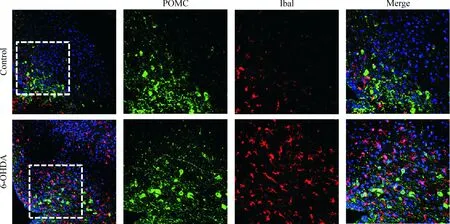
Figure 6.The distribution of POMC and Iba1 in the Arc of control and 6-OHDA rats (×200).
图6 2组大鼠Arc中POMC和Iba1免疫荧光染色
讨 论
脂肪减少是PD病人消瘦的主要原因[3],Arc作为作为调控机体能量代谢和食欲的重要核团,其内的多巴胺能神经元(TH阳性神经元)和POMC神经元都参与外周脂肪的调控。本研究用6-OHDA损伤大鼠SN后引起腹膜后脂肪的显著减少,并伴随Arc中TH减少、Iba1增多和POMC增多,提示腹膜后脂肪减少与Arc内调控能量代谢的神经元改变存在关联,TH、Iba1和POMC的表达变化可能参与与帕金森患者消瘦发病机制。
存在于Arc的POMC为促肾上腺素皮质激素(adrenocorticotropic hormone,ACTH)和β-促脂解素(β-lipotropin,LPH)的前体,ACTH可继续合成α-黑素细胞刺激素(α-melanocyte-stimulating hormone,MSH),LPH可继续合成β-MSH和β-内啡肽(β-endorphin)。
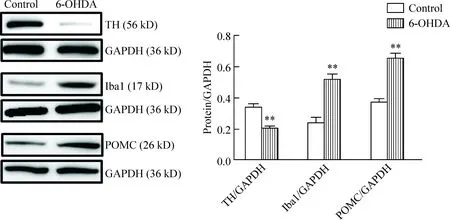
Figure 7.The protein expression of TH, Iba1 and POMC in the hypothalamus of control and 6-OHDA rats. Mean±SD.n=5.**P<0.01vscontrol group.
图7 Western blot检测2组大鼠下丘脑处TH、POMC和Iba1蛋白的表达
Arc POMC源的MSH、β-MSH和β-内啡肽能够通过下丘脑室旁核(paraventricular nucleus,PVN)中的黑皮质素3型受体(melanocortin 3 receptor,MC3R)和黑皮质素4型受体(melanocortin 4 receptor,MC4R)可以通过激活脂肪分解作用并抑制饿感的产生而对机体的脂质代谢起到直接的调控作用[8-9]。相反,POMC的缺失导致犬类的肥胖、食欲的剧烈增强[10]以及人类的肥胖、脂肪含量的增加[11]。以上的证据能够充分说明POMC参与调控机体能量代谢以及食欲。
在本实验中,6-OHDA组大鼠Arc中POMC能神经元数量显著增加,说明POMC可能参与了6-OHDA组大鼠腹膜后脂肪的减少。6-OHDA组大鼠的体重与对照组比较未有明显改变,我们推测原因可能是注射6-OHDA后饲养周期较短造成。TH是多巴胺神经元中多巴胺合成的限速酶。Arc中的TH阳性的神经元大部分为多巴胺能的神经元[12]。Arc中的POMC能神经元抑制食欲,增强代谢,其活性受到多巴胺能的负调控[5]:加入了多巴胺的POMC细胞,其活性显著降低,加入多巴胺受体1抑制剂SKF38393后POMC的电活动不受影响,而加入多巴胺受体2激动剂奎匹罗后POMC细胞的电活动几乎消失,以上结果证明了Arc中的TH对POMC有着直接的负调控作用。在本实验中,Arc中TH显著降低,说明升高的POMC的表达有可能来自于TH活性的降低。Arc能够整合外周以及旁分泌信号并传导至第二级神经元并调控摄食与能量代谢[13-14]。Arc结构上缺失血脑屏障,使其能够快速并直接感知来自于外周的营养状态变化[15],如游离脂肪酸(free fatty acid,FFA)。在高脂诱导的肥胖小鼠模型中,24 h的高脂喂养后,Arc能够敏锐地感受外周FFA的变化并迅速引起Arc中的小胶质细胞的大量产生而导致下丘脑炎症[16]。本实验中,Arc小胶质细胞增加,原因可能为增加的POMC活性激活了外周脂质的分解而导致FFA含量的上升,从而引起了Arc小胶质细胞的增生。
综上所述,本实验用6-OHDA损伤双侧SN中的多巴胺能神经元,发现大鼠的体重无明显变化,腹膜后脂肪含量减少,Arc中TH表达下降,POMC和Iba1的表达水平升高,三者的含量的变化可能与6-OHDA大鼠腹膜后脂肪减少有联系,为揭示PD患者消瘦的发病机制提供了依据。
[1] 周子懿, 高俊鹏, 向 军, 等. CX3CR1参与雷公藤内酯对MPP+帕金森病大鼠多巴胺能神经元的保护作用[J]. 中国病理生理杂志, 2015, 31(4):659-663.
[2] 李艳花, 和 青, 尉杰忠, 等. 硫辛酸对LPS 诱导的帕金森病小鼠黑质多巴胺能神经元损伤的影响[J]. 中国病理生理杂志, 2015, 31(2):201-206.
[3] Lorefält B, Toss G, Granérus AK. Weight loss, body fat mass, and leptin in Parkinson’s disease[J]. Mov Disord, 2009, 24(6):885-890.
[4] Sternson SM. Hypothalamic survival circuits: blueprints for purposive behaviors [J]. Neuron, 2013, 77(5):810-824.
[5] Zhang X, van den Pol AN. Hypothalamic arcuate nucleus tyrosine hydroxylase neurons play orexigenic role in energy homeostasis [J]. Nat Neurosci, 2016, 19(10):1341-1347.
[6] Tran DQ, Tse EK, Kim MH, et al. Diet-induced cellular neuroinflammation in the hypothalamus: mechanistic insights from investigation of neurons and microglia [J]. Mol Cell Endocrinol, 2016, 438:18-26.
[7] Lemus MB, Bayliss JA, Lockie SH, et al. A stereological analysis of NPY, POMC, Orexin, GFAP astrocyte, and Iba1 microglia cell number and volume in diet-induced obese male mice[J]. Endocrinology, 2015, 156(5):1701-1713.
[8] Cawley NX, Li Z, Loh YP. 60 years of POMC: biosynthesis, trafficking, and secretion of pro-opiomelanocortin-derived peptides [J]. J Mol Endocrinol, 2016, 56(4):T77-T97.
[9] Lowry P. 60 years of POMC: purification and biological characterisation of melanotrophins and corticotrophins[J]. J Mol Endocrinol, 2016, 56(4):T1-T12.
[10]Raffan E, Dennis RJ, O’Donovan CJ, et al. A deletion in the canine POMC gene is associated with weight and appetite in obesity-prone labrador retriever dogs[J]. Cell Metab, 2016, 23(5):893-900.
[11]Low MJ. Neuroendocrinology: New hormone treatment for obesity caused by POMC-deficiency[J]. Nat Rev Endocrinol, 2016, 12(11):627-628.
[12]Chronwall BM. Anatomy and physiology of the neuroendocrine arcuate nucleus[J]. Peptides, 1985, 6(Suppl 2):1-11.
[13]Schwartz MW, Woods SC, Porte D Jr, et al. Central nervous system control of food intake[J]. Nature, 2000, 404(6778):661-671.
[14]Barsh GS, Schwartz MW. Genetic approaches to studying energy balance: perception and integration[J]. Nat Rev Genet, 2002, 3(8):589-600.
[15]Lam TK, Schwartz GJ, Rossetti L. Hypothalamic sensing of fatty acids[J]. Nat Neurosci, 2005, 8(5):579-584.
[16]Waise TM, Toshinai K, Naznin F, et al. One-day high-fat diet induces inflammation in the nodose ganglion and hypothalamus of mice[J]. Biochem Biophys Res Commun, 2015, 464(4):1157-1162.
(责任编辑: 卢 萍, 罗 森)
Changes of ionized calcium binding adapter molecule 1 and pro-opiome-lanocortin expression in arcuate nucleus of hypothalamus induced by substantia nigra lesion with 6-hydroxydopamine
ZHANG Yi-min1, LIAN Hui1, SONG Hai-yan1, ZHOU Li1, CAI Jun-yan2, WANG Zhi-yong1
(1HenanKeyLaboratoryofMedicalTissueRegeneration,XinxiangMedicalCollege,Xinxiang453003,China;2ZhongdaHospital,SoutheastUniversity,Nanjing210009,China.E-mail:wanliheng@vip.163.com)
AIM: To observe the expression of tyrosine hydroxylase (TH), ionized calcium binding adapter molecule 1 (Iba1) and pro-opiomelanocortin (POMC) in rat arcuate nucleus (Arc) of hypothalamus induced by substantia nigra (SN) lesion with 6-hydroxydopamine (6-OHDA). METHODS: According to the random number table, 20 SD rats were randomly divided into 6-OHDA group and control group. 6-OHDA was injected into the bilateral SN of the rats in 6-OHDA group, and the same volume of saline was injected into the same position of the rats in control group. After 6 weeks, the rats were sacrificed and the brains were obtained. Immunofluorescence staining and Western blot were used to detect TH expression in the SN, and TH, Iba1 and POMC expression in the Arc. RESULTS: Compared with control group, no significant change of body weight in 6-OHDA group was observed, but the weight of retroperitoneal fat decreased from (7.550±0.670) g to (3.895±0.465) g (P<0.01). The number of TH immunoreactive neurons in SN decreased from 56±5 to 14±2 (P<0.05), and the TH protein level decreased from 0.75±0.11 to 0.41±0.09 (P<0.01). In the Arc, the number of TH immunoreactive neurons decreased from 21±2 to 10±3 (P<0.05), the number of Iba1 immunoreactive neurons increased from 12±2 to 30±5 (P<0.05), and the number of POMC immunoreactive neurons increased from 16±4 to 31±2 (P<0.05). In the hypothalamus, the TH protein level decreased from 0.35±0.05 to 0.21±0.02 (P<0.01), the Iba1 protein level increased from 0.23±0.06 to 0.51±0.04 (P<0.01), and the POMC protein level increased from 0.37±0.05 to 0.65±0.03 (P<0.01).CONCLUSION: The changes of TH, Iba1 and POMC expression in Arc of 6-OHDA-treated rats may involved in the fat loss in Parkinson’s disease.
6-Hydroxydopamine; Arcuate nucleus; Tyrosine hydroxylase; Ionized calcium binding adapter molecule 1; Pro-opiomelanocortin
1000- 4718(2017)06- 0975- 06
2016- 03- 16
2017- 04- 27
国家自然科学基金资助项目(No. 31200897);新乡医学院博士科研基金(No. XYBSKYZZ201501);河南省医用组织再生重点实验室开放课题(No. KFKT16003)
R322.85; R741
A
10.3969/j.issn.1000- 4718.2017.06.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0373-3831655; E-mail: wanliheng@vip.163.com
