STC2促进人肝癌细胞HepG2增殖和EMT相关的迁移*
2017-06-24胡明珠张一梅罗海华胡水旺刘爱华
曹 蕾, 李 磊, 胡明珠, 张一梅, 罗海华, 胡水旺, 刘爱华, 姜 勇△
(南方医科大学 1病理生理学教研室, 广东省蛋白质组学重点实验室, 2南方医院呼吸科, 广东 广州 510515)
STC2促进人肝癌细胞HepG2增殖和EMT相关的迁移*
曹 蕾1, 李 磊1, 胡明珠1, 张一梅1, 罗海华1, 胡水旺1, 刘爱华2, 姜 勇1△
(南方医科大学1病理生理学教研室, 广东省蛋白质组学重点实验室,2南方医院呼吸科, 广东 广州 510515)
目的: 探讨斯钙素 2(STC2)对人肝癌细胞HepG2增殖、迁移以及上皮-间充质转化(EMT)进程的影响。方法: Western blot法检测不同肝癌细胞株及正常肝细胞株的STC2蛋白表达情况;集落形成实验分析STC2对HepG2细胞增殖的影响,同时进一步采用实时荧光定量PCR及Western blot法检测STC2对cyclin D1等增殖相关基因的表达变化; Transwell实验分析STC2对肝癌细胞HepG2迁移能力的影响,采用实时荧光定量PCR和Wes-tern blot法检测过表达和沉默STC2的细胞中EMT分子标志物vimentin和E-cadherin的表达情况。结果: 与正常肝细胞系相比,STC2蛋白在肝癌细胞中高表达。集落形成实验结果说明STC2促进HepG2细胞的增殖,同时STC2可以显著影响cyclin D1等增殖相关基因的表达。Transwell实验结果说明STC2增强HepG2细胞的迁移能力,同时显著影响肝癌细胞的EMT过程。结论: STC2能够促进肝癌细胞系HepG2的增殖并且影响增殖相关基因的表达,进一步研究表明STC2能够影响肝癌细胞的EMT过程,促进肝癌细胞的迁移。
肝细胞癌; 斯钙素2; 上皮-间充质转化; 细胞迁移
迄今为止,由于诊断延误及不良预后等原因,肝癌致死率仍然居高不下[1]。特别在国内,每年新发病例占全球50%以上,死亡率仅次于肺癌,在某些农村甚至跃居第1位[2-4]。此外,肝癌细胞的侵袭性与转移性也是导致患者肿瘤复发、病情恶化而最终死亡的病理基础[5]。因此,研究肝癌细胞转移机制,找到调控肝癌转移的调控基因具有很大的意义。
斯钙素2(stanniocalcin 2,STC2)是一种分泌型糖蛋白,在多种组织及器官中均表达,通过自分泌或旁分泌的方式发挥功能[6]。最近,越来越多的实验表明,STC2在癌症的发生发展过程发挥重要作用[7-8]。STC2通过蛋白激酶B(protein kinase B,PKB;又称AKT)-细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路促进结肠癌的侵袭和转移[9]。相似的,在头颈癌的发生发展过程STC2发挥促癌作用[10]。但是,STC2在肝癌的病理进程的影响还知之甚少。本文以人肝癌细胞系HepG2为研究对象,研究STC2对肝癌细胞增殖、迁移以及上皮-间充质转化(epithelial-mesenchymal transition,EMT)进程的影响。
材 料 和 方 法
1 主要试剂
L02、HepG2、SMMC7721、Bel7402、QGY7703和Huh7细胞株购自ATCC细胞库;DMEM、RPMI-1640培养基、Lipofectamine 2000以及胎牛血清(fetal bovine serum,FBS)均购于Thermo;Trizol RNA提取试剂购自康为世纪;SYBR Green染料和逆转录试剂盒购自TOYOBO;鼠抗人STC2单克隆抗体和兔抗人GAPDH单克隆抗体购自Santa Cruz。
2 主要方法
2.1 细胞培养及转染 HepG2、SMMC7721和Huh7细胞均用含10% FBS的高糖DMEM培养,L02、Bel7402和QGY7703细胞采用含10% FBS的RPMI-1640培养基,5% CO2、37 ℃培养箱中培养。转染采用Lipofectamine 2000,方法步骤参照说明书,在HEK293T细胞中包装慢病毒过表达质粒pCDH-CWV-MCS-EF1-puro-STC2以及干扰质粒pLKO.1-puro-STC2,使用的包装质粒是pCMV-dR8.91和pCMV-VSV-G,转染48 h后回收培养基,离心去除杂质,回收病毒颗粒,感染目的细胞48 h后,5 mg/L嘌呤霉素处理4~5 d,筛选稳定过表达和干扰STC2细胞株,干扰序列为5’-AACAGTCTGAGTATTCTGAT-3’。
2.2 Western blot实验检测蛋白水平 细胞于4 ℃冰上裂解30 min,离心取上清,调整各组蛋白浓度一致后进行SDS-PAGE。将凝胶蛋白转至PVDF膜,TBST洗膜1次,加入5%脱脂牛奶室温封闭1 h,于4 ℃孵育 I 抗过夜。隔天取膜于HRP标记的 II 抗室温孵育1 h,TBST洗膜3次后,用增强型化学发光剂溶液浸润,显影观察。
2.3 集落形成实验 过表达STC2细胞株以及对照组细胞株消化后计数,接种于6孔板中,每孔接种500个细胞,培养15 d后,4%多聚甲醛固定10 min,结晶紫染色5 min,PBS清洗数次,显微镜下观察超过50个细胞视为一个集落,烘干拍照。
2.4 Transwell细胞迁移能力实验 Transwell小室于铺板前1 h浸润于无血清培养基中,稳定干扰STC2以及对照细胞株消化后,细胞计数,铺板于小室内,每孔1.5×104个细胞,小室内无血清,培养板孔内有血清,培养48 h(干扰表达实验)或24 h(过表达实验)后,4%多聚甲醛室温固定10 min,PBS清洗数次,结晶紫染色5 min,PBS清洗后,使用Zeiss倒置显微镜拍照。
2.5 实时荧光定量PCR (RT-qPCR)检测mRNA水平 RT-qPCR步骤参照TOYOBO产品说明书。Cyclin D1、survivin、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、c-Myc、Bcl-2、缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)、E-cadherin、vimentin和GAPDH引物序列见表1。采用2-ΔΔCt法计算和比较mRNA的相对表达量。

表1 RT-qPCR引物设计
3 统计学处理
使用SPSS 13.0软件进行统计分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 STC2在多种肝癌细胞中高表达
Western blot结果显示,STC2在正常肝细胞中表达较低,在肝癌细胞系SMMC7721、Bel7402、HepG2、QGY7703和Huh7中的表达显著高于正常肝细胞。结果预示STC2可能参与肝癌的某些病理进程,介导肝癌的发生发展,见图1。
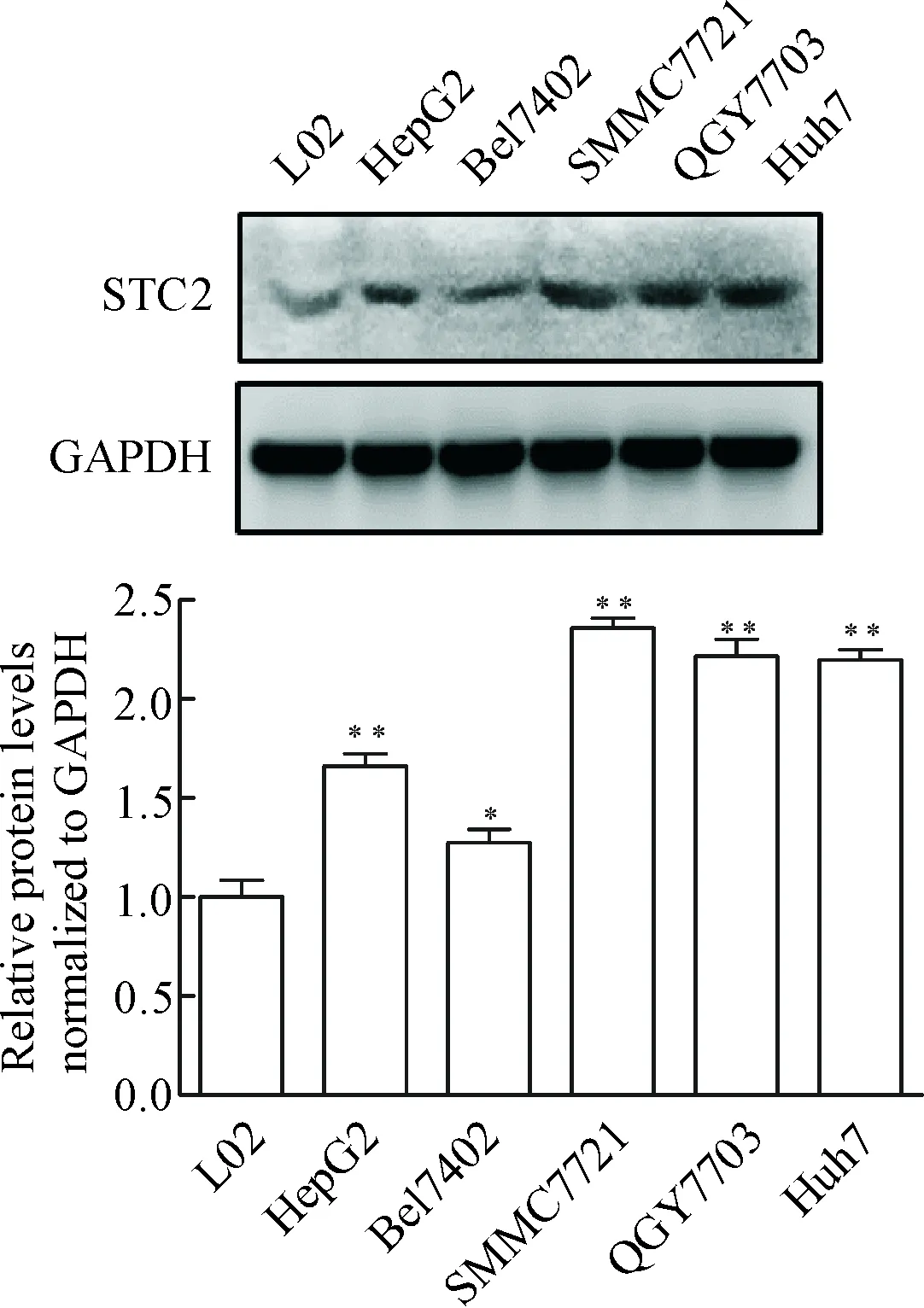
Figure 1.The protein expression levels of STC2 in several cell lines. The relative expression levels of STC2 were normalized to GAPDH. Mean±SD.n=3.*P<0.05,**P<0.01vsL02.
图1 多种细胞系中STC2蛋白表达水平
2 成功于HepG2细胞中构建稳定过表达和沉默STC2的细胞株
为了检测STC2对肝癌细胞增殖的影响,首先我们于人肝癌细胞HepG2中构建STC2过表达和沉默的细胞株,RT-PCR结果显示成功构建过表达和沉默STC2的细胞株,见图2。

Figure 2.Construction of the cell lines. A: the HepG2 cells with stable overexpression ofSTC2; B: the HepG2 cells with stable silencing ofSTC2. GAPDH was used as loading control. Every experiment was conducted in triplicate.
图2 细胞株构建
3 STC2促进肝癌细胞增殖以及相关促癌基因的表达
我们采用集落形成实验检测STC2对肝癌细胞增殖的影响,发现STC2可以促进肝癌细胞的增殖(图3A、B)。RT-qPCR进一步发现过表达STC2能促进cyclin D1、survivin、PCNA、c-Myc、Bcl-2和HIF-1α的mRNA表达上调,而干扰STC2则可以下调这些促增殖基因的表达(图3C、D)。 此外,我们检测了这些基因的蛋白表达水平,发现过表达STC2时这些蛋白表达水平升高,而干扰STC2时这些蛋白表达水平下降(图3E)。
4 STC2增强肝癌细胞HepG2的迁移能力并促进EMT进程
为研究STC2对肝癌细胞迁移的影响,我们通过Transwell实验发现,干扰STC2可以显著抑制肝癌细胞的迁移能力,过表达STC2可以增强HepG2细胞的迁移能力(图4A、B)。鉴于EMT在肿瘤转移中的重要作用,我们开展RT-qPCR实验发现,过表达STC2可以显著下调E-cadherin的mRNA表达水平,而上调vimentin的mRNA表达;干扰STC2可以促进E-cadherin mRNA表达水平上调,而显著下调vimentin mRNA表达水平(图4C、D)。通过检测EMT标志性蛋白表达水平,我们发现过表达STC2可以下降E-cadherin蛋白表达水平,上调vimentin的蛋白水平;干扰STC2则可以促进E-cadherin的蛋白表达水平,下调vimentin的蛋白表达水平(图4E、F)。
讨 论
STC2是斯钙蛋白家族成员之一,广泛表达与哺乳动物的脾、肾、肝、骨骼肌等组织[8]。过去关于STC2的研究主要集中在STC2对钙离子通道的影响方面,认为STC2能够影响钙离子内流来调节细胞内钙离子稳态[11]。
近年来,STC2在肿瘤相关研究中越来越受到重视,越来越多的研究表明STC2参与多种肿瘤发生发展进程[9-10,12]。但STC2对肝癌增殖转移方面的机制研究仍不明确。在该研究中,我们发现在肝癌细胞系中STC2的表达水平显著高于正常肝细胞。那么,STC2的高表达对肝癌发展进程有什么样的影响呢?为了探讨这一问题,我们选用HepG2细胞系构建STC2过表达和沉默细胞系,我们发现过表达STC2可以显著促进肝癌的增殖,并且对cyclin D1、survivin等促增殖基因的表达有比较强的促进作用,同时STC2可以显著上调抗凋亡基因bcl-2的表达并促进HIF-1α的上调。这些发现提示我们,STC2可能通过调节细胞周期、细胞凋亡、肿瘤微环境等方面在肝癌的发生发展过程中发挥作用,有待进一步深入的研究。

Figure 3.The promoting effect of STC2 on the proliferation and proliferation-associated gene expression in the HepG2 cells. A: colony formation assay was used to detect the proliferation ofSTC2-overexpressing cells and control cells; B: the number of colony dots were counted by ImageJ software in triplicate; C: RT-qPCR was used to test the mRNA levels of proliferation-associated genes inSTC2-overexpressing cells and control cells; D: RT-qPCR was used to test the mRNA levels of proliferation-associated genes inSTC2-silencing cells and control cells; E: Western blot was used to detect the expression of the proliferation-associated proteins inSTC2-overexpressing or -silencing cells and control cells. The bands were semi-quantified with densitometry. The relative expression levels of indicated proteins were normalized to GAPDH. Mean±SD.n=3.**P<0.01vsHepG2;#P<0.05,##P<0.01vsHepG2/shCon.
图3 STC2对人肝癌细胞HepG2增殖以及相关促增殖基因表达的影响
有文献报道,STC2能够促进神经母细胞瘤[13]和缺氧性卵巢癌细[14]的转移和侵袭。那么STC2能否影响肝癌细胞HepG2的迁移能力呢?我们的研究发现,过表达STC2可以极强的促进肝癌细胞HepG2的转移,而干扰STC2则可以削弱其迁移能力。同时,也有越来越多的研究表明,EMT在肿瘤转移和侵袭过程中发挥重要作用[15]。那么,STC2促进肝癌HepG2细胞的转移是否是通过影响其EMT进程呢?我们通过检测EMT的2个典型分子标志物,发现STC2可以显著影响EMT进程,我们的研究表明STC2可以通过影响肝癌细胞HepG2的EMT进而在HepG2细胞转移过程中发挥重要的功能。综上所述,本研究利用慢病毒载体成功构建STC2稳定过表达和干扰细胞株,分析STC2对HepG2细胞增殖、迁移以及上皮-间质转化过程中的作用,结合STC2在结肠癌、肺癌、头颈癌中的研究发现[9-10,12],提示我们STC2极有可能在肝癌的发生发展过程中发挥重要作用,需要进一步的深入研究来阐述其可能的分子机理。

Figure 4.STC2 affected the migration of HepG2 cells and was involved in the EMT process. A:STC2-silencing and control cells were subjected to Transwell assay for 48 h incubation; B:STC2-overexpressing and control cells were subjected to Transwell assay for 24 h incubation; C: RT-qPCR was used to test the effect of STC2 on EMT process inSTC2-overexpressing and control cells; D: RT-qPCR was used to test the effect of STC2 on EMT process inSTC2-silencing and control cells; E: Western blot assay was served to identify the protein expression of E-cadherin and vimentin inSTC2-overexpressing and control cells; F: Western blot assay was served to identify the protein expression of E-cadherin and vimentin inSTC2-silencing and control cells. The bands were semi-quantified with densitometry. The relative expression levels of indicated proteins were norma-lized to GAPDH. Mean±SD.n=3.**P<0.01vsHepG2;##P<0.01vsHepG2/shCon.
图4 STC2影响肝癌细胞HepG2的迁移能力并参与其EMT进程
[1] Best J, Schotten C, Theysohn JM, et al. Novel implications in the treatment of hepatocellular carcinoma[J]. Ann Gastroenterol, 2017, 30(1):23-32.
[2] Liu H, Cheng S, Huang Y, et al. Coenzyme Q10 and oxidative stress: inflammation status in hepatocellular carcinoma patients after surgery[J]. Nutrients, 2017, 9(1):E29.
[3] 戴朝六, 赵 阳. 原发性肝癌的综合治疗[J]. 中国普外基础与临床杂志, 2014, 21(2):133-137.
[4] 嵇晓辉, 范秉琳, 张红鸽, 等. MicroRNA-100对肝癌细胞增殖活力和细胞周期的影响[J]. 中国病理生理杂志, 2013, 29(1):108-111.
[5] 张承彦, 谢 鑫, 张春喜, 等. 糖蛋白非转移性黑色素瘤蛋白B对人肝癌细胞增殖、凋亡和侵袭能力的影响及其分子机制[J]. 中国病理生理杂志, 2013, 29(8):1441-1446.
[6] Chen WN, Zhu GJ. Progress in the research of stanniocalcin[J]. Prog Physiol Sci, 2008, 39(3):225-228.
[7] Chang AC, Jellinek DA, Reddel RR. Mammalian stanniocalcins and cancer[J]. Endocr Relat Cancer, 2003, 10(3):359-373.
[8] Yeung BH, Law AY, Wong CK. Evolution and roles of stanniocalcin[J]. Mol Cell Endocrinol, 2012, 349(2):272-280.
[9] Zeng X, He Y, Wang X, et al. STC2 promotes the epithelial-mesenchymal transition of colorectal cancer cells through AKT-ERK signaling pathways[J]. Oncotarget, 2016, 7(44):71400-71416.
[10]Yang S, Ji Q, Chang B, et al. STC2 promotes head and neck squamous cell carcinoma metastasis through modulating the PI3K/AKT/Snail signaling[J]. Oncotarget, 2017, 8(4):5976-5991.
[11]Zeiger W, Ito D, Swetlik C, et al. Stanniocalcin 2 is a negative modulator of store-operated calcium entry[J]. Mol Cell Biol, 2011, 31(18):3710-3722.
[12]Na S, Aldonza MB, Sung H, et al. Stanniocalcin-2 (STC2): a potential lung cancer biomarker promotes lung cancer metastasis and progression[J]. Biochim Biophys Acta, 2015, 1854(6):668-676.
[13]Volland S, Kugler W, Schweigerer L, et al. Stanniocalcin 2 promotes invasion and is associated with metastatic stages in neuroblastoma[J]. Int J Cancer, 2009, 125(9):2049-2057.
[14]Law AY, Wong CK. Stanniocalcin-2 promotes epithelial-mesenchymal transition and invasiveness in hypoxic human ovarian cancer cells[J]. Exp Cell Res, 2010, 316(20):3425-3434.
[15]Alix-Panabières C, Mader S, Pantel K. Epithelial-mesenchymal plasticity in circulating tumor cells[J]. J Mol Med (Berl), 2017, 95(2):133-142.
(责任编辑: 林白霜, 罗 森)
STC2 promotes proliferation and EMT-related migration of HepG2 cells
CAO Lei1, LI Lei1, HU Ming-zhu1, ZHANG Yi-mei1, LUO Hai-hua1, HU Shui-wang1, LIU Ai-hua2, JIANG Yong1
(1DepartmentofPathophysiology,KeyLaboratoryofProteomicsofGuangdongProvince,2DepartmentofRespiratoryDisease,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:jiang48231@163.com)
AIM: To explore the effects of stanniocalcin 2 (STC2) on the proliferation, migration and the process of epithelial-mesenchymal transition (EMT) in human hepatocellular carcinoma HepG2 cells. METHODS: The expression levels of STC2 in the hepatocellular carcinoma cell lines and normal liver cells were assessed by Western blot. Colony formation assay was used to test the effect of STC2 on the proliferation of HepG2 cells. The effects of STC2 on the expression of proliferation-related molecules at mRNA and protein levels were determined by RT-qPCR and Western blot. The effect of STC2 on the migration ability was measured by Transwell assay. The mRNA and protein levels of vimentin and E-cadherin inSTC2-overexpressing and -silencing cell lines were detected by RT-qPCR and Western blot. RESULTS: Compared with the normal liver cell line, the protein expression of STC2 was up-regulated in the hepatocellular carcinoma cell lines. The results of colony formation assay indicated that STC2 promoted the proliferation of HepG2 cells. STC2 significantly regulated the proliferation-related gene expression, such as cyclin D1. The results of Transwell assay showed that STC2 enhanced the migration ability of the HepG2 cells and influenced the EMT process.CONCLUSION: STC2 promotes the proliferation of HepG2 cells and affects the expression of proliferation-related genes. STC2 influences the process of EMT and promotes the migration of HepG2 cells.
Hepatocellular carcinoma; Stanniocalcin 2; Epithelial-mesenchymal transition; Cell migration
1000- 4718(2017)06- 1000- 06
2017- 01- 13
2017- 04- 18
国家自然科学基金资助项目 (No. 81372030); 广州市科技计划项目(No. 201607020016); 南方医科大学南方医院院长基金(No. 2015Z005)
R730.23
A
10.3969/j.issn.1000- 4718.2017.06.007
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-61648231; E-mail: jiang48231@163.com
