小檗碱增强表柔比星诱导T24细胞G0/G1期阻滞的作用机制*
2017-06-24詹雄宇陈奇彪吕秀秀秦晓平陈建帆黄保元卓育敏
詹雄宇, 陈奇彪, 吕秀秀, 秦晓平, 陈建帆, 黄保元, 黄 君, 卓育敏△
(暨南大学 1附属第一医院泌尿外科, 2基础医学院病理生理学系, 广东 广州 510632)
小檗碱增强表柔比星诱导T24细胞G0/G1期阻滞的作用机制*
詹雄宇1, 陈奇彪1, 吕秀秀2, 秦晓平1, 陈建帆1, 黄保元1, 黄 君1, 卓育敏1△
(暨南大学1附属第一医院泌尿外科,2基础医学院病理生理学系, 广东 广州 510632)
目的: 探讨小檗碱联合表柔比星对膀胱癌T24细胞周期的影响及相关作用机制。方法: 实验将膀胱癌T24细胞分为4组:对照组、表柔比星组、表柔比星+小檗碱组和小檗碱组,采用MTT法检测细胞的活力,检测药物处理后对膀胱癌T24细胞增殖的抑制情况。用流式细胞术分析T24细胞周期分布并用Western blot法测定cyclin D1、CDK2、CDK4、P21和P27蛋白的表达水平。结果: 小檗碱联合表柔比星显著抑制T24细胞的活力,存在时间依赖性,联合用药组的G0/G1期细胞比例增高,S期和G2期细胞比例降低,与单用药物组及对照组比较有显著性差异(P<0.05)。联合用药上调细胞周期依赖性激酶抑制蛋白P27和P21蛋白的表达水平,同时下调cyclin D1、CDK2及CDK4细胞周期蛋白的表达水平。结论: 小檗碱增强表柔比星对膀胱癌T24细胞增殖的抑制及G0/G1期阻滞,其作用机制可能与上调P27及P21蛋白和抑制cyclin D1、CDK2及CDK4蛋白表达有关。
小檗碱; 表柔比星; T24细胞; 细胞周期阻滞
经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)是非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)的主要治疗手段,但是术后会有很高的复发率,所以推荐所有患者进行术后辅助性膀胱灌注治疗[1]。表柔比星(epirubicin,Epi) 属第三代蒽环类抗生素类抗肿瘤半合成化合物,常用于膀胱癌术后灌注化疗[2]。研究表明表柔比星辅助膀胱灌注化疗明显降低NMIBC术后复发率。其主要产生的副作用是化学性膀胱炎,如膀胱刺激征、血尿和膀胱烧灼感等症状,常致病人储尿时间缩短,药物滞留膀胱时间缩短,从而影响治疗效果,且其严重程度与灌注药物浓度及频率相关[3]。这些不良反应限制了其在治疗膀胱癌方面的广泛应用。因此,寻找一种对治疗膀胱癌有更高疗效,又能减轻其副作用的治疗方法,具有十分重要的临床意义。
小檗碱(berberine,Ber)在临床上广泛应用于止泻、抗炎和抗氧化[4]。近年来大量研究表明,小檗碱有抗癌作用且对正常细胞没有毒性,能阻止肿瘤细胞增殖和杀死癌细胞,在乳腺癌、结直肠癌和膀胱癌中具有抗肿瘤活性[5]。 Tillhon 等[6]报道小檗碱能引起肿瘤细胞发生G1和G2/M期阻滞,并具有剂量依赖性,其主要作用机制与增加蛋白P21和P27的表达,抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)2、CDK4和细胞周期蛋白D1(cyclin D1)的表达,进而降低cyclin-CDK复合体的活性有关。我们前期实验已证实,小檗碱促进阿霉素诱导的T24细胞凋亡[7];但是小檗碱联合表柔比星对膀胱癌细胞周期有何影响,尚缺乏深入研究。因此本研究旨在观察小檗碱联合表柔比星对膀胱癌T24细胞的细胞周期的影响,并探讨其作用机制。
材 料 和 方 法
1 材料
中性硫酸小檗碱购自Sigma;表柔比星注射液购自浙江海正药业股份有限公司;RPMI-1640培养基、0.25%胰酶、胎牛血清、青霉素和链霉素为HyClone产品;本研究所用抗体购自Cell Signalling Technology;增强化学发光试剂盒(ECL)购自Millipore。
2 细胞及培养
人类膀胱癌T24细胞株购自中国科学院上海生命科学研究院细胞资源中心(编号:TcHu55),用含1×105U/L青霉素、100 mg/L链霉素和10%胎牛血清的RPMI-1640培养基在37 ℃、5% CO2及饱和湿度的培养箱中培养。
3 实验方法
3.1 MTT法检测T24细胞增殖抑制情况 取对数生长期的人膀胱癌T24细胞按1×107/L 密度接种到 96 孔板中,待细胞贴壁后,分别加入小檗碱(0.5、1和2 μmol/L)和/或表柔比星(4 μmol/L)分别处理24 h及48 h,然后每孔加入 MTT 溶液(5 g/L) 10 μL,培养 4 h 后, 弃去上层培养基, 每孔加入二甲基亚砜 150 μL, 振荡 10 min,待蓝色结晶完全溶解后,在酶标仪 490 nm 波长处检测各孔吸光度(A) 值。计算药物对T24细胞的生长抑制率(%)=(1-A实验组/A对照组)×100%。根据MTT结果,后续实验所用Ber浓度确定为1 μmol/L。
3.2 细胞周期分布的检测 收获加药处理24 h的细胞后用4 ℃ PBS洗涤1次,冷无水乙醇4 ℃固定过夜,然后再用PBS洗涤1次,离心,弃上清,加入500 μL含有RNase A的PBS液重悬细胞,在37 ℃温箱避光孵育30 min,加入PI染液继续避光孵育30 min,置于流式细胞仪检测细胞周期,实验重复3次。
3.3 Western blot 检测T24细胞周期相关蛋白的表达 按照细胞蛋白分离和提取试剂盒说明书的方法提取蛋白。BCA法检测各组蛋白浓度,计算使用Western blot所需样品浓度,分别将30 mg样品蛋白经SDS-PAGE分离,然后转移至硝酸纤维膜(PVDF膜)上。5%脱脂奶粉封闭后,加入cyclin D1、CDK2、CDK4、P21、P27单克隆抗体及内参照GAPDH抗体在4 ℃环境下孵育过夜,次日TBST漂洗滤膜3次后,加入相应的Ⅱ抗,并室温封闭1 h,TBST漂洗滤膜,之后经ECL孵育,然后曝光,用Scion Image分析软件进行目的蛋白条带的灰度值分析,计算目的蛋白与内参照 GAPDH 的灰度比值。
4 统计学处理
采用SPSS 21.0统计学软件统计分析,所有实验数据采用均数±标准差(mean±SD)表示,多组数据间的比较采用单因素方差分析(one-way ANOVA),SNK-q检验进行两两比较,两组数据间的比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 小檗碱增强表柔比星抑制膀胱癌T24细胞增殖
不同浓度小檗碱(0.5、1和2 μmol/L)协同表柔比星(4 μmol/L)处理T24细胞24 h和48 h后,对细胞活力有明显抑制作用。联合药物组对T24细胞抑制效果较单用药物组明显(P<0.05),且其作用具有明显的时间依赖性。而小檗碱各组浓度之间,随着浓度增加,时间延长,其对T24细胞的增殖活性抑制无明显差异,见图1。
2 细胞周期分布的检测
PI 染色法检测细胞周期分析结果显示,小檗碱联合表柔比星组较单用药物组显然有更多的细胞阻滞在G1期, 同时T24细胞在S期和G2/M期的数量减少,见图2。

Figure 1.The viability of T24 human bladder cancer cells treated with Epi, with or without Ber for 24 h and 48 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEpi group;△P<0.05vs24 h.
图1 小檗碱联合表柔比星对膀胱癌T24细胞增殖的抑制作用
3 Western blot检测T24细胞周期相关蛋白的表达
Western blot结果显示,小檗碱联合表柔比星能明显促进P21和P27表达,同时抑制cyclin D1、CDK2和CDK4蛋白表达水平,见图3、4。
讨 论
小檗碱是一种常见的异喹啉类生物碱,近年来大量研究表明其具有抗肿瘤作用[6]。此外,表柔比星是临床上常用的抗肿瘤药物,但是其长期高剂量的临床应用导致患者出现膀胱黏膜损伤及诱发心脏毒性,限制其广泛应用和远期效果[3],两者联合作用于膀胱癌T24细胞的体外实验目前尚未有报道。
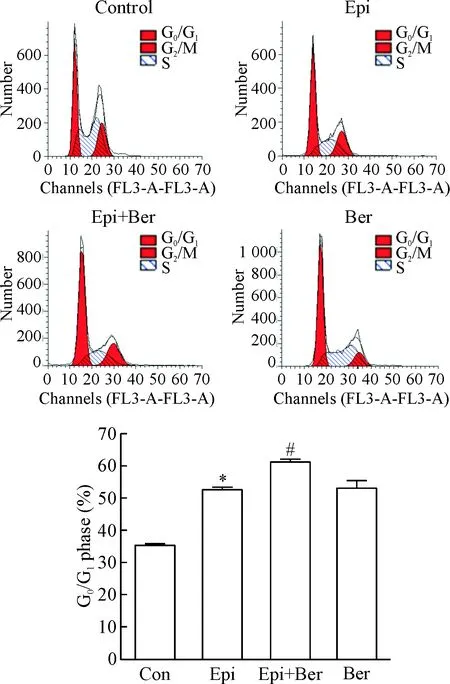
Figure 2.Ber promoted Epi-induced cell cycle arrest at G0/G1phase. Mean±SD.n=3.*P<0.05vscontrol (Con) group;#P<0.05vsEpi group.
图2 小檗碱联合表柔比星诱导T24细胞周期阻滞于G0/G1期
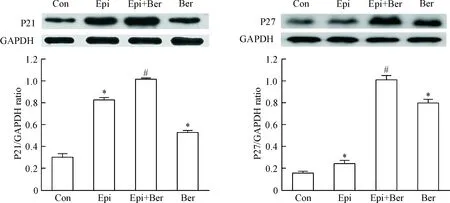
Figure 3.Effect of Ber on P21 and P27 protein levels in Epi-treated T24 cells. Mean±SD.n=3.*P<0.05vscontrol (Con) group;#P<0.05vsEpi group.
图3 各组T24细胞P21和P27的表达情况
本研究结果表明小檗碱能增强表柔比星抑制膀胱癌T24细胞的增殖活力,具有时间依赖性。
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为分裂间期与分裂期2个阶段,其通过周期蛋白家族一系列DNA的表达调控而有序进行,并严格按照G0/G1-S-G2-M的顺序进行。研究证实在细胞增殖周期表达期间存在一系列的调控因子,主要包括CDK、cyclin和CDK抑制剂(CDK inhibitor,CKI),而CDK是整个细胞周期的调控中心,cyclin对CDK起正性调控作用,CKI对CDK起负性调控作用。P27蛋白对细胞周期的调控主要是通过对cyclin E-CDK2复合物活性的抑制,从而使得细胞周期停滞在G0/G1期[8]。有研究报道,小檗碱能够下调G1期相关基因cyclin D1、cyclin E1、CDK2和CDK4的表达,并上调负调控基因P27的表达[9-10]。本实验中Western blot结果显示,小檗碱联合表柔比星药物组处理T24细胞后P27的表达上调,这与上述研究结果相一致,表明小檗碱联合表柔比星可能通过上调P27的表达直接抑制cyclin-CDK复合物的激活,阻滞T24细胞周期G0/G1期进入S期。

Figure 4.Effect of Ber on the protein expression of cyclin D1, CDK2 and CDK4 in T24 cells treated with Epi (4 μmol/L) for 24 h. Mean±SD.n=3.*P<0.05vscontrol (Con) group;#P<0.05vsEpi group.
图4 各组T24细胞cyclin-CDK复合物的表达情况
Tashiro 等[11]研究发现cyclin D1可以通过激活CDK4或CDK6等作用,促进DNA合成以及细胞周期中G1期进入S期,加速细胞增殖。流式细胞术分析细胞周期发现,Ber与Epi药物联合组G0/G1期细胞比例增高, S期和G2/M期细胞比例降低,与单用Epi组及对照组比较差异有统计学意义,表明小檗碱能够促进表柔比星加强对膀胱癌T24细胞周期抑制作用。而Western blot检测结果发现小檗碱联合表柔比星抑制T24细胞细胞周期中关键蛋白CDK2、CDK4和cyclin D1的表达水平和酶活性显著降低,提示小檗碱能够促进表柔比星加强对膀胱癌T24细胞周期抑制作用,其主要途径是通过降低T24细胞的CDK和cyclin D1表达从而阻断细胞从G1期向S期进展,造成G1期细胞堆积。
目前认为P21几乎可以和每一种cyclin-CDK复合物结合,广泛抑制各种cyclin-CDK复合物,如cyclin D1-CDK4、cyclin E-CDK2和cyclin A-CDK2[12]。已有研究证明P21的过表达可使细胞周期阻滞于G1期、G2期或S期,其机制主要是抑制cyclin E/CDK2及cyclin D1/CDK4等细胞周期相关cyclin-CDK复合物的活性,阻滞于G1期或G2/M期,诱导细胞凋亡或细胞修复DNA损伤[13]。 Yan 等[14-15]研究发现小檗碱能够通过上调P21的表达,介导caspase-9-caspase-3的内源性凋亡信号通路,诱导膀胱癌T24细胞G1期细胞周期的阻滞和凋亡。我们在研究结果显示,小檗碱联合表柔比星药物组较单用药物组处理T24细胞后P21蛋白的表达水平上调,表明其可能通过上调P21的表达,阻滞T24细胞周期于G1期,但G2/M期是否发生阻滞尚未明确。
综上所述,小檗碱能增强表柔比星抑制人T24细胞增殖的作用,具有时间依赖性效应。小檗碱能增强表柔比星诱导膀胱癌细胞G0/G1期阻滞的作用,其机制可能与其上调P27及P21蛋白的表达水平,抑制cyclin D1、CDK2及CDK4等细胞周期相关cyclin-CDK复合物的活性有关,这些结果为治疗膀胱癌和其它肿瘤提供新的策略和思路。
[1] 那彦群, 叶章群, 孙颖浩, 等.中国泌尿外科疾病诊断治疗指南手册: 2014版[M].第1版.北京: 人民卫生出版社, 2014:36-39.
[2] Chen SY, Du LD, Zhang YH. Pilot study of intravesical instillation of two new generation anthracycline antibiotics in prevention of superficial bladder cancer recurrence[J]. Chin Med J (Engl), 2010, 123(23):3422-3426.
[3] 王建国. 表阿霉素膀胱灌注预防膀胱癌术后复发的临床观察[J]. 现代仪器与医疗, 2014, 20(6):94-96.
[4] Singh A, Duggal S, Kaur N, et al. Berberine: alkaloid with wide spectrum of pharmacological activities[J]. J Nat Prod, 2010, 3:64-75.
[5] Xie J, Xu Y, Huang X, et al. Berberine-induced apoptosis in human breast cancer cells is mediated by reactive oxygen species generation and mitochondrial-related apoptotic pathway[J]. Tumor Biol, 2015, 36(2):1279-1288.
[6] Tillhon M, Guam [7] 陈奇彪, 詹雄宇, 吕秀秀, 等. 小檗碱增强阿霉素诱导的膀胱癌T24细胞凋亡[J]. 中国病理生理杂志, 2016, 32(5):847-851. [8] Nourse J, Firpo E, Flanagan WM, et al. Interleukin-2-mediated elimination of the p27Kip1cyclin-dependent kinase inhibitor prevented by rapamycin[J]. Nature, 1994, 372(6506): 570-573. [9] 吴莉莉, 秦 霞, 秦 莹. 盐酸小檗碱抑制MOG特异性T细胞增殖及其机制研究[J]. 现代免疫学, 2009, 29(3):223-229. [10]杨历辉, 李东霞, 苏依拉, 等. 小檗碱对人皮肤黑素瘤A375细胞周期相关miRNA的影响[J]. 中国皮肤性病学杂志, 2016, 30(11):1123-1126. [11]Tashiro E, Tsuchiya A, Imoto M. Functions of cyclin D1 as an oncogene and regulation of cyclin D1 expression[J]. Cancer Sci, 2007, 98(5):629-635. [12]Warfel NA, El-Deiry WS. p21WAF1and tumourigenesis: 20 years after[J]. Curr Opin Oncol, 2013, 25(1):52-58. [13]Vogelstein B, Lane DP, Levine AJ. Surfing the P53 network[J]. Nature, 2000, 408(6810):307-310. [14]Yan K, Zhang C, Feng J, et al. Induction of G1 cell cycle arrest and apoptosis by berberine in bladder cancer cells[J]. Eur J Pharmacol, 2011, 661(1-3):1-7. [15]Yan L, Yan K, Wang K, et al. Berberine inhibits the migration and invasion of T24 bladder cancer cells via redu-cing the expression of heparanase[J]. Tumor Biol, 2013, 34(1):215-221. (责任编辑: 陈妙玲, 罗 森) Berberine promotes epirubicin-induced G0/G1phase arrest in T24 bladder cancer cells ZHAN Xiong-yu1, CHEN Qi-biao1, Lg Xiu-xiu2, QIN Xiao-ping1, CHEN Jian-fan1, HUANG Bao-yuan1, HUANG Jun1, ZHUO Yu-min1 (1DepartmentofUrology,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,SchoolofBasicMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tzhuoyumin@126.com) AIM: To observe the effects of the combination of berberin and epirubicin on the cell cycle of T24 bladder cancer cells and the underlying mechanisms. METHODS: The cancer cells were exposed to epirubicin in the presence or absence of different concentrations of berberin. The viability of the cancer cells was determined by MTT assay. The cell cycle distribution was detected by flow cytometry, and the protein levels of cyclin D1, CDK2, CDK4, P21 and P27 were detected by Western blot. RESULTS: Berberine markedly enhanced the inhibitory effect of epirubicin on the viability of T24 cells and promoted epirubicin-induced cell cycle arrest at G0/G1phase as compared with the negative control cells. Epirubicin increased the protein expression of P27 and P21, both of which were enhanced by treatment with berberin. In contrast, berberin exposure further decreased the protein expression of cyclin D1, CDK2 and CDK4 in epirubicin-treated T24 cells.CONCLUSION: Berberine significantly promotes epirubicin-induced G0/G1phase arrest in human bladder cancer cells by up-regulating P27 and P21 expression and inhibiting the expression of cyclin D1, CDK2 and CDK4. Berberine; Epirubicin; T24 cells; Cell cycle arrest 1000- 4718(2017)06- 1048- 05 2016- 12- 23 2017- 03- 28 暨南大学第一临床医学院科研培育专项基金资助项目(No. 2014105) R730.23; R965 A 10.3969/j.issn.1000- 4718.2017.06.015 杂志网址: http://www.cjpp.net △通讯作者 Tel: 020-38688516; E-mail: tzhuoyumin@126.com
