Taxol对宫颈癌U14细胞增殖、凋亡及α2,6-SA和ST6Gal mRNA表达的影响*
2017-06-24高雪松王晓玉
高雪松, 王晓玉
(暨南大学第一附属医院妇产科,广东 广州 510632)
Taxol对宫颈癌U14细胞增殖、凋亡及α2,6-SA和ST6Gal mRNA表达的影响*
高雪松, 王晓玉△
(暨南大学第一附属医院妇产科,广东 广州 510632)
目的: 研究泰素(Taxol)对小鼠宫颈癌U14细胞株增殖、凋亡以及α2,6-唾液酸(SA)和α2,6-唾液酸转移酶(ST6Gal)mRNA表达的影响,为进一步探讨宫颈癌Taxol化疗机制提供新思路。方法: Taxol处理U14细胞后,MTT检测Taxol对U14细胞的IC50值。流式细胞术检测细胞α2,6-SA、细胞凋亡相关因子(Bcl-2、Bax、caspase 8和caspase 3)、凋亡率和细胞周期改变。 qPCR检测ST6Gal1 和ST6Gal2 mRNA的表达。结果: 与对照组相比,Taxol对U14细胞有明显的抑制作用,减弱α 2,6-SA荧光强度,上调Bax表达,下调Bcl-2表达,降低Bcl-2/Bax比值,并增强caspase 8和caspase 3活性;Taxol处理显著增加U14细胞凋亡率及S期细胞和G2/M期细胞比率,此外还下调ST6Gal1 mRNA表达。结论: α2,6-SA和ST6Gal可能参与了Taxol对U14细胞细胞周期和凋亡调控的多重作用。
泰素; 细胞凋亡; 细胞周期; α2,6-唾液酸; α2,6-唾液酸转移酶
近年来,泰素(Taxol;紫杉醇注射液)已成为晚期宫颈癌化疗常用的治疗药物。研究表明,细胞表面唾液酸化水平的改变与细胞的癌变、肿瘤的进展、转移及预后显著相关。因而,在癌症进展中检测唾液酸有助于癌症诊断,评估疗效和预后。根据与糖残基的连接方式,唾液酸(sialic acid,SA)可分为α2,3-、α2,6-和α2,8- 三大类,细胞表面唾液酸化是由唾液酸转移酶(sialyltransferase,ST)催化,α2,6-唾液酸转移酶(α2,6-sialyltransferase,ST6Gal)成员包括ST6Gal1和ST6Gal2。α2, 6-唾液酸化与 ST6Gal的活性密切相关。文献报道,α2,6-唾液酸(α2,6-SA)和ST6Gal1在宫颈癌中呈高表达[1],但它们在Taxol治疗宫颈癌中的改变及其作用,报道甚少。子宫颈癌是全球女性仅次于乳腺癌的第二大常见癌症,宫颈癌的发生发展机制十分复杂。本实验旨在通过观察Taxol对小鼠宫颈癌U14细胞增殖、凋亡及α2,6-SA和ST6Gal表达的影响,为进一步探讨宫颈癌Taxol化疗机制提供新的思路。
材 料 和 方 法
1 材料
小鼠宫颈癌 U14 细胞株购自中国医学科学院肿瘤研究所;Taxol(紫杉醇注射液)购自Bristol-Myers Squibb;全自动酶标仪(Bio-Rad);FACSAria流式细胞仪和Annexin V-FITC/PI 凋亡试剂盒(BD);α2,6-SA FITC-SNA试剂盒(Vector);Bcl-2、Bax和caspase-8试剂盒(SCBT);caspase-3试剂盒(CST);Cell Cycle Assay Kit 购自Abcam;qPCR所用试剂和所有引物均由上海生工生物工程股份有限公司合成提供;CFX实时荧光定量 PCR 仪 (Roche)。
2 实验方法
2.1 细胞培养 U14细胞用含 10% 胎牛血清 的 DMEM 高糖培养液在 37 ℃、5% CO2的条件下培养,所有后续实验均在细胞处于对数生长期时进行。
2.2 MTT检测 取对数生长期U14细胞,分未加药物常规培养的U14细胞为对照(control)组和Taxol处理组,其中Taxol组分为7个不同浓度的亚组。首先将4×107/L单细胞悬液,接种于96孔细胞培养板。Taxol组再分别加入依次以4倍比稀释的Taxol,终浓度分别为60 mg/L、15 mg/L、3.75 mg/L、0.938 mg/L、0.234 mg/L、0.059 mg/L和0.015 mg/L。加药后,将细胞分别培养24 h、48 h和72 h,然后,行常规MTT检测,于全自动酶标仪,570 nm波长处测定各孔吸光度,计算不同Taxol浓度孵育的细胞存活率,绘制药物浓度-细胞存活曲线并做线性回归,通过IC50软件计算出相应的IC50值。
2.3 流式细胞术检测U14 细胞α2,6-SA、Bcl-2、Bax、caspase 8和caspase 3的表达及细胞凋亡和周期 选MTT检测中Taxol达到较好杀伤效果的IC50值处理的U14细胞为Taxol组,常规培养的U14细胞为对照组。严格按照检测项目各自试剂盒说明书操作,Cell Quest 软件分析样品,重复进行3次。
2.4 qPCR检测ST6Gal mRNA表达 qPCR所用引物如下: ST6Gal1(检测3个剪接体的同源序列)上游引物5’-CCACTCAGCCCCTGGTGT-3’,下游引物5’-CAGCTCGAAACACCGAAGC-3’;ST6Gal2上游引物5’-TGGCTGTCCAGCAGCACTTT-3’,下游引物5’-AGCAATCCTGCGGCACCTAT-3’;GAPDH的上游引物5’-TGGGTGTGAACCACGAGAAATAT-3’,下游引物5’-CAGAGGGGCCATCCACAGTC-3’。严格按照试剂盒说明书操作,应用qPCR仪进行检测。反应条件: 95 ℃ 2 min; 95 ℃ 10 s, 60 ℃ 30 s, 70 ℃ 30 s, 40个循环; 熔解温度70~95 ℃。收集荧光信号,绘制扩增曲线,计算mRNA的2-ΔΔCt相对表达量。将Taxol组分为3个亚组(10 mg/L组、20 mg/L组和30 mg/L组),常规培养的U14细胞为对照组,GAPDH作为内参照,行qPCR检测,依据CFX Manager软件进行基因表达分析,获取ST6Gal1 mRNA和 ST6Gal2 mRNA相对表达水平,实验重复进行3次。
3 统计学处理
采用SPSS 13.0统计软件进行分析。数据用均数±标准误(mean±SEM)表示,两组间均数的比较采用t检验,多组间均数的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 MTT实验结果
随着Taxol浓度梯度的递增和时间的延长,U14细胞存活率呈下降趋势。24 h,IC50=168.8 mg/L;48 h,IC50=22.15 mg/L;72 h,IC50=8.04 mg/L,随着Taxol作用时间的延长,IC50值逐渐降低。3个时间段相比,48 h的存活率曲线与线性回归直线方程拟合的趋势效果较佳,细胞的生长抑制呈明显的时效和量效关系,见图1。因此,选择IC50值 22.15 mg/L或相近浓度10 mg/L、20 mg/L和30 mg/L作用于U14细胞48 h,作为后续实验的作用浓度和作用时间。
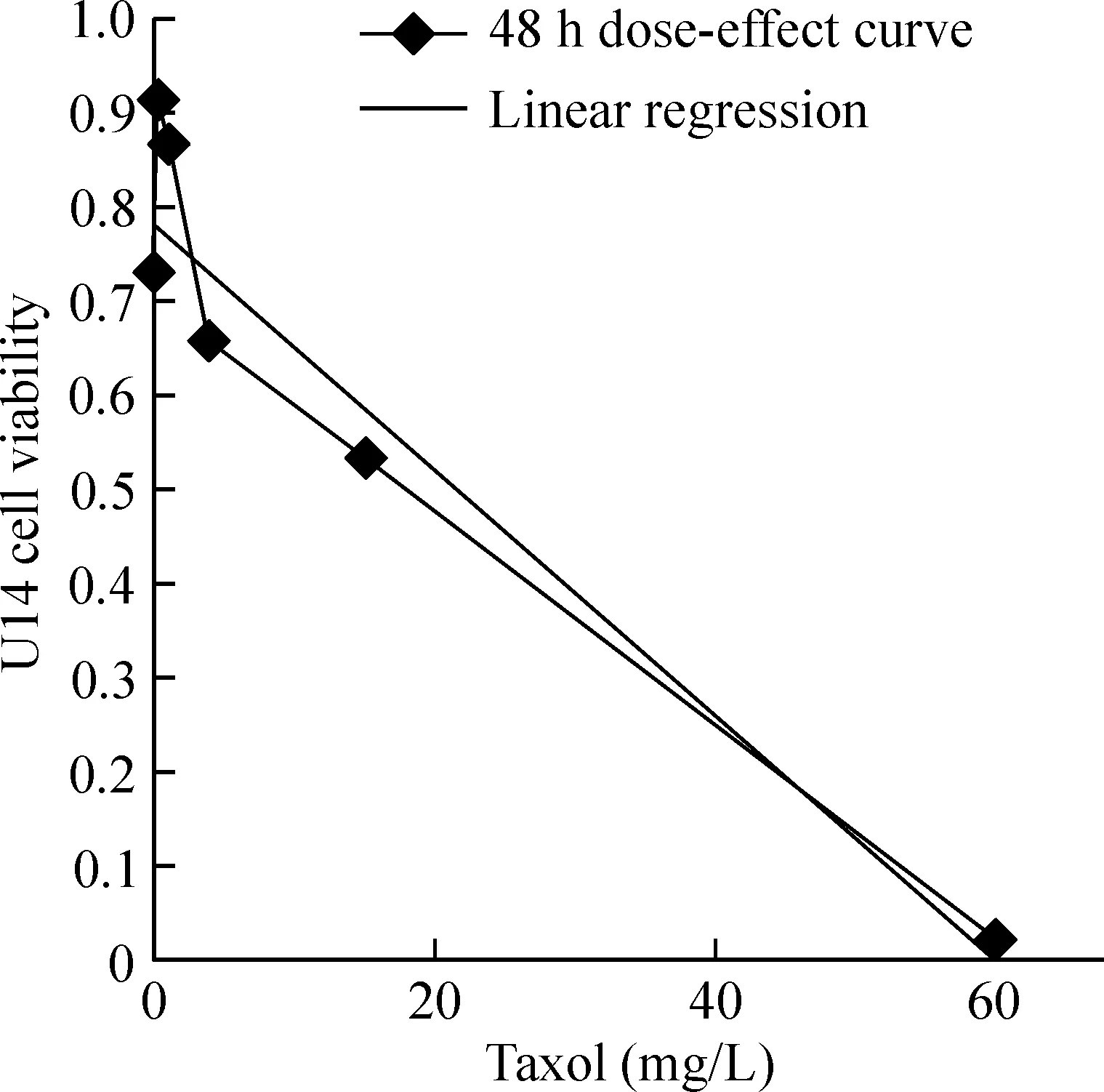
Figure 1.The dose-effect curve and linear regression of mouse cervical cancer cell line U14 treated with various concentrations (0.015 mg/L~60 mg/L) of Taxol for 48 h.
图1 Taxol孵育U14细胞48 h量效曲线与线性回归
2 流式细胞术检测结果
依据MTT实验结果,Taxol组采用浓度为22.15 mg/L,孵育U14细胞48 h后显示:与对照组相比,Taxol对U14细胞有明显的抑制作用,α2,6-SA荧光强度减弱, Bax表达上调, Bcl-2表达下调, Bcl-2/Bax比值降低caspase 8和caspase 3活性增强;Taxol处理后U14细胞凋亡率(早期和晚期凋亡)增加;Taxol组U14细胞可见G0/G1期前出现显著的Sub-G1期凋亡峰,G0/G1期细胞百分率减少,而S期和G2/M期细胞比率显著增多,见图2、表1。
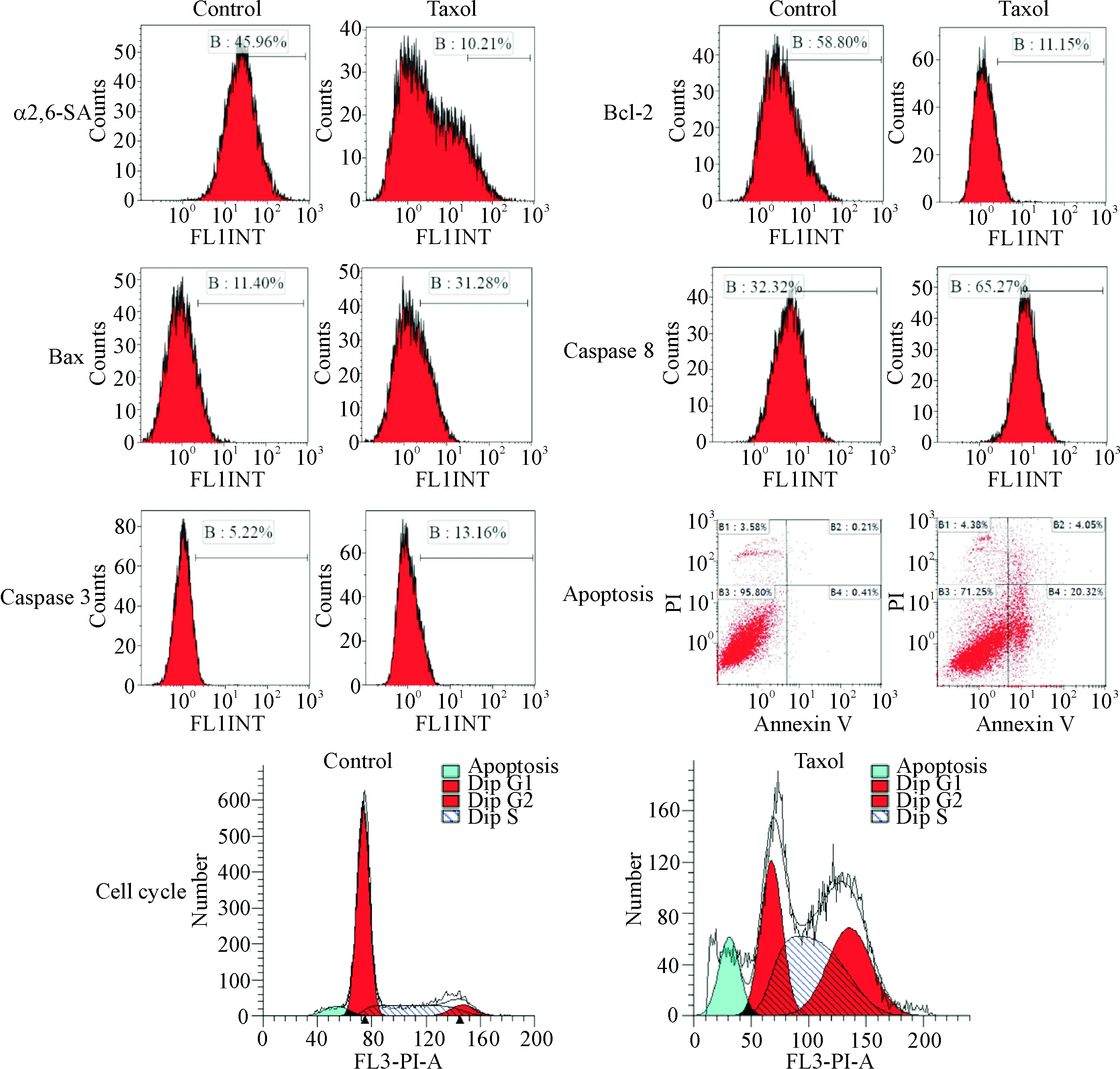
Figure 2.Changes of α2,6-SA, Bcl-2 and Bax expression, caspase 8 and caspase 3 activity, apoptosis rate and cell cycle in U14 cells treated with 22.15 mg/L Taxol for 48 h were detected by flow cytometry.
图2 流式细胞仪检测对照组与Taxol组U14细胞的α2,6-SA、Bcl-2、 Bax、 caspase 8、caspase 3、细胞凋亡率和细胞周期的改变
3 ST6Gal1 和ST6Gal2 mRNA 的表达
U14细胞经 Taxol 10 mg/L、20 mg/L和30 mg/L浓度分别处理48 h后,ST6Gal1 mRNA相对表达量随着Taxol药物浓度的递增而递减,呈显著的剂量依赖性。而ST6Gal2 mRNA相对表达量均轻度上调,且有波动,以20 mg/L组上调较明显,但与对照组相比,差异无统计学意义,见图3。
讨 论
紫杉醇是一种高效、作用强、广谱的细胞周期特异性抗肿瘤药物,能协同多种抗癌药物,并增敏放疗。Bava等[2]指出,MTT测定法评价紫杉醇药物敏感性是非常方便的方法,100 nmol/L Taxol对人源性宫颈癌HeLa、SiHa、CaSki和ME-180细胞系具有高度的细胞毒性,而5 nmol/L和10 nmol/L Taxol诱导的细胞毒性分别为17%和50%。本研究中Taxol作用24 h对U14细胞的生长抑制作用欠佳,作用48 h和72 h则有一定的细胞毒性,呈现时间和一定剂量的依赖性,随药物浓度的递增和时间的延长毒性作用增加, U14细胞的增殖存活逐渐受到抑制。
表1 流式细胞术分析Taxol处理48 h对U14细胞α2,6-SA、细胞凋亡相关因子和细胞周期的影响
Table 1.Effects of 22.15 mg/L Taxol treatment for 48 h on α2,6-SA, apoptosis-related factors and cell cycle in U14 cells were detected by flow cytometry (%. Mean±SEM.n=6)
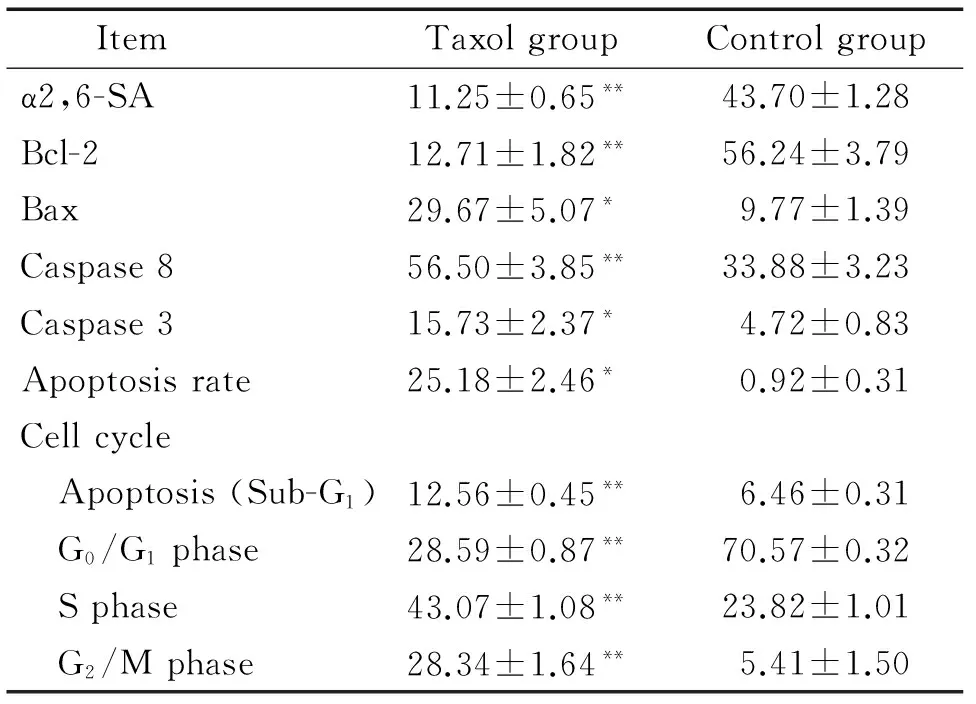
ItemTaxolgroupControlgroupα2,6-SA11.25±0.65**43.70±1.28Bcl-212.71±1.82**56.24±3.79Bax29.67±5.07*9.77±1.39Caspase856.50±3.85**33.88±3.23Caspase315.73±2.37*4.72±0.83Apoptosisrate25.18±2.46*0.92±0.31Cellcycle Apoptosis(Sub-G1)12.56±0.45**6.46±0.31 G0/G1phase28.59±0.87**70.57±0.32 Sphase43.07±1.08**23.82±1.01 G2/Mphase28.34±1.64**5.41±1.50
*P<0.05,**P<0.01vscontrol group.
细胞周期调控是一个复杂的生物学过程, 肿瘤的发生、发展与细胞周期密切相关,越来越多的研究显示,肿瘤是一类细胞周期性紊乱性疾病[3]。细胞凋亡与肿瘤有着密切关系。肿瘤不仅是细胞增生过度,而且细胞死亡率过低,是增生与死亡失调所致,所以肿瘤不但是细胞增生异常的疾病,亦是死亡异常的疾病[4],1979年,Schiff等[5]首次研究发现,紫杉醇抑制成倍增长的HeLa细胞的分裂,孵育20 h,HeLa细胞被阻止在G2/M期,阻滞细胞有丝分裂的完成。由此提出,紫杉醇抗肿瘤独特机制是作用于细胞骨架蛋白微管系统,并可诱导肿瘤细胞的凋亡。Dang等[6]发现,紫杉醇孵育可增强HeLa细胞(HPV18阳性)和CaSki细胞(HPV16阳性)的凋亡(早期和晚期凋亡),抑制癌细胞增殖。表明,紫杉醇是人类宫颈癌的广谱有效药物。Sreekanth等[7]利用3-甲基胆蒽(3-MC)制作小鼠宫颈多级鳞状细胞癌模型,然后将肿瘤分离出的原代细胞,进行紫杉醇药物处理,在10 nmol/L和25 nmol/L浓度下作用24 h,可见显著的代表凋亡细胞群体的亚G1峰,G0/G1期细胞百分率减少,S期随紫杉醇浓度的增加,呈现增加的趋势,G2/M期百分率则明显增多,提示紫杉醇诱导G2/M期阻滞。Bao等[8]观察到HeLa细胞内及其表面显示出较高的ST6Gal活性,且在G1期比S期有较大的ST6Gal活性,表明,在药物治疗中,对G1期HeLa细胞的ST6Gal活性的监控,可为ST6Gal相关抗癌药物的开发和筛选提供一种有效的平台。Baskaran等[9]发现,宫颈鳞状细胞癌患者促凋亡蛋白Bcl-2表达增加,抗凋亡蛋白Bax表达减少, Bax蛋白与Bcl-2蛋白比例降低,caspase 3的活性显着减弱,表明它们可能在宫颈癌细胞的异常增殖中发挥作用。本研究发现,Taxol作用后,U14细胞表面α2,6-SA荧光强度降低,Bcl-2表达减少,Bax表达增加,Bcl-2/Bax比值降低;caspase 8和caspase 3上调;细胞凋亡率增加;细胞周期检测:G0/G1期前出现显著的Sub-G1期凋亡峰,G0/G1期细胞显著减少;而S期细胞和G2/M期细胞明显增多,使较多U14细胞阻滞于 S期和G2/M期,提示Taxol可通过凋亡的细胞内线粒体途径和细胞外死亡受体途径引起caspase的级联活化来诱导肿瘤细胞凋亡。Taxol下调α2,6-SA,伴随细胞凋亡增加,表明Taxol可通过对U14细胞细胞周期和细胞凋亡调控的多重效应,杀伤癌细胞,从而抑制肿瘤细胞的增殖和生长。
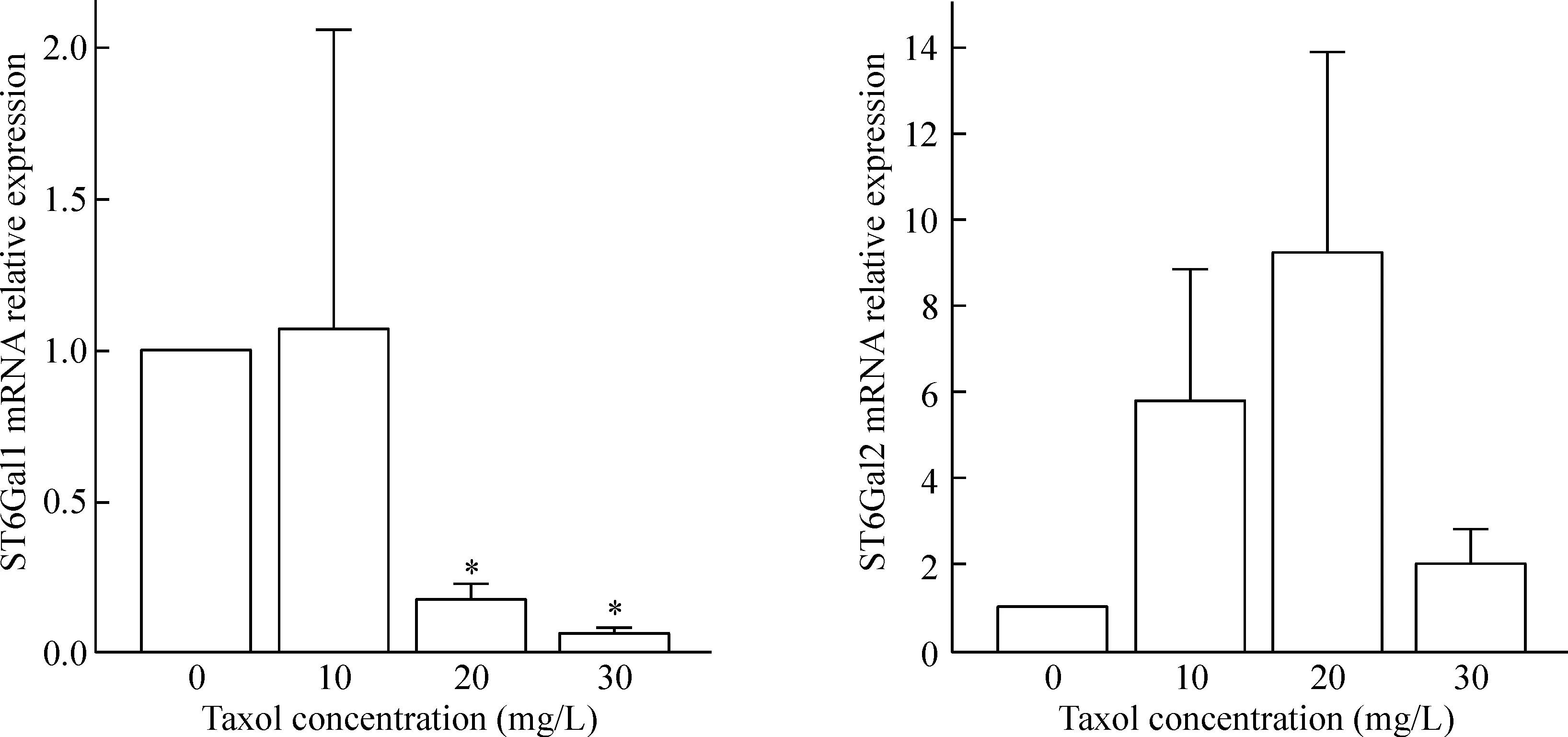
Figure 3.The relative expression of ST6Gal1 mRNA and ST6Gal2 mRNA in U14 cells treated with different concentrations of Taxol for 48 h. Mean±SEM.n=9.*P<0.05vs0 mg/L.
图3 qPCR 检测ST6Gal1 mRNA和ST6Gal2 mRNA的相对表达量
癌细胞ST6Gal1的上调,催化癌细胞表面α2,6-唾液酸化,可促进肿瘤细胞的抗凋亡作用。本课题组发现,下调HeLa 细胞ST6Gal1的表达水平,可以降低宫颈癌 HeLa 细胞 α2,6-SA的表达,增强顺铂对 HeLa细胞的凋亡诱导效应[10]。增加ST6Gal1表达可介导整合素β1的α2,6-唾液酸化,保护结肠癌SW48细胞,阻断细胞外分泌型Gal-3与整合素β1结合产生的促凋亡效应[11]。ST6Gal1可促进死亡受体Fas的α2,6-唾液酸化修饰,下调caspases 8和caspases 3的活化,抑制Fas诱导凋亡的能力,致肿瘤逃避凋亡[12]。强制下调ST6Gal1,可显著增加TNF-α诱导的细胞凋亡[13]。以上可见, ST6Gal1是多种细胞存活途径的一个关键调节因子,可作为一种潜在的抗细胞凋亡识别信号。
Mannherz等[14]通过TUNEL测定和流式细胞仪分析,首次确认ST6Gal2具诱导人HEK293T细胞凋亡功能。杨佳晔等[15]观察到,转染ST6Gal2的HeLa细胞,呈现大量的凋亡细胞。转染ST6Gal2的HEK293T细胞,切割的caspase 3、caspase 7和PARP含量增加。转染ST6Gal2的HEK293T细胞和内源性ST6Gal2蛋白水平显著增加的小鼠大脑原代神经元中,分别检测到内质网应激的标志蛋白BiP、Bim和CHOP含量增加,caspase 3增加,以上表明,ST6Gal2可引发内质网应激通道,导致细胞凋亡。证明,诱导细胞凋亡是ST6Gal2特有的性质。而转染ST6Gal1的HEK293T细胞,BiP、Bim和CHOP的蛋白含量没有增加,提示同属一个家族的ST6Gal1不参与诱导细胞凋亡。本研究Taxol处理U14细胞,ST6Gal2 mRNA相对表达量均轻度上调,由于标准误较大,未呈现显著性差异,有待进一步研究。
本研究初步探讨了Taxol抗宫颈癌U14细胞生长增殖和诱导凋亡作用的分子机制。首次报道了Taxol处理U14细胞,下调α2,6-SA和ST6Gal1表达。这些结果提示,α2,6-SA和ST6Gal可能参与Taxol对U14细胞细胞周期和凋亡调控的多重作用,为Taxol治疗宫颈癌的机制补充了新的资料。
[1] Wang PH. Altered sialylation and its roles in gynecologic cancers[J]. J Cancer Mol, 2006, 2(3): 107-116.
[2] Bava SV, Puliappadamba VT, Deepti A, et al. Sensitization of Taxol-induced apoptosis by curcumin involves down-regulation of nuclear factor-κB and the serine/threonine kinase Akt and is independent of tubulin polymerization[J]. J Biol Chem, 2005, 280(8):6301-6308 .
[3] Hartwell LH, Kastan MB. Cell cycle control and cancer[J]. Science, 1994, 266(5192):1821-1828.
[4] Iversen OH. Kinetics of cellular proliferation and cell loss in human carcinomas. A discussion of methods available forinvivostudies[J]. Eur J Cancer, 1967, 3(4):389-394.
[5] Schiff PB, Fant J, Horwitz SB. Promotion of microtubule assemblyinvitroby taxol[J]. Nature, 1979, 277(5698):665-667.
[6] Dang YP, Yuan XY, Tian R, et al. Curcumin improves the paclitaxel-induced apoptosis of HPV-positive human cervical cancer cells via the NF-κB-p53-caspase-3 pathway[J]. Exp Ther Med, 2015, 9(4):1470-1476.
[7] Sreekanth CN, Bava SV, Sreekumar E, et al. Molecular evidences for the chemosensitizing efficacy of liposomal curcumin in paclitaxel chemotherapy in mouse models of cervical cancer[J]. Oncogene, 2011, 30(28):3139-3152.
[8] Bao L, Ding L, Yang M, et al. Noninvasive imaging of sialyltransferase activity in living cells by chemoselective recognition[J]. Sci Rep, 2015, 5:10947.
[9] Baskaran K, Satish R, Santhosh V, et al. Expression pattern of pro- and anti-apoptotic proteins in patients with squamous cell carcinoma of the uterine cervix[J]. Int J Res Pharm Sci, 2010, 1(4):546-550.
[10]张小鹏. 靶向 ST6GalⅠ的 siRNA 与顺铂联合应用对宫颈癌细胞化疗敏感性的研究[D]. 广州: 暨南大学, 2012.
[11]Zhuo Y, Bellis SL. Emerging role of α2,6-sialic acid as a negative regulator of galectin binding and function[J]. J Biol Chem, 2011, 286(8): 5935-5941.
[12]Swindall AF, Bellis SL. Sialylation of the Fas death receptor by ST6Gal-I provides protection against Fas-mediated apoptosis in colon carcinoma cells[J]. J Biol Chem, 2011, 286(26):22982-22990.
[13]Liu Z, Swindall AF, Kesterson RA, et al. ST6Gal-I regulates macrophage apoptosis via α2-6 sialylation of the TNFR1 death receptor[J]. J Biol Chem, 2011, 286(45): 39654-39662.
[14]Mannherz O, Mertens D, Hahn M, et al. Functional screening for proapoptotic genes by reverse transfection cell array technology[J]. Genomics, 2006, 87(5):665-672.
[15]杨佳晔. ST6Gal2为BACE1的水解底物并且能够诱导细胞凋亡[D]. 厦门: 厦门大学, 2013.
(责任编辑: 陈妙玲, 罗 森)
Effects of Taxol on proliferation, apoptosis, and mRNA expression of α2,6-sialic acid and ST6Gal in cervical carcinoma cell line U14
GAO Xue-song, WANG Xiao-yu
(DepartmentofObstetricsandGynecology,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China.E-mail:twxy@jnu.edu.cn)
AIM: To study the effect of Taxol on the proliferation, apoptosis, and mRNA expressions of α2,6-sialic acid (SA) and α2,6-sialyltransferase (ST6Gal) in mouse cervical cancer cell line U14. METHODS: After the U14 cells were treated with Taxol, the IC50value of Taxol to U14 cells was detected by MTT assay. The expression of α2,6-SA and apoptosis-related factors (Bcl-2, Bax, caspase 8 and caspase 3), the apoptosis rate and cell cycle were determined by flow cytometry. The mRNA expression of ST6Gal1 and ST6Gal2 was detected by qPCR.RESULTS: As compared with control group, Taxol induced obvious U14 cell growth inhibition, reduced α2,6-SA expression, up-regulated Bax, down-regulated Bcl-2, decreased the ratio of Bcl-2/Bax, enhanced caspase 8 and caspase 3 activity, increased the apoptotic rate and cell proportions of Sub-G1and S phases, and induced G2/M phase arrest. Taxol also down-regulated the mRNA expression of ST6Gal1, and slightly up-regulated the mRNA expression of ST6Gal2. CONCLUSION: α2,6-SA and ST6Gal are involved in the multiple effects of Taxol on modulation of the cell cycle and apoptosis in U14 cells.
Taxol; Apoptosis; Cell cycle; α2,6-sialic acid; α2,6-sialyltransferase
1000- 4718(2017)06- 1038- 05
2016- 01- 21
2017- 03- 21
广东省药学会妇科肿瘤用药研究基金资助项目(No. 2012D15); 暨南大学第一临床医学院科研培育专项基金[2012]7号青年项目(No. 9)
R730.23; R711.74
A
10.3969/j.issn.1000- 4718.2017.06.013
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-38688646; E-mail: twxy@jnu.edu.cn
