单纯疱疹病毒1型感染神经胶质细胞的代谢组学研究
2017-06-23马丽华杨宏静徐晓艳石中全邓榕
马丽华,杨宏静,徐晓艳,3,石中全,邓榕
(1重庆三峡医药高等专科学校基础医学部,重庆 404120;2重庆三峡中心医院神经内科,重庆 404120;3重庆医科大学神经科学研究中心,重庆400016)
单纯疱疹病毒1型感染神经胶质细胞的代谢组学研究
马丽华1,杨宏静1,徐晓艳1,3,石中全1,邓榕2*
(1重庆三峡医药高等专科学校基础医学部,重庆 404120;2重庆三峡中心医院神经内科,重庆 404120;3重庆医科大学神经科学研究中心,重庆400016)
目的研究单纯疱疹病毒1型(HSV-1)对人类少突胶质细胞(OL细胞)代谢的影响,从而探讨HSV-1感染的分子机制。方法将OL细胞随机分为两组,一组为感染组,感染HSV-1,一组为正常对照组,不感染HSV-1,运用核磁共振氢谱(1H NMR)检测二组细胞培养液水相代谢产物,最后由偏最小二乘法-判别分析(PLS-DA)对数据进行分析。结果感染组与正常对照组细胞培养液水相代谢物的组成有显著差异:被HSV-1感染的OL细胞的培养液中,亮氨酸、谷氨酸、谷氨酰胺增多,丙氨酸、甘氨酸、组氨酸、异亮氨酸、乳酸减少。结论HSV-1感染改变OL细胞的氨基酸代谢,HSV-1可能通过扰乱宿主细胞的代谢路径,促进自己的繁殖,并影响神经系统的功能活动。
单纯疱疹病毒1型;代谢组学;核磁共振氢谱;神经胶质细胞
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)是有包膜的双链嗜神经DNA病毒。中枢神经系统是HSV-1感染的主要部位之一,感染后导致单纯疱疹病毒性脑炎(Herpes simplex encephalitis,HSE)。在所有脑炎中,HSE占5%~20%,在病毒性脑炎中达20%~68%,在成人和儿童,90% HSE由HSV-1所造成[1]。据最新统计数据显示,国外,HSE患病率为10/10万,发病率为4/10万~8/10万,我国尚无准确的流行病学资料。HSE的死亡率很高,HSE未经治疗死亡率为70%[2],经过抗病毒治疗的死亡率仍高达20%,且50%以上的存活者遗留有神经功能的缺损[3]。此外,HSV-1与难治性局灶性癫痫、老年痴呆症、急性播散性脑脊髓炎和多发性硬化[4]也有密切的关系。但是HSV-1感染的分子机制仍不清楚。
已证实,细胞模型对阐明病毒感染的机制有重要价值,依靠细胞模型,许多病毒感染的机制被提出[5]。病毒借助宿主细胞进行复制增殖,从而改变细胞的代谢。细胞外液是细胞直接生存的环境,是细胞摄取营养物质和排泄代谢产物的地方,它清晰地反映了细胞的代谢活性[6]。曾有研究表明HSV-1感染影响了宿主细胞的代谢路径,扰乱了物质的水平,但目前尚无HSV-1感染导致细胞代谢物整体轮廓改变的研究。
代谢组学是一个整体性的代谢谱分析方法,它能够多元地分析在病理生理压力下系统代谢的综合改变[7]。核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)作为新兴的代谢组学分析技术广泛用于人类疾病的代谢组学研究[6], 它能检测出大多数化合物,具有样品易处理、无偏向性、无损伤性等优点[8]。
人少突胶质细胞(OL细胞)是一种广泛用于嗜神经病毒研究的神经胶质细胞株[9],HSV-1对它也高度敏感,超微结构下, 细胞内曾多次发现HSV-1颗粒[10]。并且目前认为病毒复制增殖及其毒性产物造成神经细胞、神经胶质细胞凋亡或死亡是引起1型HSE的病理机制之一[11]。因此本研究中,我们采用高分辨率的1H NMR代谢组学方法探测感染HSV-1的OL细胞和正常对照OL细胞外液代谢物的不同,试图为HSV-1感染病理机制的研究提供一个新的方向。
材料与方法
1 病毒及细胞株
OL细胞由德国柏林自由大学Hanns Ludwig教授惠赠,非洲绿猴肾细胞(African green monkey kidney cell,Vero细胞)从American Type Culture Collection (ATCC)购得,HSV-1F株由本实验室保存。
2 主要试剂及设备
胎牛血清(fetal bovine serum,FBS)、DMEM、L型谷氨酰胺、青-链霉素溶液、0.25%的胰蛋白酶和磷酸盐缓冲液(phosphate bufer solution, PBS)(1×) 为HyClone公司产品,低熔点琼脂购自promega公司,结晶紫由Amresco公司购得,重水 (D2O )和 2,2,3,3-氘代三甲基硅烷丙酸钠(TSP)为美国Cambridge Isotope Laboratories公司产品,甲醇、氯仿和甲醛为国产分析纯。超纯水由Millipore MilliQ净化系统制备,低温离心机、恒温培养箱、冰冻干燥机为Thermo Scientifc公司产品,生物安全柜为海尔公司产品,倒置显微镜为Nikon 公司产品,Bruker AVIlI 600 NMR光谱仪为德国Bruker公司产品。
3 细胞培养
Vero细胞和OL细胞在含有DMEM、5% FBS、青-链霉素溶液(100units/ml、100µg/ml)和L型谷氨酰胺(2mM/ml)的培养皿中,于37℃、含5% CO2的培养箱内孵育。
4 空斑实验
当细胞密度达到90%时,将Vero细胞用胰蛋白酶消化,传代到六孔板中。当细胞长满成单层时,弃去培养液,用PBS清洗两遍,随机选3孔作为阴性对照,每孔加入0.6ml 2%DMEM;剩下的加入等量按10倍递增稀释的HSV-1悬液,每个稀释度3孔 (图1)。盖上六孔板于37℃含5%CO2的孵箱中感作,每隔15分钟摇晃数下,使感染均匀。 1h后倒掉病毒悬液,用5.0ml不含血清的DMEM清洗后,每孔加入3.0ml 37℃1∶1混合的2%低熔点琼脂糖和4%2DMEM,于培养箱内进行孵育。当感染细胞出现明显的病变效应(cytopathic efect,CPE)时,细胞变圆、肿大、形成多核巨细胞,每孔加4%甲醛3ml于孵箱中进行固定。30min后弃除琼脂和甲醛,每孔加入1.5%结晶紫1.5ml于室温下染色1h。挑选空斑清晰的孔,计算病毒悬液滴度,蚀斑形成单位(plaque forming unit,PFU)=稀释度×(P1+P2+……Pn) /n × 1 /v,其中p=该稀释度每孔的空斑数,n=该稀释度感染的孔数,v=每孔接种的病毒量(ml)。
5 HSV-1感染OL 细胞
当OL细胞在培养皿(直径为10cm)中长满成单层时,用PBS洗两遍,随机选取6个培养皿的OL细胞作为感染组,以病毒滴度为2.0×105Pfu的HSV-1悬液进行感染;另外6个作为对照组,等量加入含2% FBS的DMEM培养液,于培养箱内进行孵育。当感染HSV-1的OL细胞出现明显细胞病变时,在Nikon倒置显微镜下对两组细胞拍照后,分别提取培养液代谢产物。
6 细胞培养液代谢物的提取
每个培养皿分别取2.4ml培养液到离心管中,加入3倍4℃以2∶1混合的甲醇、氯仿混合液,震荡均匀后,再加入4℃ 2.4ml的氯仿,在冰上进行整个过程的操作。于4℃ 以7000r/min将混合物离心20min,分离成清晰的两层:上层为水相,下层为有机相,吸取上层于冰冻干燥机中干燥,取干燥物进行1H NMR分析。

图1 空斑实验示意图。将 HSV-1原液按10倍递增的方式进行稀释,每孔加入等量病毒稀释液,每个稀释度3孔。Fig. 1 Plaque assay diagram. The HSV-1 suspension was diluted tenfold serially into fve diluents, each of which was added in equal amount into a well in the six-well plate, and three such plates were prepared.
7 样品的NMR扫描
用600µl的D2O(含0.018g/50mlTSP)溶解水相颗粒,于4℃以12000r/min离心10min,吸取550μl的上清液到5mm核磁管进行1H NMR分析,使用Bruker AVANCE Ⅲ 600 NMR采集一维1H NMR谱,1H共振频率为600.13MHz,在90°脉冲序列下采集信号,采样时间为2.66s,迟豫延迟时间为8s,谱宽为 12000 Hz, 累加次数为 256。每个自由诱导衰变(Free Induced Deday,FID)收集 16K 个数据点,充零到 64K 个数据点。采用线宽为 0.3HZ 的指数窗函数,进行傅里叶变换。
8 数据前处理
对所有采集的NMR谱峰,使用3-三甲基甲硅烷基-2,2,3,3-四氘代丙酸钠(TSP,化学位移δ0.0)进行人工定标和基线校正。为了最大程度提取 NMR 谱峰中的代谢信息,用Topspin 2.1软件(Bruker Biospin)将δ10.0-δ-1.0ppm 的峰图平均切分成 0.01ppm。为了消除水峰和尿素峰的影响,减掉δ50.1-4.5。将剩余的峰图校正后倒入 SIMCA-P+ 12.0 软件中进行多变量统计分析。
9 统计分析
运用监督性偏最小二乘法-判别分析(Partial Least Square Discriminant Analysis,PLS-DA)得 到得分图和载荷图。通过分析 PLS-DA得分图区分感染组和正常对照之间的差异程度;通过PLS-DA载荷图区分两组之间的差异代谢物质。依靠化学位移值在数据库Bio Mag Res Bank (BMRB)和Human Metabolome Database(HMDB)中进行化合物的鉴定。
结 果
1 空斑实验
通过空斑实验,计算出HSV-1滴度为2×107pfu/ml(图2)。为使感染复数(multiplicity of infection,MOI)=1,以2.0× 105Pfu感染OL细胞。
2 HSV-1感染OL 细胞
HSV-1是一类溶细胞性感染病毒,镜下可见HSV-1感染OL细胞后,细胞逐渐变圆、肿大和折光性增强,感染细胞与邻近未感染细胞融合形成多核巨细胞,出现明显细胞病变效应(图3)。

图2 空斑实验。箭头所指为OL细胞被HSV-1感染所形成的空斑;A、B、C、D、E 分别表示感染OL细胞的HSV-1浓度分别为原液的10-1、10-2、10-3、10-4、10-5倍,F为阴性对照组。Fig. 2 The plaque assay. The arrow indicates a plaque formed by HSV-1 infected cells; the dilution ratios of HSV-1 suspension in A, B, C, D, and E were 10-110-2, 10-3, 10-4and 10-5, respectively. F is the negative control group.
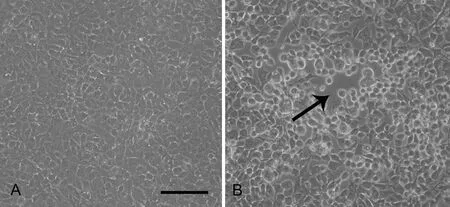
图3 感染HSV-1的OL细胞出现明显的细胞病变效应。A,正常OL细胞;B,被感染HSV-1的OL细胞;标尺,100μmFig. 3 Cytopathic manifestations of HSV-1 infected OL cells. A, normal OL cell; B, OL cells infected with HSV-1; scale bar, 100μm
31H NMR谱
通过1H NMR分析获得感染HSV-1的OL细胞和正常对照组OL细胞的一维培养液水相600MHz谱图(图4)。根据谱图,共有20种代谢物被识别,包括氨基酸(亮氨酸(Leucine)、缬氨酸(Valine)、谷氨酸(Glutamate)、苯丙氨酸(Phenylalanine)、丙氨酸(Alanine)、谷氨酰胺(Glutamate)、甘氨酸(Glycine)、组氨酸(Histidine)、异亮氨酸(Isoleucine)、酪氨酸(Tyrosine))以及一个氨基酸的衍生物N -乙酰天门冬氨酸(N-acetylaspartate,NAA),短链脂肪酸(3-羟基丁酸(3-Hydroxybutyrate)、乙酸(Acetate)、甲酸盐(Formate)、2-氧-异戊酸(2-oxo-Isovalerate) ),有机酸(乳酸(Lactate)、肌酸(Creatine) ),葡萄糖(α-Glucose),胆碱(Choline),肌-肌醇(Myo-inositol)。
4 统计学分析

图4 感染HSV-1的OL细胞和正常对照组OL细胞培养液水相磁共振波谱图Fig.41H NMR spectra of the metabolites extracted from the culture media of HSV-1 infected OL cells and control OL cells
PLS-DA 是一种监督的多变量统计分析方法。本研究,PLS-DA 用于比较感染HSV-1的OL细胞和正常对照组OL细胞。图5是感染组与对照组细胞培养液水相代谢物PLS-DA分析的得分图,其中每个点代表一个样品的1H NMR图谱,紫色代表感染组、红色代表对照组。如图所示,感染组与正常对照组完全区分开来(R2X = 85.9 %, R2Y = 98.8 %, Q2 = 61.6 %)。该模型参数 R2X,R2Y 以及 Q2 均大于 0.5,说明该 PLS-DA 模型是可靠的且具有高的预测能力。
为了鉴定被HSV-1感染的OL细胞和正常对照OL细胞培养液代谢物的差异,我们分析了该 PLSDA 的载荷图(图6)。分析结果显示,有 8个细胞培养液水相差异代谢物质在感染组与正常组区分中起主要作用,其变量重要性投影(Variable importance in the projection,VIP)>2(表1)。

图5 PLS-DA得分,感染组(蓝色点)与对照组(粉色点)可明显区分开来Fig. 5 PLS-DA score plot discriminating HSV-1 infected cells (blue dots) and control OL cells (pink dots).

图6 PLS-DA 载荷图,鉴定感染组与正常对照组间的差异代谢物质Fig. 6 PLS-DA loading plot demonstrating diferences in the levels of key metabolites between HSV-1 infected and control OL cells.
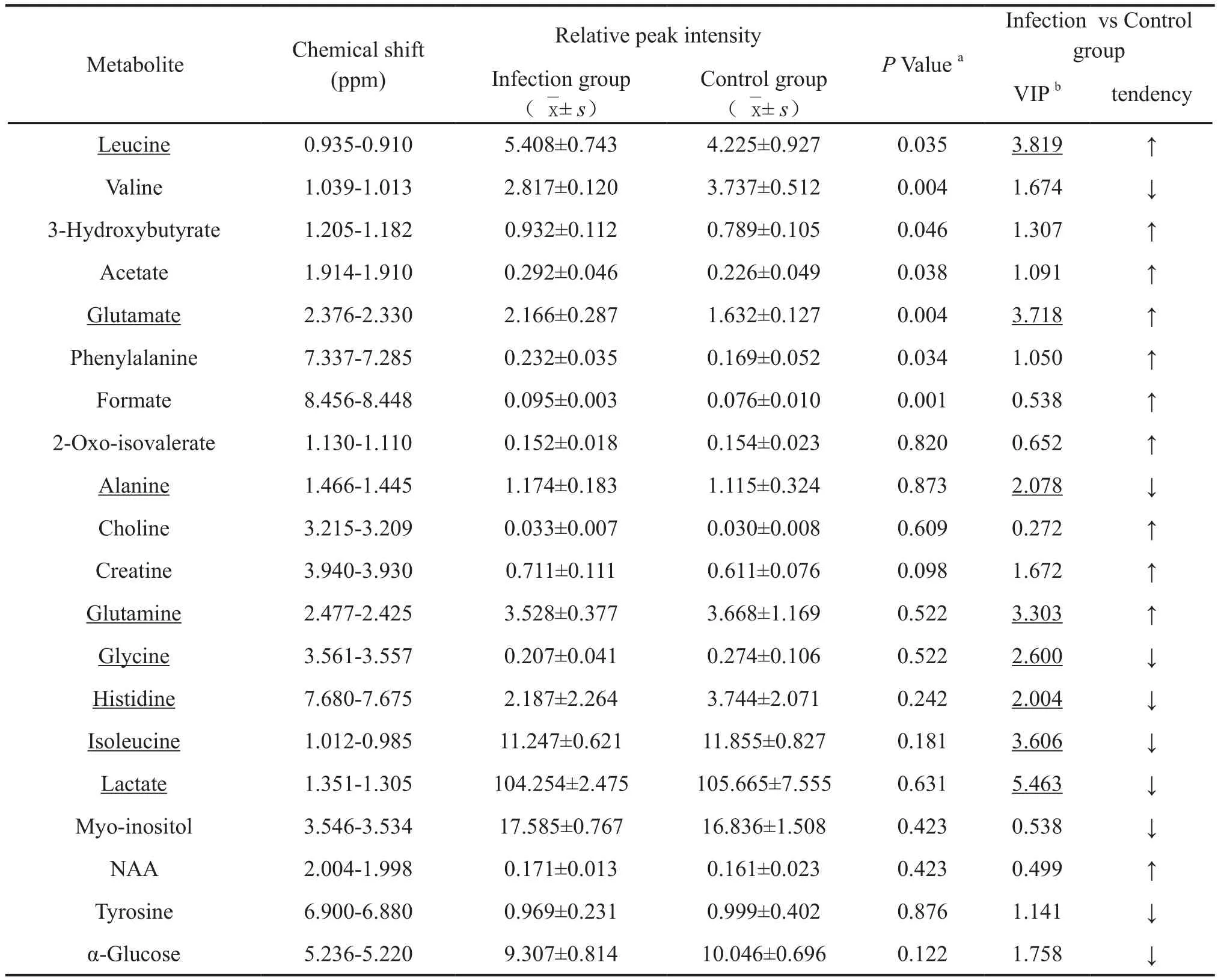
表1 细胞培养液水相代谢产物浓度Tab.1 Concentration of metabolites in the aqueous phase of the culture media
讨 论
依靠变量重要性投影分析,与正常对照细胞相比,感染HSV-1的 OL细胞培养液水相中有8种物质发生了明显的改变 :亮氨酸、谷氨酸、谷氨酰胺(含量呈升高趋势),丙氨酸、甘氨酸、组氨酸、异亮氨酸、乳酸(呈降低趋势)。
1 氨基酸
在8种发生明显改变的物质中,有7种都属于氨基酸,这与以前LC–MS检测到HSV-1感染细胞导致氨基酸改变是一致的[12,13]。值得注意的是在这些发生改变的氨基酸中,有4种氨基酸:谷氨酸、谷氨酰胺、甘氨酸、组氨酸都属于神经递质[14,15],曾有研究表明嗜神经病毒感染与中枢神经系统递质异常有关[16]。
谷氨酸、甘氨酸分别是中枢神经系统重要的兴奋性和抑制性递质。生理情况下,谷氨酸和甘氨酸对突触传递、突触可塑性和脑发育起着重要作用[1,17]。但是,谷氨酸增多、甘氨酸降低会导致神经系统兴奋性异常,这可能是HSV-1诱导癫痫发作的原因[18-21]。此外,谷氨酸增多是一种强有力的兴奋性神经毒素,可引起神经细胞凋亡[22],在本试验中,我们观察到被HSV-1感染的OL细胞表现出明显的细胞病变效应。与谷氨酸密切联系的谷氨酰胺,是体内细胞外最丰富的氨基酸,通过谷氨酰胺-谷氨酸循环在谷氨酸神经递质传递中起着关键的作用[23]。本实验中,增多的谷氨酸和谷氨酰胺表明HSV-1感染扰乱了谷氨酰胺-谷氨酸循环,产生异常的兴奋性[24,25],这可能跟HSV-1诱导癫痫发作有关。组胺是一种中枢神经递质,与认知、觉醒、昼夜节律和摄食节律有关[26],组氨酸是合成组胺的前体物质,但目前无HSV-1感染与组胺功能障碍的相关报道。
亮氨酸、异亮氨酸是必需氨基酸,属于支链氨基酸。 异亮氨酸广泛参与机体的新陈代谢,容易被脑吸收[27]。异亮氨酸和亮氨酸通过转氨作用与α-酮戊二酸生成谷氨酸[28]。异亮氨酸和亮氨酸也可通过生成乙酰进入三羧酸循环[28],以前曾有报道证实单纯疱疹病毒干扰了宿主细胞糖酵解和三羧酸循环路径[13]。
丙氨酸已被证实是脑组织中神经元和神经胶质细胞之间的代谢偶联剂[29]。神经胶质细胞向神经元输送的丙氨酸有助于维持神经元的线粒体氧化还原电位。NH4
+和谷氨酸促使神经胶质细胞合成和释放丙氨酸,产生糖酵解。因此,本实验中增高的丙氨酸表明糖酵解增强,这与以前的研究是一致的。
2 乳酸
在培养的哺乳动物细胞中,摄入的葡萄糖大部分通过糖酵解转化为乳酸排泄到培养液中,因此可通过葡萄糖消耗量和乳酸产生量的比值来反映葡萄糖含量的变化[13]。在本实验中虽未发现葡萄糖产生明显的变化,但乳酸明显地降低了,与以前研究表明HSV-1感染导致乳酸排泄减少是一致的[13]。降低的乳酸与升高的丙氨酸(丙酮酸的产物)和谷氨酸(三羧酸的产物)表明HSV-1导致参与糖酵解的碳减少了,而增强了三羧酸循环[30]。三羧酸循环是一些氨基酸、脂质和核苷酸前提物质的来源[13],并且有氧路径更利于ATP的生成,这表明HSV-1操纵了上述细胞通路,有助于病毒的复制。
本研究中运用1H NMR代谢组学方法监测感染HSV-1的OL细胞和正常对照OL细胞培养液水相代谢物的不同。通过比较,两组代谢物在七种氨基酸和乳酸的含量有显著的统计学差异,表明HSV-1感染改变了氨基酸在人少突胶质细胞中的代谢。为了满足自身复制的需要,HSV-1感染可能扰乱了宿主细胞的代谢路径,也影响了神经系统的功能活动。通过对HSV-1感染导致细胞外液代谢物变化的阐述,也为以后研究HSV-1致病机制提供了方向。
[1] Kennedy PG, Chaudhuri A. Herpes simplex encephalitis. J Neurol Neurosurg Psychiatry, 2002, 73(3)∶ 237-238.
[2] Steiner I, Kennedy PG, Pachner AR. The neurotropic herpes viruses∶ herpes simplex and varicella-zoster. Lancet Neurol, 2007, 6(11)∶ 1015-1028.
[3] Raschilas F, Wolff M, Delatour F, et al. Outcome of and prognostic factors for herpes simplex encephalitis in adult patients∶ results of a multicenter study. Clin Infect Dis, 2002, 35(3)∶ 254-260.
[4] Steiner I NP, Wirguin I. Infections and the etiology and pathogenesis of multiple sclerosis. Curr Neurol Neurosci Rep, 2001, 1(3) 271-276
[5] Sugiyama K, Ebinuma H, Nakamoto N, et al. Prominent steatosis with hypermetabolism of the cell line permissive for years of infection with hepatitis C virus. PLoS One, 2014, 9(4)∶ e94460.
[6] Birungi G, Chen SM, Loy BP, et al. Metabolomics approach for investigation of efects of dengue virus infectiogeneon using the EA.hy926 cell line. J Proteome Res, 2010, 9(12)∶6523-6534.
[7] Nicholson JK, Wilson ID. Opinion∶ understanding ‘global’systems biology∶ metabonomics and the continuum of metabolism. Nat Rev Drug Discov, 2003, 2(8)∶ 668-676.
[8] Nicholson JK, Lindon JC. Systems biology∶ Metabonomics. Nature, 2008, 455(7216)∶ 1054-1056.
[9] Qian J, Zhai A, Kao W, et al. Modulation of miR-122 on persistently Borna disease virus infected human oligodendroglial cells. Antiviral Res, 2010, 87(2)∶ 249-256.
[10] Ecob-Johnston MS, Whetsell WO. Host-cell response to herpes virus infection in central and peripheral nervous tissue in vitro. J Gen Virol, 1979, 44(3)∶ 747-757.
[11] Marques CP, Hu S, Sheng W, et al. Microglial cells initiate vigorous yet non-protective immune responses during HSV-1 brain infection. Virus Res, 2006, 121(1)∶ 1-10.
[12] Zheng P, Gao HC, Li Q, et al. Plasma metabonomics as a novel diagnostic approach for major depressive disorder. J Proteome Res, 2012, 11(3)∶ 1741-1748.
[13] Vastag L, Koyuncu E, Grady SL, et al. Divergent efects of human cytomegalovirus and herpes simplex virus-1 on cellular metabolism. PLoS Pathog, 2011, 7(7)∶ e1002124.
[14] Aguilar E, Tena-Sempere M, Pinilla L. Role of excitatory amino acids in the control of growth hormone secretion. Endocrine, 2005, 28(3)∶ 295-302.
[15] Legendre P. The glycinergic inhibitory synapse. Cell Mol Life Sci, 2001, 58(5-6)∶ 760-793.
[16] Huang R, Gao H, Zhang L, et al. Borna disease virus infection perturbs energy metabolites and amino acids in cultured human oligodendroglia cells. PLoS One, 2012, 7(9)∶e44665.
[17] Yang X, Wang Y, Luo J, et al. Protective effects of YC-1 against glutamate induced PC12 cell apoptosis. Cell Mol Neurobiol, 2011, 31(2)∶ 303-311.
[18] Paik SK, Kwak MK, Bae JY, et al. γ-Aminobutyric acid-, glycine-, and glutamate-immunopositive boutons on mesencephalic trigeminal neurons that innervate jaw-closing muscle spindles in the rat∶ ultrastructure and development. J Comp Neurol, 2012, 520(15)∶ 3414-3427.
[19] Lee EA, Cho JH, Choi IS, et al. Presynaptic glycine receptors facilitate spontaneous glutamate release onto hilar neurons in the rat hippocampus. J Neurochem, 2009, 109(1)∶275-286.
[20] Sierra-Paredes G, Sierra-Marcuño G. Extrasynaptic GABA and glutamate receptors in epilepsy. CNS Neurol Disord Drug Targets, 2007, 6(4)∶ 288-300.
[21] Wu HM, Huang CC, Chen SH, et al. Herpes simplex virus type 1 inoculation enhances hippocampal excitability and seizure susceptibility in mice. Eur J Neurosci, 2003, 18(12)∶3294-3304.
[22] Castillo CA, León DA, Ballesteros-Yáñez I, et al. Glutamate differently modulates excitatory and inhibitory adenosine receptors in neuronal and glial cells. Neurochem Int, 2010, 57(1)∶ 33-42.
[23] Taylor TJ, Brockman MA, McNamee EE, et al. Herpes simplex virus. Front Biosci, 2002, 7∶ d752-764.
[24] Coulter DA, Eid T. Astrocytic regulation of glutamate homeostasis in epilepsy. Glia, 2012, 60(8)∶ 1215-1226.
[25] Vezzani A, Aronica E, Mazarati A, et al. Epilepsy and brain infammation. Exp Neurol, 2013, 244∶ 11-21.
[26] Passani MB, Blandina P. Histamine receptors in the CNS as targets for therapeutic intervention. Trends Pharmacol Sci, 2011, 32(4)∶ 242-249.
[27] Murín R, Hamprecht B. Metabolic and regulatory roles of leucine in neural cells. Neurochem Res, 2008, 33(2)∶ 279-284.
[28] García-Espinosa MA, Wallin R, Hutson SM, et al. Widespread neuronal expression of branched-chain aminotransferase in the CNS∶ implications for leucine/glutamate metabolism and for signaling by amino acids. J Neurochem, 2007, 100(6)∶ 1458-1468.
[29] Tsacopoulos M, Magistretti PJ. Metabolic coupling between glia and neurons. J Neurosci, 1996, 16(3)∶ 877-885.
[30] Peng L, Hertz L, Huang R, et al. Utilization of glutamine and of TCA cycle constituents as precursors for transmitter glutamate and GABA. Dev Neurosci, 1993, 15(3-5)∶ 367-377.
Study of the metabolomics of glia cells infected by herpes simplex virus type 1
Ma Lihua1, Yang Hongjing1, Xu Xiaoyan1,3, Shi Zhongquan1, Deng Rong2*(1Department of Basic Medicine, Chongqing Three Gorges Medical College, Chongqing 404120, China;2Department of Neurology, Chongqing Three Gorges Central Hospital, Chongqing 404120, China;3Institute of Neuroscience, Chongqing Medical University, Chongqing 400016, China)
ObjectiveTo investigate the efect of herpes simplex virus type 1 (HSV-1) infection on the metabolism of human oligodendroglia cells (OL cells) and explore the molecular mechanism of HSV-1 infection.MethodsOL cells were randomly divided into two groups, the HSV-1 infection group and the normal control group. The metabolites in the aqueous phase of the culture media were extracted and detected by proton nuclear magnetic resonance spectroscopy (1H NMR). The data were analyzed by partial least square discriminant analysis (PLS-DA).ResultsThe metabolic profles of the infection and normal control groups varied signifcantly. In the culture medium of the infection group, the contents of leucine, glutamate and glutamine increased, while those of alanine, glycine, histidine, isoleucine and lactate decreased.ConclusionHSV-1 infection interferes with the amino acid metabolism of OL cells. HSV-1 may impact the metabolic pathway of its host cells to facilitate its own proliferation. It also afects the normal function of the nervous system.
Herpes simplex virus type 1; metabolomics; 1H nuclear magnetic resonance spectroscopy; oligodendroglia cells
R3
A
10.16705/ j. cnki. 1004-1850.2017.02.007
2016-12-09
2017-03-30
重庆市教委科学技术研究项目资助(KJ1402507)
马丽华,女(1979年),汉族,讲师
*通讯作者(To whom correspondence should be addressed):13066030@qq.com
