Flot-2高表达促进食管鳞状细胞癌的生长和侵袭
2017-06-23李莉娜肖鹏王云峰王翠莲
李莉娜,肖鹏,王云峰,王翠莲
(长治医学院病理学教研室,长治 046000)
Flot-2高表达促进食管鳞状细胞癌的生长和侵袭
李莉娜*,肖鹏,王云峰,王翠莲
(长治医学院病理学教研室,长治 046000)
目的探究fotillin-2(Flot-2)在人食管鳞状细胞癌中的表达及基本功能。方法利用免疫组织化学技术检测76例人食管鳞状细胞癌组织及相应癌旁组织中Flot-2的免疫反应阳性水平,并分析其与食管鳞状细胞癌的相关性。以小分子siRNA降低人食管鳞状细胞癌细胞系KYSE150细胞中Flot-2表达后,利用CKK-8及Transwell小室实验,检测细胞生长和侵袭能力的变化。结果Flot-2在人食管鳞状细胞癌组织中免疫反应性明显升高,其在转移组织中的免疫反应水平显著高于非转移组织。敲低Flot-2表达后,KYSE150细胞的生长和侵袭能力明显降低。结论Flot-2能促进细胞的生长和侵袭,参与人食管鳞状细胞癌的发生与转移过程。
Flotillin-2;食管鳞状细胞癌;转移
食管癌恶性程度高,五年生存率低,其致死率在全球恶性肿瘤致死率中位列第八。在中国等发展中国家,鳞状细胞癌为食管癌的主要病理类型。在我国其发病率和致死率位居各类恶性肿瘤前列,已成为严重影响我国人民群众生命健康的重大疾病[1]。因此,深入研究食管癌,特别是食管鳞状细胞癌的分子病理机制意义重大。
Flotillins是一类重要的脂筏蛋白,是细胞膜表面脂筏结构的重要组成成分,包含fotillin-1(Flot-1)和fotillin-2(Flot-2)两个成员,在细胞信号传导,物质运输等过程中发挥重要作用,参与细胞连接、细胞恶性转化等一系病理生理进程的调节[2]。Flot-1和Flot-2已被证实参与肺癌、口腔癌、胃癌、鼻咽癌等肿瘤的恶性进程[3-7]。对Flot-1与食管癌关系的研究发现,Flot-1在食管鳞状细胞癌组织和细胞中高表达,并能促进食管鳞状细胞癌细胞的生长[8]。Flotillins蛋白之间能形成异源或同源二聚体,是其稳定和发挥作用的结构基础[2]。因此,作为另一个fotillins,Flot-2在食管鳞状细胞癌是否存在类似于Flot-1的表达水平和功能,目前尚不清楚。本研究观察了Flot-2在人食管鳞状细胞癌中的表达及降低人食管鳞状细胞癌细胞系KYSE150细胞中Flot-2表达对该细胞系生长和侵袭的影响。
材料和方法
1 临床标本与细胞系
收集长治医学院附属和平医院病理科2016年1月至5月手术切除的食管鳞状细胞癌患者的癌组织和癌旁组织标本蜡块,共76对。所有病例术前均无化疗、放疗及免疫治疗史。人食管鳞状细胞癌细胞系KYSE150细胞购自中南大学细胞中心。
2 试剂
SP法免疫组织化学试剂盒及DAB显示试剂盒均购自福州迈新生物技术有限公司,Flot-2兔多抗、GAPDH兔多抗及相应的二抗购自武汉三鹰生物技术有限公司。Flot-2 siRNA(si-Flot-2)和对照siRNA(si-NC)由广州锐博生物科技有限公司合成,Flot-2 siRNA序列为5’-ATGACAAAGTGGACTATCT-3’[7]。RPMI-1640、胎牛血清和0.25%胰蛋白酶购自以色列BI公司, LipofectamineTM2000和Transwell 小室购自美国Thermo公司,ECL显色液购自Millipore,RIPA蛋白裂解液、5×SDS上样缓冲液、CCK-8购自南京诺唯瓒生物有限公司。
3 免疫组织化学染色
组织蜡块4μm切片,柠檬酸缓冲液高压修复3min,Flot-2抗体的工作浓度1∶100,详细步骤按照SP试剂盒说明书操作。阳性对照取乳腺癌组织,阴性对照用PBS代替一抗设立。结果判断标准:先按阳性细胞占上皮细胞或肿瘤细胞的百分比计分:无阳性细胞为0分,阳性细胞≤10%计1分,11%~50%计2分,51% ~ 75%计3分,>75%计4分;再按染色强度计分:浅黄色计1分,棕黄色计2分,棕褐色计3分。以两者乘积为最后得分:0~3分为阴性或弱阳性,4~6为阳性,6~12分为强阳性。
4 细胞转染
转染前24h,将KYSE150细胞消化接种于6孔板中,使第二天转染时,细胞汇合度在70%左右。根据LipofectamineTM2000说明书,制备si-Flot-2脂质体混合液及相应的si-NC脂质体混合液,室温静置20min;随后将混合好的siRNA脂质体悬液均匀滴加至细胞中,继续培养6h后更换培养基;48h后,抽提细胞总蛋白,检测Flot-2敲低效率。
5 Western blot
处于对数生长期的细胞,经PBS漂洗后,加入适量RIPA蛋白裂解液,于冰上裂解30min后,用细胞刮将细胞裂解液刮下,经超声破碎,低温高速离心后,得到细胞总蛋白。经SDS-PAGE(聚丙烯酰胺凝胶)电泳、转膜、封闭、一抗和二抗孵育后,进行ECL化学发光显色,利用Gel-Pro analyzer软件分析条带灰度值,经内参校正后,比较蛋白表达差异。
6 CCK-8实验
将分别转染si-Flot-2和si-NC的KYSE150细胞,按照2000个/孔的密度接种于96孔板,于接种后24h、48h、72h、96h,按10μl CCK-8/孔(每孔含100μl培养基)的比例,加入CCK-8溶液,每组设置5个复孔,37℃孵育1h后,于酶标仪(Epoch,Bio Tek公司)450nm波长下,检测每孔的吸光值,计算细胞生长速率。
7 Transwell侵袭实验
按2.5×104个/孔的密度,将分别转染si-Flot-2和si-NC的KYSE150细胞,接种于包被有基质胶(Matrigel)的Transwell小室中(细胞悬液总体积保持在500μl),下层为750μl 5%FBS+RPMI1640培养基,保证小室和下层培养基的接触面没有气泡,正常培养48h后,弃培养基,经缓冲液清洗、甲醇固定后,0.1%结晶紫染色20min,自来水冲洗干净后,用棉签小心刮掉上层膜侧未穿过的细胞,于倒置显微镜下观察细胞穿过情况,每组设置3个复孔,每孔随机选取5个视野,计数穿过细胞数,以平均数作为此孔的细胞穿过数,取3个复孔的细胞穿过数进行统计学分析。
8 统计学分析
利用SPSS 18.0 统计分析软件进行数据分析,免疫组化结果采用Kruskal-Wallis H 检验比较组间总体差异,Nemenyi秩和检验比较组间相互差异。计量资料以均数±标准差(s)表示,采用两样本t检验比较实验组和对照组间的差异, P< 0.05为差异有统计学意义。
结 果
1 食管鳞状细胞癌组织中Flot-2免疫反应性增强
免疫组织化学检测显示,Flot-2免疫反应产物主要定位于食管鳞状细胞癌癌组织和配对癌旁组织细胞质和细胞膜。Flot-2在鳞状细胞癌组织中的免疫反应性明显强于相应癌旁组织 (图1A,图1B,表1)。对Flot-2在无淋巴结转移和有淋巴结转移的食管鳞状细胞癌中的免疫反应性比较发现,相较于无淋巴结转移的食管鳞状细胞癌组织,Flot-2在发生淋巴结转移的食管鳞状细胞癌组织中的免疫反应性更强(图1C,表1),提示Flot-2可能参与食管鳞状细胞癌的转移过程。
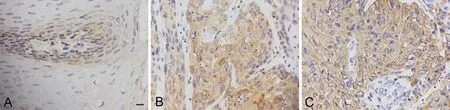
图1 食管鳞状细胞癌及癌旁组织中Flot-2的免疫组织化学表达。A,癌旁组织中;B,无转移的食管鳞状细胞癌组织;C,有转移的食管鳞状细胞癌组织;比例尺,100μmFig. 1 Immunohistochemical expression of Flot-2 in ESCC tissue and adjacent tissue. A, adjacent tissue; B, non-metastatic ESCC tissue; C, metastatic ESCC tissue; scale bar, 100μm
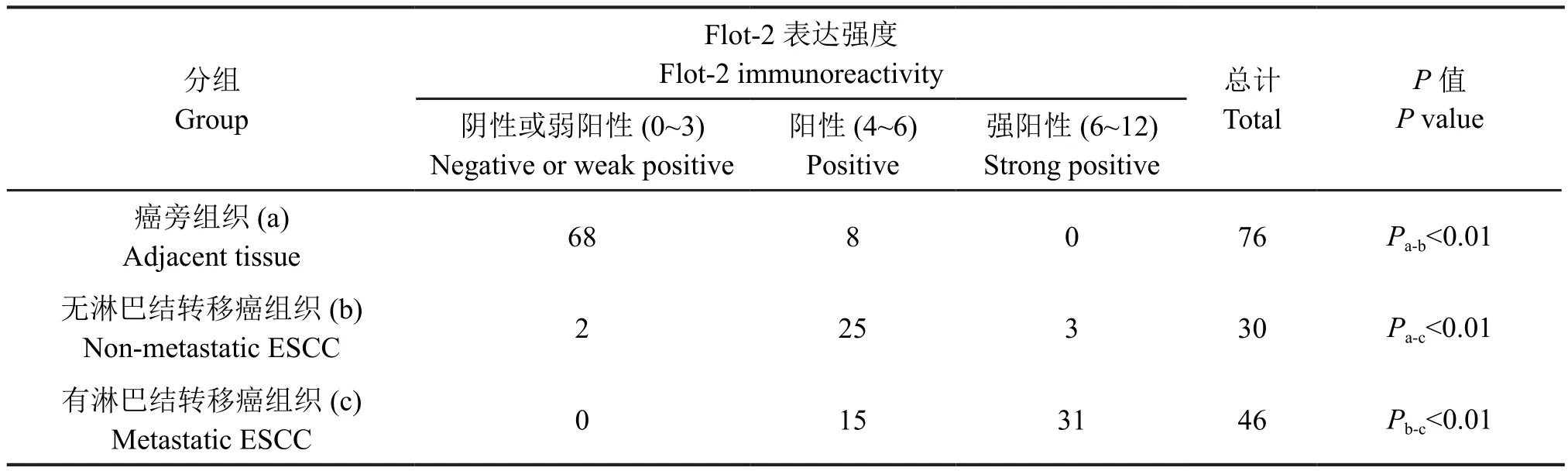
表1 Flot-2在食管鳞状细胞癌组织和癌旁组织中的免疫反应性比较Tab. 1 Comparison of Flot-2 immunoreactivity in ESCC tissue and adjacent tissue
2 沉默Flot-2抑制KYSE150细胞生长和侵袭
为了探讨Flot-2在人食管鳞状细胞癌中的作用,利用脂质体转染技术,将靶向Flot-2的si-Flot-2和相应的对照siRNA(si-NC)转入人食管鳞状细胞癌细胞系KYSE150细胞,建立低表达Flot-2的细胞模型。收集转染si-RNA 48h后的KYSE150细胞,提取总蛋白,进行Flot-2蛋白水平的免疫印记检测。结果显示,与未转染siRNA的空白细胞和转染si-NC的细胞相比,转染si-Flot-2的KYSE150细胞中,Flot-2d蛋白水平明显降低(图2),表明成功建立了敲低Flot-2的KYSE150细胞模型。

图2 Western blot检测Si-Flot-2沉默KYSE150细胞中Flot-2表达Fig. 2 Western blot detection of the efciency of Flot-2 knockdown in KYSE150 cells by Si-Flot-2
利用CCK-8实验检测沉默Flot-2的KYSE150细胞生长速率,结果显示:与转染si-NC的细胞相比,转染si-Flot-2的细胞生长速率明显减慢,在转染72h和96h后差异尤其显著(图3)。由此提示,Flot-2可能通过促进人食管鳞状细胞癌细胞的生长而参与肿瘤进程。
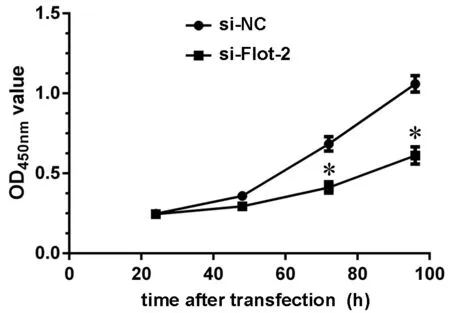
图3 沉默Flot-2抑制KYSE150细胞的生长速率。*,与转染si-NC的细胞比较,P <0.01Fig. 3 Statistical analysis for the effect of Flot-2 knockdown on the proliferative rate of KYSE150 cells detected by CCK-8. *, P<0.01, compared with cells transfected with si-NC
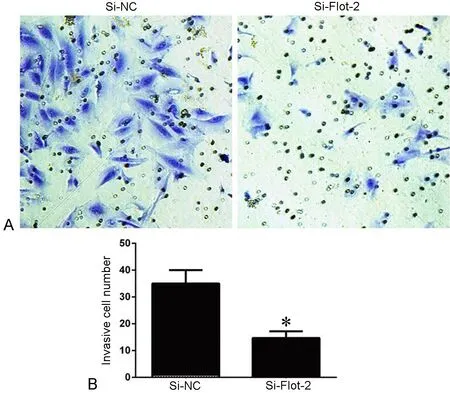
图4 沉默Flot-2对KYSE150细胞侵袭力的影响。A, 穿过Transwell膜细胞的结晶紫染色;B,穿过Transwell膜的细胞数统计学分析; *,与转染si-NC细胞比较,P <0.01Fig. 4 The efect of Flot-2 knockdown on the invasion ability of KYSE150 cells detected by Transwell assay. A, crystal violet staining of the cells having migrated through the Transwell membrane; B, statistical analysis for the number of cells having migrated through the Transwell membrane; *, P<0.01, compared with cells transfected with si-NC
利用Transwell小室实验对沉默Flot-2对KYSE150细胞侵袭能力检测显示,与转染si-NC的对照细胞相比,抑制Flot-2表达后,KYSE150细胞消化基质胶、穿过小室的细胞数目明显降低(35.00 ± 2.89 vs 14.67 ± 1.45, P < 0.05),细胞的侵袭能力显著降低(图4)。因此,Flot-2可能通过促进人食管鳞状细胞癌细胞的侵袭而参与其转移进程。
讨 论
脂筏是细胞表面信号分子聚集的超微结构,是细胞信号汇集、整理和传导的分子平台[9]。Flot-2作为重要的脂筏结构蛋白,在上述过程中发挥重要作用。已知Flot-2与神经再生分化、细胞内吞、细胞增殖、胰岛素信号传导等生命过程密切相关,其表达异常与包括肿瘤在内的多种病理过程相关[2,10-12]。目前,Flot-2已被证实在多种实体肿瘤中表达异常升高,且与肿瘤早期诊断、转移及预后判断等因素相关。例如:在乳腺癌和非小细胞肺癌中,Flot-2异常活化与乳腺癌的病理分期、转移能力呈正相关,与患者生存期呈负相关[5,13-15];在宫颈癌及肾细胞癌等肿瘤中,Flot-2呈渐行性升高[16,17];Flot-2的表达水平,可以作为鼻咽癌淋巴结转移的分子标记[18];在口腔鳞状细胞癌及胃癌等消化道相关肿瘤中,Flot-2同样与肿瘤生长、转移等密切相关[4,19]。基于Flot-2在肿瘤中的关键作用,在本研究中,我们检测了其在食管鳞状细胞癌中的水平,结果显示Flot-2在食管鳞状细胞癌中的水平明显升高,且在存在淋巴结或远端转移的组织中更高。由此提示,Flot-2可能作为人食管鳞状细胞癌早期诊断和靶向治疗的潜在靶标。
已有研究显示,Flot-2促进肿瘤进程的主要分子机制是促进肿瘤细胞生长和侵袭。降低Flot-2的表达,能抑制Akt/FOXO等信号轴的活性,进而抑制乳腺癌的生长、迁移和侵袭[14];在鼻咽癌中,降低5-8F细胞中Flot-2的表达,能抑制Akt3/NF-kB通路的活性,进而抑制其侵袭和转移[7];降低Flot-2表达,同样能抑制胃癌细胞的生长、迁移和侵袭能力[20]。本研究中,我们同样探讨了Flot-2对人食管癌鳞状细胞癌细胞生长和侵袭能力的影响。在SiRNA下调Flot-2表达后,KYSE150细胞的生长和侵袭能力均受到明显抑制,由此提示Flot-2可以通过促进人食管鳞状细胞癌细胞的生长和侵袭,而促进其发生和转移。
[1] 赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策. 中国癌症杂志, 2011(7):501-504.
[2] Bodin S, Planchon D, Rios Morris E ,et al. Flotillins in intercellular adhesion - from cellular physiology to human diseases. J Cell Sci, 2014,127(Pt 24)∶ 5139-5147.
[3] Gao W, Xu J, Wang F, et al. Plasma membrane proteomic analysis of human Gastric Cancer tissues∶ revealing fotillin 1 as a marker for gastric cancer. BMC cancer, 2015,15∶ 367.
[4] Wen Q, Alnemah MM, Luo J, et al. FLOT-2 is an independent prognostic marker in oral squamous cell carcinoma. Int J Clin Exp Pathol, 2015, 8(7)∶ 8236-8243.
[5] Wang YL, Yao WJ, Guo L, et al. Expression of fotillin-2 in human non-small cell lung cancer and its correlation with tumor progression and patient survival. Int J Clin Exp Pathol, 2015, 8(1)∶ 601-607.
[6] Zhao L, Lin L, Pan C, et al. Flotillin-2 promotes nasopharyngeal carcinoma metastasis and is necessary for the epithelial-mesenchymal transition induced by transforming growth factor-beta. Oncotarget, 2015, 6(12)∶ 9781-9793.
[7] Liu J, Huang W, Ren C, et al. Flotillin-2 promotes metastasis of nasopharyngeal carcinoma by activating NF-kappaB and PI3K/Akt3 signaling pathways. Sci Rep, 2015, 5∶11614.
[8] Song L, Gong H, Lin C, et al. Flotillin-1 promotes tumor necrosis factor-alpha receptor signaling and activation of NF-kappaB in esophageal squamous cell carcinoma cells. Gastroenterology, 2012, 143(4)∶ 995-1005.
[9] Mollinedo F, Gajate C. Lipid rafts as major platforms for signaling regulation in cancer. Adv Biol Regul, 2015, 57∶130-146.
[10] Park MY, Kim N, Wu LL, et al. Role of flotillins in the endocytosis of GPCR in salivary gland epithelial cells. Biochem Biophys Res Commun, 2016, 476(4)∶ 237-244.
[11] Koch JC, Solis GP, Bodrikov V, et al. Upregulation of reggie-1/fotillin-2 promotes axon regeneration in the rat optic nerve in vivo and neurite growth in vitro. Neurobiol Dis, 2013, 51∶ 168-176.
[12] Banning A, Kurrle N, Meister M, et al. Flotillins in receptor tyrosine kinase signaling and cancer. Cells, 2014, 3(1)∶ 129-149.
[13] Wen Q, Wang W, Chu S, et al. Flot-2 Expression Correlates with EGFR Levels and Poor Prognosis in Surgically Resected Non-Small Cell Lung Cancer. PloS One, 2015,10(7)∶e0132190.
[14] Xie G, Li J, Chen J ,et al. Knockdown of fotillin-2 impairs the proliferation of breast cancer cells through modulation of Akt/FOXO signaling. Oncol Rep, 2015, 33(5)∶ 2285-2290.
[15] Wang X, Yang Q, Guo L, et al. Flotillin-2 is associated with breast cancer progression and poor survival outcomes. J Transl Med, 2013,11∶ 190.
[16] Liu Y, Lin L, Huang Z, et al. High expression of fotillin-2 is associated with poor clinical survival in cervical carcinoma. Int J Clin Exp Pathol, 2015, 8(1)∶ 622-628.
[17] Yan Y, Yang FQ, Zhang HM, et al. Up-regulation of fotillin-2 is associated with renal cell carcinoma progression. Tumour Biol, 2014, 35(10)∶ 10479-10486.
[18] Wen Q, Li J, Wang W, et al. Increased expression of fotillin-2 protein as a novel biomarker for lymph node metastasis in nasopharyngeal carcinoma. PloS One, 2014, 9(7)∶e101676.
[19] Zhu Z, Wang J, Sun Z, et al. Flotillin2 expression correlates with HER2 levels and poor prognosis in gastric cancer. PLoS One, 2013, 8(5)∶ e62365.
[20] Cao K, Xie D, Cao P, et al. SiRNA-mediated flotillin-2 (Flot2) downregulation inhibits cell proliferation, migration, and invasion in gastric carcinoma cells. Oncol Res, 2014, 21(5)∶ 271-279.
High expression of Flot-2 promotes the development and invasion of esophageal squamous cell carcinoma
Li Lina*, Xiao Peng, Wang Yunfeng, Wang Cuilian
(Department of Pathology, Changzhi Medical College, Changzhi 046000)
ObjectiveTo explore the expression and functions of fotillin-2 (Flot-2) in human esophageal squamous cell carcinoma (ESCC).MethodsThe immunoreactivity of Flot-2 in the cancerous and adjacent tissue from 76 ESCC cases was detected by immunohistochemistry, and its correlation with ESCC was analyzed. Small RNA interference (siRNA) was applied to reduce the expression of Flot-2 in KYSE150 ESCC cells, after which the proliferation and invasion abilities of KYSE150 cells were examined by CCK-8 and Transwell tests.ResultsFlot-2 immunoreactivity was signifcantly higher in ESCC tissue than in adjacent tissue, and in metastatic ESCC than in non-metastatic ESCC. The proliferation and invasion abilities of KYSE150 cells were obviously inhibited after Flot-2 knockdown.ConclusionFlot-2 plays a role in the development and metastasis of ESCC by promoting cell proliferation and invasion.
Flotillin-2; esophageal squamous cell carcinoma; metastasis
R730.2
A
10.16705/ j. cnki. 1004-1850. 2017.02.011
2016-11-07
2017-03-30
长治医学院科研启动基金普及项目(201508)
李莉娜,女(1981年),汉族,讲师
*通讯作者(To whom correspondence should be addressed):lilina9825@163. com
