乳腺分泌性癌8例临床病理分析
2017-06-23蔡兆根张琼于东红郭冰沁赵艳
蔡兆根,张琼,于东红,郭冰沁,赵艳
(蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,蚌埠 233030)
病例报道
乳腺分泌性癌8例临床病理分析
蔡兆根*,张琼,于东红,郭冰沁,赵艳
(蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,蚌埠 233030)
目的探讨乳腺分泌性癌(secretory breast carcinoma,SBC)的临床病理特征、免疫组织化学特点、鉴别诊断和预后。方法收集SBC 8 例,对其临床、病理及免疫组织化学资料进行分析及文献复习。结果8例SBC,1例男性,7例女性,发病年龄8~76岁(中位年龄43.2岁)。临床主要表现为无痛性乳房内包块。大体上肿块多数边界清楚,质稍硬,直径0.6~4.0cm;镜下瘤细胞呈实性、微囊状和导管样排列,胞质丰富,嗜酸性颗粒状。瘤细胞胞质内外含有丰富均质的嗜伊红分泌物。阿辛蓝染色呈蓝色,PAS 染色呈红色。核分裂像少见,未见肿瘤性出血及坏死。免疫组织化学:肿瘤细胞主要表达CK7 和S-100蛋白,CK5/6、p63、CEA和CD10绝大多数呈阴性反应,Ki-67 指数相对较低。结论SBC是乳腺癌的一种少见亚型,通常预后较好,形态学需与乳腺粘液癌,富于脂质癌,泌乳腺瘤等相鉴别,确诊依据HE染色形态和免疫组织化学,必要时可结合ETV6-NTRK3 融合基因检测结果。
乳腺肿瘤;分泌性癌;免疫组织化学;鉴别诊断
乳腺分泌性癌(secretory breast carcinoma,SBC)是乳腺浸润性癌中一种少见亚型,由McDivitt 等[1]首次报道,主要发生于青少年,当时称之为幼年性癌。随着成人病例的报道逐渐增多,发现此肿瘤可发生于任何年龄,随后由Tavassoli等[2]正式命名为乳腺分泌性癌。WHO(2003版和2012版)乳腺肿瘤病理学及遗传学分类中将SBC列为乳腺浸润性癌类目下的罕见类型。作者在日常病理诊断中收集8例病例,现结合文献分析其临床病理特征,以提高对该肿瘤的认识。
材料与方法
1 临床病理资料
收集本院病理科 2010年5月至 2016年 11月的外检确诊的SBC 8例,其中常规病例6例,会诊病例2例。女性7例,男性1例;年龄18~76岁,平均43.2岁。临床上均表现为无痛性乳房肿物,无乳头溢液及溢血,肿块位于皮下,1例肿块突向皮肤表面并累及乳头,乳头结构不清。病程从15天到2年不等。4例行彩超检查,显示为形态不规则,边界欠清的低回声区,5例行钼靶X线检查,显示为乳房内实质性占位,其中2例伴BI-RADS 4级(图1)。3例行局部或区段切除,5例为改良根治,其中1例有腋窝淋巴结转移。8例病人中7例获得随访,随访时间为2-67个月,例7复发,其余均未见复发及转移(表1)。
2 方法
肿瘤组织均经10%缓冲福尔马林固定,常规石蜡包埋、切片,厚4μm,常规HE染色和组织化学AB-PAS染色。同时采用SP 法对8例标本的石蜡切片行免疫组织化学染色,具体操作按说明书进行。选用的特异性第一抗体包括抗ER、PR、HER2、CK7、CK5/6、CEA、S-100蛋白、Syn、P53、EGFR、CD10和Ki-67等抗体。以上抗体均购自福州迈新生物技术有限公司。免疫组织化学染色均设立阳性和阴性对照。
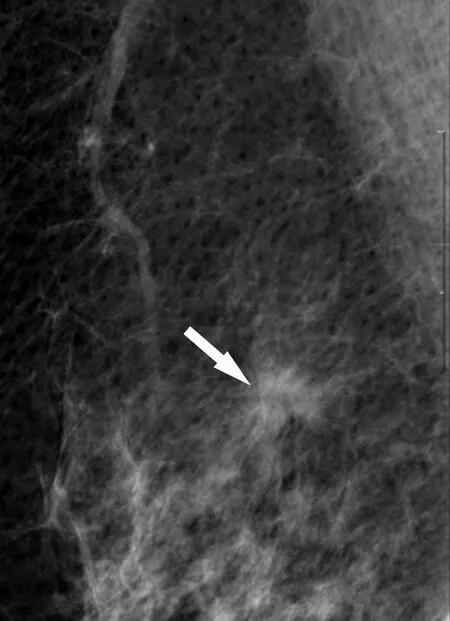
图1 8号病例左乳钼靶X线像。箭头示左乳外上象限见一0.6cm高密度影Fig. 1 Molybdenum-target X-ray imaging of Case 8. The arrow indicates a high density shadow (0.6cm) in the outer upper quadrant of the left breast

表1 8例SBC临床及部分病理资料Tab. 1 Clinical and pathological data of the eight SBC cases
3 结果判定
组织化学阿辛蓝AB染色阳性呈蓝色,过碘酸雪夫PAS阳性呈红色;免疫组织化学阳性反应呈棕黄色,其中CK7、CK5/6、Syn、CEA均为细胞质阳性,S-100蛋白为细胞质与细胞核阳性,CD10、EGFR为细胞质与细胞膜阳性,HER2为细胞膜阳性,ER、PR、P53和Ki-67为细胞核阳性;观察肿瘤细胞丰富、Ki-67阳性肿瘤细胞(定位于细胞核)较多的热点区域,选择10个高倍视野,计算视野内肿瘤细胞中阳性细胞的平均值(%),作为Ki-67增殖指数。
结 果
肉眼观发现,8例SBC标本中,6例为境界清楚的肿块,质地偏硬,切面灰白色,2例境界欠清晰,与周围脂肪组织交错在一起,其中例8肿块因含有粘液且体积小,质地相对较软,从大体表现上易误认为良性病变。瘤体直径0.6~2.5cm,均未见明显出血及坏死。
HE染色检测显示,8例肿瘤组织均呈实性较为松散的巢片状、微囊状及腺管状排列,肿瘤细胞多为胞浆丰富嗜酸性的细胞,核圆形或卵圆形,大小相对一致,部分核染色较深,核仁不明显,部分核染色较淡,可见小核仁。少部分瘤细胞胞浆空淡,可见核偏位细胞,呈印戒样改变(图2A)。瘤细胞异型性较小,核分裂象少见,未见出血及坏死。瘤细胞质内外或腺腔内可见大量红染均质物质,部分区域浓缩呈小球状(图2B)。肿瘤细胞巢之间为宽窄不等的纤维结缔组织分隔,部分区域间质广泛纤维化透明变性。例8因间质有较多粘液而呈疏松黏液样,但仍可见少数嗜伊红小球。
免疫组织化学染色显示,8例 SBC均呈CK7和S-100蛋白阳性,CK7和S-100蛋白在癌细胞中弥漫性分布(图2C);ER在乳腺分泌性癌中表达较低,8例中仅2例癌细胞核部分区域阳性;PR在本组病例中4例癌细胞轻到中等程度阳性,比较相关文献,其表达率较高;癌基因HER2 在本组病例中2例癌细胞膜部分区域呈中等程度阳性;EGFR在8例SBC中的2例有部分区域癌细胞胞质及胞膜呈现轻到中等程度阳性;p53蛋白无1例阳性,说明SBC癌细胞无突变型p53蛋白的积聚。肌上皮标记物CK5/6和CD10在8例SBC中均未见表达,仅2例癌组织小灶性区域CK5/6轻度阳性,癌组织周边残留的正常乳腺导管肌上皮CK5/6和CD10阳性。CEA 仅见于2例癌组织腺腔样结构的内缘及部分分泌物中阳性;Syn在8例中有2例见癌细胞胞质轻-中等程度着色;Ki-67可见散在少数细胞核阳性免疫反应, 增殖指数约6%~10%,较非特殊型浸润性癌和浸润性小叶癌低,仅例8癌组织局部区域增殖指数高达30%(图2D)。鉴于S100蛋白在常见的乳腺浸润性导管癌和小叶癌中阴性,在其他少见及罕见类型的乳腺癌中亦极少阳性,因此可作为SBC相对特异的诊断标记物,同时对于乳腺癌具有预后指示意义的两种标记物Ki-67和p53蛋白在SBC中的低表达和无表达也指示其较好的预后。

图2 乳腺分泌性癌病理学特征的HE染色、免疫组织化学与组织化学检测。A, 部分瘤细胞核染色较淡,可见小核仁,少数呈印戒样(箭头)(HE);B,肿瘤组织排列成微囊状,分泌物浓缩成致密的嗜酸性小球(箭头)(HE);C, 肿瘤细胞S-100免疫染色阳性;D, 第8号病例肿瘤细胞增殖指数Ki-67免疫染色阳性(约30%);E, 组织化学AB染色显示瘤组织内分泌物呈蓝色。比例尺,100μmFig.2 SBC pathological features detected by HE staining (A, B), immunohistochemistry (C, D) and histochemistry (E). A, light nuclear staining and small nucleoli were observed in some tumor cells; a few signet ring-like cells (arrow) were present; B, the tumor cells were in a microcystic arrangement and contained condensed eosinophilic bodies of secretions (arrow); C, the tumor cells were S-100 positive; D, Case 8 was Ki-67 positive (~30%); E, tumor tissue secretions were stained blue by AB staining; scale bar, 100μm

表2 8例SBC免疫表型Tab. 2 Immuophenotyping of the eight SBC cases
经阿辛蓝AB染色和过碘酸雪夫PAS染色发现,8例肿瘤细胞内、细胞间、微囊性结构内均质红染或淡粉染的分泌物均可见AB阳性反应(图2E),部分PAS 阳性反应。AB和PAS阳性提示肿瘤的分泌性特征,分泌物为酸性粘多糖,中性粘液,少数为糖原成分。
讨 论
SBC是一种特殊类型的乳腺癌,相对少见,相关文献报道其发病率低于1.5‰[3]。儿童和成人均可发病,发病年龄3~87岁,大多数为成年女性,中位年龄40岁,男女发病数之比约为1∶6,男性病例相对少见且多为青少年[4-6]。临床上主要表现为生长缓慢、边界清楚、活动度好的无痛性乳房内肿块。肿物多位于外上象限,也可发生于其他象限。青春期前的患者及男性患者因乳房组织较小,常发生于乳晕下,并伴乳头溢液。肿块多为单个,平均直径为3.0cm(0.5~12.0cm)。腋窝淋巴结转移不常见,有淋巴结转移者主要为成人,儿童和青少年罕见淋巴结转移[6];相关文献报道其转移率小于30%,如有转移一般不超过4枚[7]。本组报道的8例临床表现与文献报道基本一致,其中例1为青少年男性且伴有淋巴结转移(2/17),与Dali Li等报道的结果相似[3]。
SBC的组织学形态主要有3 种构成模式∶ 微囊状、小管状及实性片状,常为3种结构的混合形态。瘤细胞主要由两型细胞组成,A型细胞:多边形,核圆形或椭圆形,染色质中等,常见小核仁,胞质丰富,嗜酸性颗粒状;B型细胞:胞质空淡,部分胞质呈空泡状,细胞核偏向一侧呈印戒样。瘤细胞异型性小,核分裂像少见,罕见瘤体内出血及坏死。肿瘤细胞内外常见丰富红染的嗜酸性分泌物,AB和PAS 染色常为阳性。瘤巢间为透明变性的纤维间质所分隔。少数情况下可见乳头状和大囊结构。电镜下,瘤细胞腔面见微绒毛突起,腔内可见高电子密度的圆形小体,部分肿瘤细胞质内见较多膜分泌泡。肿瘤细胞间含桥粒和连接复合体结构[8]。 本组8例HE主要呈混合形态模式,局灶可见乳头状结构;瘤细胞以A型细胞成分为主,少数为B型细胞成分,细胞内外均可见AB和PAS 染色阳性分泌性物质,形态学及组织化学均符合SBC特点。
SBC癌细胞表达CK、CK8/18、CK7、EMA、S100蛋白和α-乳清蛋白,少数表达p53、CK5/6、CD117、GCDFP-15和(或)EGFR,个别SMA和p63阳性,ER、PR或HER2通常阴性或低表达,Ki-67增殖指数相对较低(<10%)[3]; STAT5a在SBC中过表达而在其他浸润性乳腺癌中表达缺失,其可作为SBC的一种相对特异性的标记物[9]。总结免疫组织化学指标,相对具有诊断意义的标记物为S100蛋白、α-乳清蛋白和STAT5a,具有较好预后指示意义的标记物为p53和Ki-67[9,10]。本组病例免疫组织化学结果与文献报道大致相似,稍有不同之处为例1、3、4、7的ER、PR或HER2染色为阳性,另见例1和例4 Syn阳性,SBC是否亦有神经内分泌物表达,未见相关文献提及。p53均为阴性,除例8的Ki-67增殖指数较高(为30%)外,其余均在10%以内,与文献报道基本一致,提示此种类型乳腺癌的低度恶性特点。
SBC相对少见,需在形态学上与相似的肿瘤相鉴别。①泌乳腺瘤∶ 主要发生在妊娠期或哺乳期,境界清楚,分泌性腺体增生构成的小叶紧密聚集,肌上皮和基底膜存在,可通过免疫组织化学检测肌上皮标记物(如CK5/6,p63,CD10等)鉴别[11]。② 富于脂质的癌:癌细胞异型性明显,胞质丰富而透明呈蜂窝状,PAS 和AB 染色阴性而脂肪染色阳性[12]。③黏液腺癌:有丰富的细胞外黏液,形成大片的黏液湖,肿瘤细胞成小团状漂浮在黏液湖中与SBC不同,且肿瘤细胞常表达神经内分泌标记物(如Syn,CgA,NSE等)[13]。④青少年乳头状瘤病伴大汗腺化生:主要呈乳头状排列,且位于扩张的大导管内,免疫组织化学检测显示肿瘤细胞同时表达肌上皮和腺上皮标记物(如CK7标记腺上皮,CK5/6、p63等标记肌上皮)[14]。⑤囊性高分泌性癌:一种少见的乳腺导管原位癌亚型,其特征是出现大小不等的囊肿,囊内含有类似甲状腺滤泡胶质的嗜酸性分泌物,胞质嗜酸性,常有空泡,细胞核有高度多形性,囊肿间的纤维间质内可见灶性淋巴细胞浸润,HE不难鉴别[15]。⑥乳腺腺泡细胞癌:罕见于乳腺,AB-PAS染色和免疫组织化学有助于区别两者,且SBC具有特征性的ETV6-NTRK3融合基因。⑦非典型性妊娠样增生(PLH):形态上和SBC(形态为分泌型、雌激素受体阴性、孕激素受体阴性)具有一定的相似性,可能是SBC的前驱病变[16]。
通常儿童和青春期SBC患者预后较好,成人预后相对较差。青春期前的SBC复发一般出现在初次手术后20 年,对于无淋巴结转移的成人,肿瘤复发一般发生在术后15 年。该瘤远处转移少见,若肿瘤是多中心,直径>2.0cm,浸润性边界和 >3个淋巴结转移灶,则提示预后较差,远处转移风险增加[17,18]。本组8例均为单发,其中3例肿瘤直径>2.0cm,例1失访,例2无转移及复发,例7复发且为老年人,虽比文献报道的复发时间短,但目前状况尚好,说明SBC与其他类型乳腺癌相比预后较好。
有文献报道,部分SBC具有基底样免疫表型,认为是基底细胞样癌的一种好的预后亚型,然而,总体例数较少,临床意义还不太明确[19,20]。SBC具有特征性的ETV6-NTRK3 融合基因,与部分急性白血病具有相同的基因改变,目前用于治疗白血病的靶向药物PKC412有望用于SBC的治疗,特别是复发和转移的病例[21]。
[1] McDivitt RW, Stewart FW. Breast carcinoma in children. JAMA, 1966, 195(5)∶ 388-390.
[2] Tavassoli FA, Norris HJ. Secretory carcinoma of the breast. Cancer, 1980, 45(9)∶ 2404-2413.
[3] Dali Li, Xiuying Xiao, Wentao Yang, et al. Secretory breast carcinoma∶ a clinicopathological and immunophenotypic study of 15 cases with a review of the literature. Modern Pathology, 2012, 25(4)∶ 567–575.
[4] Sza´nto´ J, Andra´s C, Tsakiris J, et al. Secretory breast cancer in a 7.5-year old boy. Breast, 2004, 13(5)∶ 439–442.
[5] Serour F, Gilad A, Kopolovic J, et al. Secretory breast cancer in childhood and adolescence∶ report of a case and review of the literature. Med Pediatr Oncol, 1992, 20(4)∶341–344.
[6] Vieni S, Cabibi D, Cipolla C, et al. Secretory breast carcinoma with metastatic sentinel lymph node.World J Surg Oncol, 2006, 4∶ 88.
[7] Iglesias B, Monteagudo B, Rouco JS, et al. Secretory breast carcinoma in a 63-year-old man. J Cutan Pathol, 2009, 36(Suppl 1)∶ 86–88.
[8] 刘秋珍,脱朝伟. 乳腺分泌性癌光、电镜的观察. 中国医学影像技术,1993,9(1):75.
[9] Strauss BL, Bratthauer GL, Tavassoli FA. STAT5a expression in the breast is maintained in secretory carcinoma in contrast to other histologic types. Hum Pathol, 2006, 37(5)∶586-592.
[10] Lamovec J and Bracko M. Secretory carcinoma of the breast∶ light microscopical, immunohistochemical and low cytometric Study. Mod Pathol, 1994, 7(4)∶475-479.
[11] 汪颖南,顾依群,王爱春,等. 6 例乳腺泌乳腺瘤的临床病理分析.现代肿瘤医学,2013,21(4):789-791.
[12] 许良中,张廷璆.乳腺病理学. 上海医科大学出版社,1999:183-184.
[13] Ohashi R, Sakatani T, Matsubara M, et al. Mucinous carcinoma of the breast∶ a comparative study on cytohistological findings associated with neuroendocrine differentiation. Cytopathology. 2016, 27(3)∶193-200.
[14] Vaysse C, Charitansky H, Alunni JP, et al. Voluminous juvenile papillomatosis∶ Diagnostic, therapeutic and prognostic difficulties - a case report. Gynecol Obstet Fertil. 2011, 39(1)∶e23-26.
[15] Skalova A, Ryska A, Kajo K, et al. Cystic hypersecretory carcinoma∶ rare and poorly recognized variant of intraductal carcinoma of the breast. Report of fve cases. Histopathology, 2005, 46(1)∶ 43-49.
[16] Popnikolov NK, Yan J, Mendez AB, et al. Pregnancy-like hyperplasia with focal atypia arising within a gynecomastic male breast∶ a case report. Clin Breast Cancer, 2015, 15(2)∶e171-175.
[17] Sharma V, Anuragi G, Singh S, et al. Secretory Carcinoma of the Breast∶ Report of Two Cases and Review of the Literature. Case Rep Oncol Med, 2015, 2015∶ 581892.
[18] Tixier H, Picard A, Guiu S, et al. Long-term recurrence of secretory breast carcinoma with metastatic sentinel lymph nodes. Arch Gynecol Obstet, 2011, 283(Suppl 1)∶ 77–78.
[19] Horowitz DP, Sharma CS, Connolly E, et al. Secretory carcinoma of the breast∶ results from the survival, epidemiology and end results database. Breast, 2012, 21(3)∶ 350-353.
[20] Lae´ M, Fre´neaux P, Sastre-Garau X, et al. Secretory breast carcinomas with ETV6-NTRK3 fusion gene belong to the basal-like carcinoma spectrum. Mod Pathol, 2009, 22(2)∶291-298.
[21] Chi H T,Ly B T,Kano Y,et al.ETV6-NTRK3 as a therapeutic target of small molecule inhibitor PKC412. Biochem Biophys Res Commun, 2012, 429(1-2)∶ 87-92.
Secretory carcinoma of the breast: a clinicopathological study of 8 cases
Cai Zhaogen*, Zhang Qiong, Yu Donghong, Guo Bingqin, Zhao Yan
(Department of Pathology, The First Affilliated Hospital of Bengbu Medical College, Bengbu 233030, China)
ObjectiveTo study the clinicopathological features, immunohistochemical characteristics, diferential diagnosis and prognosis of secretory carcinoma of the breast (SBC).MethodsThe clinicopathological data and immunohistochemical information of eight SBC cases were analyzed, and related literature was reviewed.ResultsEight cases, one male and seven female, aged 18-76 years (mean 43.2), the main clinical manifestations being painless breast masses. The masses mostly had clear boundaries, slightly hard texture and 0.6-4.0cm diameters. Histologically, the tumor cells were in a solid, microcystic and ductal arrangement, had abundant cytoplasm, eosinophilic granules, and large amounts of intracellular and extracellular eosinophilic secretions, Alcian blue staining (AB) and periodic acid-Schif (PAS) staining both being positive. Mitotic activity was rare. Hemorrhage and necrosis were not observed. Tumor cell immmunhistochemitry∶ CK7 and S-100 were positive; CK5/6, CEA, p63 and CD10 were negative in almost all cases; Ki-67 index was relatively low.ConclusionSBC is a rare subtype of breast cancer and has relatively good prognoses. Morphologically, it needs to be diferentiated from mucinous carcinoma, lipid rich carcinoma, lactating adenoma, etc. Defnite diagnosis depends on HE morphology and immunohistochemistry. ETV6-NTRK3 fusion gene detection results should be referred to when necessary.
Breast neoplasm; secretory carcinoma; immunohistochemistry; diferential diagnosis
R361
A
10.16705/ j. cnki. 1004-1850.2017.02.012
2016-12-21
2017-04-10
安徽省教育厅自然科学重点项目(KJ2017A236)
蔡兆根,男(1976年),汉族,副教授
*通讯作者(To whom correspondence should be addressed):chzgen@163.com
