亚临床甲状腺功能减退对2型糖尿病患者临床及生化指标的影响
2017-06-21余芳
余芳
[摘要] 目的 探讨亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)对2型糖尿病(type 2 diabetes mellitus,T2DM)患者临床及生化指标的影响。 方法 161例T2DM患者根据促甲状腺激素(TSH)值分为SCH组78例和对照组83例,比较两组的年龄、性别、血压(收缩压SBP、舒张压DBP)、体重指数(BMI)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸(UA)、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)水平的差异。 结果 两组间TC、LDL-C、UA、hs-CRP、Hcy、TSH有统计学差异(P<0.05),两组间年龄、性别、BMI、SBP、DBP、HbA1c、TG、HDL-C、FT3、FT4无统计学差异(P>0.05)。相关分析显示,TSH与TC、LDL-C、UA、hs-CRP、Hcy呈正相关(P<0.05)。二元Logistic回归分析显示LDL-C、UA、hs-CRP、Hcy是SCH发生的独立危险因素(P<0.05)。 结论 合并SCH的T2DM患者更易发生血脂、UA、hs-CRP、Hcy等代谢及炎症指标异常。
[关键词] 亚临床甲状腺功能减退;血脂;尿酸;超敏C反应蛋白;同型半胱氨酸
[中图分类号] R581.2;R587.1 [文献标识码] A [文章编号] 1673-9701(2017)14-0012-03
[Abstract] Objective To explore the effect of subclinical hypothyroidism(SCH) on the clinical and biochemical indexes of type 2 diabetes mellitus(T2DM) patients. Methods 161 patients with T2DM were divided into SCH group(n=78) and control group(n=83) according to the value of thyroid stimulating hormone(TSH). The differences in age, sex, blood pressure(SBP, DBP), body mass index(BMI), glycated hemoglobin(HbA1c), total cholesterol(TC), triglyceride (TG), high density lipoprotein cholesterol(HDL-C), low density lipoprotein cholesterol (LDL-C), uric acid (UA), high sensitivity C response protein(hs-CRP) and homocysteine(Hcy) levels between the two groups were compared. Results There were significant differences in TC, LDL-C, UA, hs-CRP, Hcy and TSH between the two groups(P<0.05). There were no significant differences in age, sex, BMI, SBP, DBP, HbA1c, TG, HDL-C, FT3, FT4 between the two groups(P>0.05). Correlation analysis showed that TSH was positively correlated with TC, LDL-C, UA, hs-CRP and Hcy(P<0.05). Binary Logistic regression analysis showed that LDL-C, UA, hs-CRP and Hcy were independent risk factors of SCH(P<0.05). Conclusion Patients with T2DM combined with SCH were more prone to have abnormalities in metabolic and inflammatory indicators including blood lipids, UA, hs-CRP and Hcy.
[Key words] Subclinical hypothyroidism; Blood lipids; Uric acid; Hypersensitive C-reactive protein; Homocysteine
糖尿病和甲狀腺疾病均是常见的内分泌代谢疾病。研究发现2型糖尿病(type 2 diabetes mellitus,T2DM)患者甲状腺功能异常的发病率明显高于非糖尿病患者[1]。亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)是血清促甲状腺素(thyroid stimulating hormone,TSH)水平升高而游离甲状腺素水平正常,患者没有或几乎没有甲状腺功能减退的相应症状和体征的病理状态。研究显示SCH与T2DM合并发生率约为4%~22.4%[2],且SCH患者存在内皮功能障碍,可加速动脉粥样硬化的进展,是发生心血管事件的独立危险因素[3,4]。本文拟通过观察合并SCH的T2DM患者临床及生化指标变化,探讨SCH对T2DM患者临床及生化指标的影响及其意义。
1 资料与方法
1.1 一般资料
选择2013年1月~2016年12月我院就诊的T2DM患者,均符合1999年WHO诊断标准。排除严重肝肾功能损害、恶性肿瘤、急性脏器功能衰竭、糖尿病酮症、高渗性昏迷等疾病,患者既往无甲状腺疾病史,亦无临床甲减症状或体征,甲状腺B超排除甲状腺炎、甲状腺结节或腺瘤等甲状腺疾病,近期未使用影响甲状腺、血脂、尿酸等代谢的药物。
1.2 研究方法
1.2.1 临床数据收集 所有患者均记录年龄、性别,测量血压(收缩压SBP、舒张压DBP)、身高、体重,计算体重指数(BMI)。
1.2.2 生化指标测定 受试者空腹10 h后采肘静脉血,用离子交换液相层析法测量糖化血红蛋白(HbA1c,东芝G7糖化血红蛋白分析仪,日本),酶比色法测定总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸(UA)、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(Hcy,日立7600生化分析仪,日本),电化学发光法测定血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH,罗氏Cobas 8000电化学发光仪,瑞士)。
1.2.3 受试者分组 以TSH升高、FT3和FT4水平正常者为亚临床甲状腺功能减退症(SCH)组,以TSH、FT3和FT4水平均正常者为对照组,选取161例(SCH组78例,对照组83例)患者纳入观察。
1.3统计学分析
使用SPSS22.0统计学软件进行处理,正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数加四分位间距表示,组间比较采用非参数检验;计数资料采用χ2检验,ABI与其他因素的关系采用Pearson相关分析(数据正态分布)或Spearman秩相关(数据非正态分布),多因素分析采用二元Logistic回归分析,P<0.05表示差异有统计学意义。
2 结果
2.1 两组间临床及生化指标比较
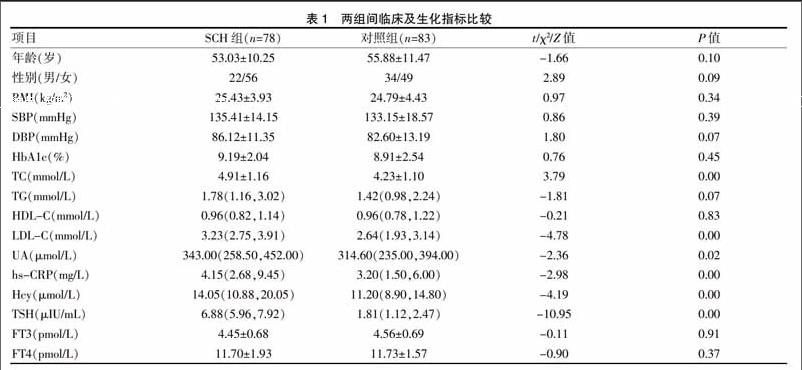
两组间TC、LDL-C、UA、hs-CRP、Hcy、TSH有统计学差异(P<0.05),两组间年龄、性别、BMI、SBP、DBP、HbA1c、TG、HDL-C、FT3、FT4无统计学差异(P>0.05)。见表1。
2.2 TSH与各指标的相关性分析
相关分析显示,TSH与TC、LDL-C、UA、hs-CRP、Hcy呈正相关(相关系数分别为0.252、0.419、0.160、0.235、0.263,P<0.05),TSH与年龄、BMI、SBP、DBP、HbA1c、TG、HDL-C无相关性(相关系数分别为-0.081、0.017、0.006、0.065、0.088、0.087、-0.056,P>0.05)。
2.3 SCH多因素回归分析
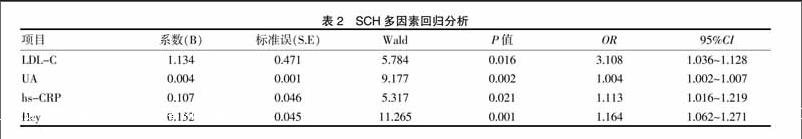
以是否发生SCH为因变量,其他指标为自变量,二元Logistic回归分析显示LDL-C、UA、hs-CRP、Hcy是SCH发生的独立危险因素(P<0.05),见表2。
3讨论
研究显示糖尿病人群中甲状腺疾病的发生率是非糖尿病人群的2~3倍,其中以SCH最为常见[5]。SCH是一种隐蔽而又持久的内分泌代谢疾病,如未得到有效控制,可进一步进展为甲状腺功能减退症。近年来的研究发现SCH可诱导体内炎症反应及高凝状态,并可能通过影响糖脂代谢增加动脉硬化风险,导致心血管事件发生[6,7]。本研究对161例T2DM患者进行分组研究,发现SCH组与对照组间TC、LDL-C、TSH水平有统计学差异,相关分析显示TSH与TC、LDL-C呈正相关。甲状腺激素对维持机体血脂代谢有重要作用,其对TC的影响是双向的,既可上调肝脏内TC的合成,也可促进TC从胆汁中排泄。相对而言,后者的作用较前者更强。故在SCH状态下虽然TC合成减少,但TC排泄降低更多,加之肠内胆固醇的吸收增加,从而导致体内的TC水平上升[8]。SCH影响LDL-C水平的机制可能是甲状腺激素能诱导肝细胞表面LDL-C受体mRNA表达,在SCH状态下患者LDL-C受体活性和数量下降,引起血清中LDL-C摄取和降解减少,最终导致LDL-C水平升高[9,10]。LDL-C可通过受体被巨噬细胞吞噬形成泡沫细胞,最终导致动脉粥样硬化斑块形成[11]。
本研究结果还显示SCH组与对照组间Hcy、hs-CRP、UA水平有统计学差异,相关分析显示TSH与Hcy、hs-CRP、UA呈正相关。Hcy是蛋氨酸循环脱甲基后的衍生物,参与体内多种甲基化反应过程,是独立的心血管事件危險因素。SCH状态下胃酸分泌减少,肠道吸收功能障碍,导致血清叶酸和维生素B12水平下降,同时转甲基酶生成减少,阻断Hcy甲基化途径,导致Hcy在体内蓄积并合成同型半胱氨酸巯基内酯,后者可与LDL结合后被巨噬细胞吞噬,形成泡沫细胞及动脉粥样硬化斑块[12]。另外,Hcy增加可诱导过氧化氢和超氧化物合成增加,加速LDL氧化和血管内皮细胞损伤,并促进平滑肌细胞增殖及血小板黏附聚集,加剧动脉粥样硬化[13]。hs-CRP是反映体内炎症的敏感指标。研究发现hs-CRP与LDL结合后,通过CD32介导途径由巨噬细胞吞噬形成泡沫细胞,导致动脉粥样硬化。另外,hs-CRP可促进血管内皮细胞增殖及迁移,亦可与单核细胞结合后诱导多种细胞因子表达,造成血管内膜损伤,促进动脉粥样硬化形成及进展[14]。UA是嘌呤代谢的终产物,SCH患者代谢下降,但同时肾血流量减少,肾小球滤过下降,最终UA水平升高,进而生成尿酸盐结晶,后者可破坏血管内膜,并可激活中性粒细胞,诱导血小板聚集及纤溶系统紊乱,加速动脉粥样硬化进程[15-19]。
本研究结果显示与单纯T2DM患者比较,合并SCH患者更易发生血脂、UA、hs-CRP、Hcy等代谢及炎症指标异常,上述异常可能会加重糖尿病血管病变的进展。故对于T2DM患者,应注意筛查甲状腺功能,早期发现并及时纠正甲减状态,从而预防和延缓血管并发症的发生和进展。
[参考文献]
[1] Gu Y,Li H,Bao X,et al.The relationship between thyroid function and the prevalence of type 2 diabetes mellitus in euthyroid subjects[J].J Clin Endocrinol Metab,2017, 102(2):434-442.
[2] Papazafiropoulou A,Sotiropoulos A,Kokolaki A.Prevalence of thyroid dysfunction among greek type 2 diabetic patients attending an outpatient clinic[J].J Clin Med Res,2010,20(2):75-78.
[3] Gao CX,Yang B,Guo Q,et al.High thyroid-stimulating hormone level is associated with the risk of developing atherosclerosis in subclinical hypothyroidism[J]. Horm Metab Res,2015,47(3):220-224.
[4] Lu M,Yang CB,Gao L,et al.Mechanism of subclinical hypothyroidism accelerating endothelial dysfunction(Review)[J]. Exp Ther Med,2015,9(1):3-10.
[5] Chubb SA,Davis WA,Inman Z,et al.Prevalence and progression of subclinical hypothyroidism in women with type 2 diabetes:the Fremantle Diabetes Study[J].Clin Endocrinol(Oxf),2005,62(4):480-486.
[6] Klein I,Danzi S.Thyroid disease and the heart[J].Curr Probl Cardiol,2016,41(2): 65-92.
[7] Suh S,Kim DK.Subclinical hypothyroidism and cardiovascular disease[J].Endocrinol Metab(Seoul),2015,30(3):246-251.
[8] Chin KY,Ima-Nirwana S,Mohamed IN,et al.The relationships between thyroid hormones and thyroid-stimulating hormone with lipid profile in euthyroid men[J].Int J Med Sci,2014,11(4):349-355.
[9] Biondi B,Cooper DS.The clinical significance of subclinical thyroid dysfunction[J].Endocr Rev,2008,29(1):76-131.
[10] Delitala AP,Fanciulli G,Maioli M,et al.Subclinical hypothyroidism,lipid metabolism and cardiovascular disease[J].Eur J Intern Med,2017,38:17-24.
[11] Peluso I,Morabito G,Urban L,et al.Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst[J]. Endocr Metab Immune Disord Drug Targets,2012,12(4):351-360.
[12] Bertoia ML,Pai JK,Cooke JP,et al.Plasma homocysteine,dietary B vitamins,betaine, and choline and risk of peripheral artery disease[J].Atherosclerosis,2014,235(1): 94-101.
[13] Chang L,Geng B,Yu F,et al.Hydrogen sulfide inhibits myocardial injury induced by homocysteine in rats[J].Amino Acids,2008,34(4):573-585.
[14] Fonseca FA,Izar MC.High-sensitivity C-reactive protein and cardiovascular disease across countries and ethnicities[J].Clinics(Sao Paulo),2016,71(4):235-242.
[15] Baliarsingh S,Sharma N,Mukherjee R.Serum uric acid:Marker for atherosclerosis as it is positively associated with "atherogenic index of plasma"[J].Arch Physiol Biochem,2013,119(1):27-31.
[16] 蔣秋明,张熙洋,雷蕾亚.临床甲状腺功能减退对糖尿病患者血糖、血脂、尿酸代谢的影响[J].中国医药导报,2016,13(18):80-84.
[17] 李子振,王镁.2型糖尿病合并亚临床甲状腺功能减退症116例临床分析[J].中国当代医药,2016,23(2):29-32.
[18] 李珍梅,钟义春,陈晓正.2型糖尿病合并亚临床甲状腺功能减退症与糖尿病微血管并发症的相关性分析[J].现代诊断与治疗,2016,27(13):2370-2372.
[19] 田林玉,陈晓蕾,柯亭羽.亚临床甲状腺功能减退症与2型糖尿病及其慢性并发症相关性研究进展[J].医学综述,2015,21(21):3938-3941.
(收稿日期:2017-02-26)
