学习初中化学中几种常见的微粒
——分子、原子和离子
2017-06-20贵州省安顺市普定县马场中学
贵州省安顺市普定县马场中学 林 海
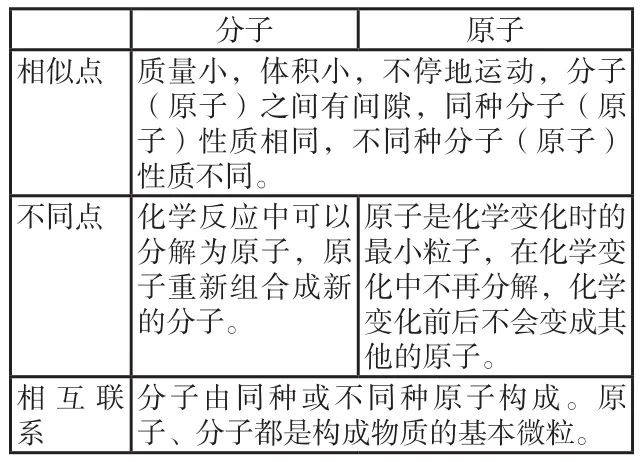
一、分子与原子的区别与联系
二、原子、离子的认识
(一)原子的结构
原子是由原子中心的原子核和核外电子构成。原子核由质子和中子构成,质子带正电,核外电子带负电,质子数和核外电子数相等,所以原子不显电性。原子的质量主要集中在原子核上,与质子、中子相比,电子的质量很小,是质子质量的1∕1836。
(二)原子核外电子排布
1.核外电子的运动状态——分层运动
(1)分层运动:含有多个电子的原子中,由于各电子的能量不同,克服原子核对其引力的能力各不相同,因而分布在离核远近不同的区域运动。
(2)分层原理:能量低的电子在离核近的区域运动;能量高的电子在离核远的区域运动。
(3)电子层的划分:根据电子离核的远近分为1~7个电子层,离核最近的叫第一层,依次为第二层,直到第七层。
2.核外电子排布规律
(1)核外电子总是尽量排布在能量较低的电子层里,然后再由里向外排。
(2)各电子层最多容纳的电子数目为2n²(n为第n电子层数)。
(3)最外层电子最多不超过8个电子(当第一层为最外层时,不超过2个电子),次外层不超过18个电子。
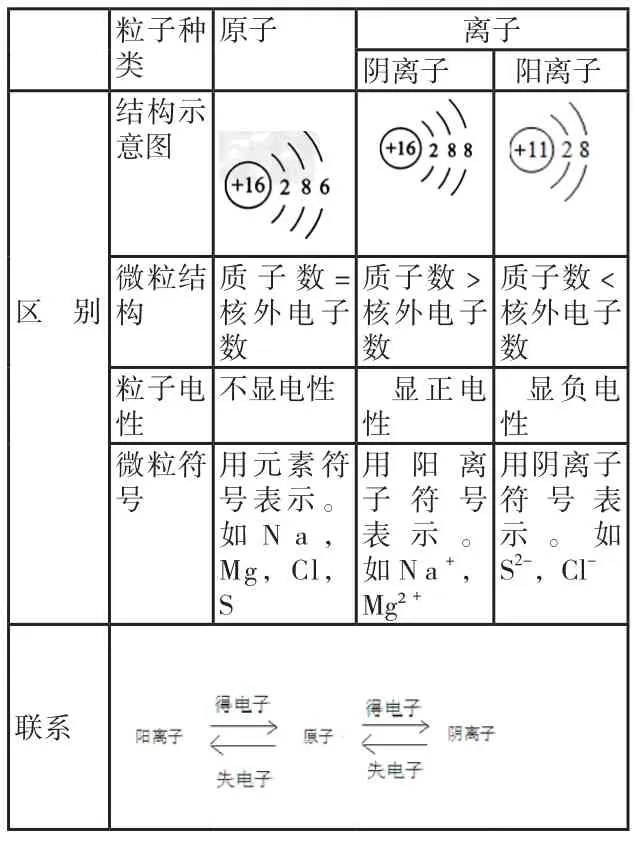
3.离子的形成
元素的原子由于最外层电子数未达到8个电子(第一层为2个)的稳定结构,在化学反应中易失去或得到电子,使最外层达到稳定结构,从而形成阳离子或阴离子。离子的分类:
阳离子:带正电的离子;阴离子:带负电的离子。
(1)原子与离子的区别与联系
(2)原子最外层电子数与其化学性质的联系
原子的最外层电子数决定元素的化合价。一般地,原子最外层电子数小于4个的,在化学反应中易失去电子,其元素的化合价表现为正价,失去1个电子,是+1价:失去2个电子,是+2价。失去最外层电子数即是最高正价。
原子最外层电子数多于4个的,在化学反应中易得到电子,元素的化合价表现为负价,得到1个电子,是-1价:得到2个电子,是-2价。直到最外层电子数满8个(第一层为2个),得到几个就是负几价。
三、原子、分子和离子构成的物质
(一)由原子直接构成的物质
1.金属单质(Na,Cu,Fe)
2.一些非金属单质和化合物(C,S,O2)
3.稀有气体(He,Ne,Ar,Kr)
(二)由分子构成的物质有
1.某些气态非金属单质,如:O2,H2,N2,Cl2。
2.某些共价化合物,如:CO2,H2,C2H5OH。
(三)由离子构成的离子化合物
如:NaCl,KCl,NaOH,K2SO4。
