合成偕二卤代烯烃的新方法
2017-06-19刘凯婷张印红王满刚
李 怡, 郑 忠, 刘 春, 李 洁, 刘凯婷, 张印红, 王满刚
(西北民族大学 化工学院,甘肃 兰州 730000)
·研究简报·
合成偕二卤代烯烃的新方法
李 怡, 郑 忠, 刘 春, 李 洁, 刘凯婷, 张印红, 王满刚
(西北民族大学 化工学院,甘肃 兰州 730000)
以芳醛为原料,与四卤化碳和三苯基膦发生叶立徳反应合成系列偕二卤代烯烃类化合物(2a~2h),其结构经1H NMR和13C NMR确证。考察了碱、溶剂、反应温度和反应时间对2产率的影响。结果表明:在最优条件(三乙胺为碱,二氯甲烷为溶剂,于室温反应15 h)下,2产率高达88%。
苯甲醛; 偕二卤代烯烃; 偶联反应; 合成
偕二卤代烯烃类化合物是常见的有机合成片断,易于制备且活性较高,在有机合成中得到广泛应用。该类化合物是许多天然活性产物及非天然材料合成的关键中间体。与单卤代烯烃化合物相比,偕二卤代烯烃是非常重要的二齿亲电试剂,在过渡金属催化的C—C[1-3], C—N[4-5], C—O[6]和C—S[7-8]等偶联反应中具有广泛的应用。在非金属参与的反应中也是非常重要的中间体[9-10]。偕二卤代烯烃还用于合成多取代烯烃、烯炔化合物、酰胺以及吲哚、苯并噻吩、苯并呋喃等化合物[11]。
合成偕二卤代烯烃的方法不多[12],早在1962年,Ramirez小组[13]报道了一种制备1,1-二溴代烯烃类化合物的简单方法。以苯甲醛为原料,二氯甲烷为溶剂,与四溴化碳(CBr4)和三苯基膦(PPh3)原位生成的叶立德(Ph3P=CBr2)反应制得该化合物,但该方法所需PPh3用量较多,环境污染严重。1972年,Corey小组[14]对上述方法进行了改进,加入锌粉消除副产物PPh3Br2,减少了三苯基膦的用量,提高了产率,但反应时间较长,且对于酮类化合物的产率较低。2002年,Shastin等[15]以未取代苯腙为原料,DMSO为溶剂,与四溴化碳反应合成一系列偕二溴代烯烃。2008年, Lautens等[16]将PPh3换为P(OPri)3,对于部分酮类化合物,P(OPri)3反应活性更强,他们认为反应是通过离子反应机理进行的。1976年,Savignac等[17]首次报道了利用有机锂试剂制备偕二溴代烯烃的方法。然而,现有的方法均存在一定的弊端,如反应时间长、环境污染严重,反应条件苛刻,原料难制备等。
本文以取代苯甲醛(1a~1h)为原料,与四卤化碳和三苯基膦发生叶立徳反应合成系列偕二卤代烯烃类化合物(2a~2h),其结构经1H NMR和13C NMR确证。考察了碱、溶剂、反应温度和反应时间对2产率的影响。
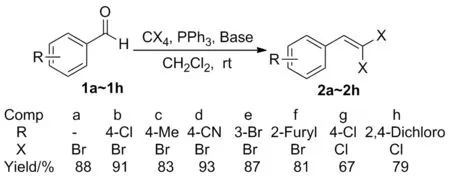
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker Advance Digital DMX 400/500型核磁共振仪(CDCl3为溶剂,TMS为内标)。
所用试剂均为分析纯, 其中二氯甲烷使用前经五氧化二磷除水处理。
1.2 合成
(1) 2的合成通法
在反应瓶中加入三苯基膦1.3 g(5 mmol),三乙胺0.5 g(5 mmol),四溴(氯)化碳5 mmol和二氯甲烷100 mL, 于室温反应12 h;加入1 2.5 mmol,加毕,反应3 h。用冷水(2×15 mL)洗涤,旋蒸除溶,残余液用正己烷(5×15 mL)萃取,合并萃取液,用无水硫酸钠干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:正己烷)纯化得2。
1-(2,2-二溴乙烯基)苯(2a)[18]: 淡黄色液体,产率88%;1H NMRδ: 7.51(d,J=6.0 Hz, 2H), 7.46(s, 1H), 7.39~7.28(m, 3H);13C NMRδ: 136.8, 135.2, 128.5, 128.3, 128.3, 89.5。
1-(2,2-二溴乙烯基)-4-氯苯(2b)[18]: 黄绿色液体,产率91%;1H NMRδ: 7.47(s, 1H), 7.45(d,J=2.3 Hz, 1H), 7.42(s, 1H), 7.35~7.33(m, 1H), 7.33~7.31(m, 1H);13C NMRδ: 135.6, 134.3, 133.6, 129.6, 128.6, 90.4。
1-(2,2-二溴乙烯基)-4-甲基苯(2c)[19]: 淡黄色液体,产率83%;1H NMRδ: 7.42(d,J=6.9 Hz, 3H), 7.16(d,J=8.0 Hz, 2H), 2.33(s, 3H)。
4-(2,2-二溴乙烯基)苯甲腈(2d)[18]: 白色固体,产率93%, m.p. 79~80 ℃;1H NMRδ: 7.69~7.58(m, 4H), 7.50(s, 1H);13C NMRδ: 139.5, 135.1, 132.1, 128.9, 118.4, 111.9, 93.4。
1-溴-3-(2,2 -二溴乙烯基)苯(2e)[20]: 无色液体,产率87%;1H NMRδ: 7.67(s, 1H), 7.45(dd,J=12.8 Hz, 7.9 Hz, 2H), 7.41(s, 1H), 7.26~7.22(m, 1H);13C NMRδ: 134.9, 132.1, 130.7, 129.8, 124.3, 122.1, 82.1, 78.6。
2-(2,2-二溴乙烯基)呋喃(2f)[18]: 淡褐色液体,产率81%;1H NMRδ: 7.43(d,J=1.4 Hz,1H), 7.40(s, 1H), 6.94(d,J=3.4 Hz, 1H), 6.45~6.46(m, 1H);13C NMRδ: 149.9, 142.5, 126.3, 111.5, 111.4, 87.0。
1-氯-4-(2,2-二氯乙烯基)苯(2g)[21]: 淡黄色液体,产率67%;1H NMRδ: 7.45(d,J=8.5 Hz, 2H), 7.32(d,J=8.5 Hz, 2H), 6.79(s, 1H);13C NMRδ: 134.2, 129.8, 128.6, 131.5, 128.6, 129.8, 127.3, 121.6。
2,4-二氯-1-(2.2-二氯乙烯基)苯(2h)[22]: 白色固体,产率79%, m.p.47~48 ℃;1H NMRδ: 7.59(d,J=8.4 Hz, 1H), 7.49(s, 1H), 7.41(d,J=1.3 Hz, 1H), 7.26(d,J=8.6 Hz, 1H);13C NMRδ: 134.8, 134.2, 130.7, 130.4, 129.4, 127.0, 124.7, 124.2。
2 结果与讨论
2.1 反应条件优化
为优化2的合成条件,以2a为例,考察了溶剂、碱、反应温度和反应时间对2a产率的影响,结果见表1。由表1可见,二氯甲烷为溶剂时,室温反应5 h,产率为61%(Entry 1)。延长反应时间至15 h,产率可达88%(Entry 3),进一步延长反应时间,产率并没有明显的升高。采用镁粉代替三乙胺时,没有得到更优的实验结果(Entry 5~8)。将反应温度升至50 ℃,产率为81%(Entry 9);采用其他溶剂代替二氯甲烷,没有得到更理想的实验结果(Entry 10~12)。
因此,最佳反应条件为:三乙胺为配体,二氯甲烷为溶剂,于室温反应15 h。

表1 2a的合成条件优化aTable 1 Optimization of reaction conditions for synthesizing 2a
a苯甲醛2.5 mmol, CBr45 mmol, PPh35 mmol,碱5 mmol,溶剂100 mL。
2.2 底物拓展
在最佳反应条件下进行了底物普适性考察,结果见Scheme 1。实验结果表明,芳环上吸电子取代基能得到较优的产率(2b, 91%; 2d, 93%),芳环间位上的吸电子取代基也可以得到很好的实验结果(2e, 87%);此外,该反应条件同样也适用于芳杂环类化合物(2f, 81%)。采用镁粉作为路易斯碱,在二氯甲烷中反应15 h, 制得两种偕二氯代烯烃类化合物(2g, 67%; 2h, 79%)。
本研究以取代苯甲醛为原料,探索了制备偕二卤代烯烃的方法,采用三乙胺代替锌粉来促进叶立德中间体的生成,大大缩短了反应时间(15 h),产率可提高至88%,三苯基膦的用量降低50%,减少了对环境的污染,并且实验操作简单;对于1,1-二氯代-1-烯烃类化合物,金属镁粉的加入可促进反应的进行。此类化合物与各种亲核试剂的偶联反应研究正在进行中。
[1] Coste A, Couty R, Evano G. Copper-mediated homocoupling of vinyl dibromides to symmetrical diynes [J].Synthesis,2010,(9):1500-1504.
[2] Hong D, Hong J L, Lei W.Ortho-heteroarylation of azobenzenes by rh-catalyzed cross-dehydrogenative coupling:An approach to aonjugated biaryls[J].Org Lett,2016,18(13):3110-3113.
[3] Rao M L N, Jadhav D N, Dasgupta P. Pd-catalyzed domino synthesis of internal alkynes using triarylbismuths as multicoupling organometallic nucleophiles[J].Org Lett,2010,12(9):2048-2051.
[4] Fang Y Q, Lautens M. A highly selective tandem cross-coupling ofgem-dihaloolefins for a modular,efficient synthesis of highly functionalized indoles[J].J Org Chem,2008,73(2):538-549.
[5] Newman S G, Lautens M. The role of reversible oxidative addition in selective palladium(0)-catalyzed intramolecular cross-couplings of polyhalogenated substrates:Synthesis of brominated indoles[J].J Am Chem Soc,2010,132(33):11416-11417.
[6] Zhou W, Chen W, Wang L. A highly efficient one-pot reaction of 2-(gem-dibromovinyl)phenols(thiophenols) with K4Fe(CN)6to 2-cyanobenzofurans(thiophenes)[J].Org Biomol Chem,2012,10:4172-4178.
[7] Zeng F, Alper H. Palladium-catalyzed domino C—S coupling/carbonylation reactions:An efficient synthesis of 2-carbonylbenzo[b]thiophene derivatives[J].Org Lett,2011,13(11):2868-2871.
[8] Newman S G, Aureggi A, Bryan C S,etal. Intramolecular cross-coupling of gem-dibromoolefins:A mild approach to 2-bromo benzofused heterocycles[J].Chem Commun,2009,35:5236-5238.
[9] Xiao D J. Radical cation salts:From single-electron oxidation to C—H activation[J].Synthesis,2016,48(01):18-30.
[10] Okutami M, Mori Y. Conversion of bromoalkenes into alkynes by wet tetra-n-butylammonium fluoride[J].J Org Chem,2009,74(1):442-444.
[11] Si W J, Zhang T, Zhang K X,etal. Synthesis and bioactivities of novel benzimidazole derivatives[J].Chin J Synth Chem,2016,24(5):369-373.
[12] Chelucci G. Synthesis and metal-catalyzed reactions ofgem-dihalovinyl systems[J].Chem Rev,2012,112(3):1344-1362.
[13] Desai N B, Mckelvie N, Ramirez F. A new synthesis of 1, 1-dibromoölefins via phosphine-dibromomethylenes the reaction of triphenylphosphine with carbon tetrabromide[J].J Am Chem Soc,1962,84(9):1745-1747.
[14] Corey E J, Fuchs P L. A synthetic method for formyl→ethynyl conversion (RCHO→RC—CH or RC—CR′)[J].Tetrahedron Lett,1972,13:3769-3772.
[15] Korotchenko V N, Shastin A V, Nenajdenko V G,etal. Olefination of aromatic ketones:Synthesis of mono- and dihaloalkenes[J].J Chem Soc Perk,2002,(T1):883-887.
[16] Fang Y Q, Lifchits O, Lautens M. Horner-wadsworth-emmons modification for ramirezgem-dibromoolefination of aldehydes and ketones using P(OPri)3[J].Synlett,2008,(3):413-417.
[17] Savignac P, Coutrot P. Preparation of 1,1-dibromoalkenes by halogen exchange[J].Synthesis,1976(3):197-199.
[18] Rao M L N, Jadhav D N, Dasgupta P. Pd-catalyzed domino synthesis of internal alkynes using triarylbismuths as multicoupling organometallic nucleophiles[J].Org Lett,2010,12(9):2048-2051.
[19] Pawluc P, Hreczycho G, Walkowiak J,etal. A new facile synthesis of 1,1-dibromo-2-arylethenes[J].Synlett,2007,(13):2061-2064.
[20] Morri A K, Thummala Y, Doddi V R. The dual role of 1,8-diazabicyclo[5.4.0]undec-7-ene(DBU) in the synthesis of terminal aryl-and styryl-acetylenesviaumpolung reactivity[J].Org Lett,2015,17(18):4640-4643.
[21] Krabbenhoft H O. Substituent effects on the preparations and thermal decarboxylations ofβ-lactones derived from the cycloaddition of dichloroketene with monosubstituted benzaldehydes[J].J Org Chem,1978,43:1305-1311.
[22] Newman S G, Bryan C S, Perez D,etal. The use of bromotrichloromethane in chlorination reactions[J].Synthesis,2011,(2):342-346.
征 订 启 事
《合成化学》(月刊)是由中国科学院成都有机化学有限公司和四川省化学化工学会联合主办的学术期刊。于1993年创刊,国内外公开发行。主要内容包括基本有机合成、高分子合成、生化合成及无机合成等方面的基础研究和应用研究的中文研究论文、快递论文、研究简报、制药技术以及关系合成化学领域各学科的综合评述。
《合成化学》于2008年入选“中文核心期刊(化学类)”(第五版), 2011年入选“中文核心期刊(化学类)”(第六版)。2003年以来被连续收录为“中国科技论文统计源期刊”(中国科技核心期刊)。2003年度在“CA收录千种表”中名列第710名(中国入选科技期刊的第39名)。为首批入选“中国学术期刊”(光盘版)的刊物之一,1999年至今被“中国科学文献计量评价研究中心”认证为《中国科学引文数据库》来源期刊。
本刊按新修订的GB/T788-1999《图书和杂志开本及其幅面尺寸》国家标准(大16开)出版印刷,2017年每期订价12元,全年144元。邮发代号62-196,欢迎到各地邮局订阅。
《合成化学》编辑部
Novel Method for The Synthesis ofGem-dihaloolefins
LI Yi, ZHENG Zhong, LIU Chun, LI Jie,LIU Kai-ting, ZHANG Yin-hong, WANG Man-gang*
(School of Chemical Engineering, Northwest University for Nationalities, Lanzhou 730000, China)
A series ofgem-dihaloolefins(2a~2h) were prepared by Witting reaction using benzaldehydes, carbon tetrahalide and triphenylphosphine as starting materials. The structures were confirmed by1H NMR and13C NMR. The effects of reaction temperature and time, solvents and base on the yield of 2 were investigated. The results indicated that the yield of 2 was up to 88% under the optimum conditions(triethylamine as base in methylene chloride, reaction at room temperature for 15 h).
benzaldehyde;gem-dihaloolefin; coupling reaction; synthesis
2017-02-15
西北民族大学国家级大学生创新训练项目(201610742060); 国家民委科研项目(14XBZ012); 中央高校基本科研业务费专项资金项目(31920150022); 甘肃省高等学校科研项目(2014B-009)
李怡(1995-),男,苗族,重庆彭水人,本科生,主要从事有机合成的研究。 E-mail: 1126712958@qq.com
王满刚,副教授, E-mail: 332610626@qq.com
O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.17025
