2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯的合成
2017-06-19宣美军
宣美军, 金 灿
(浙江工业大学 药学院,浙江 杭州 310006)
·研究简报·
2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯的合成
宣美军, 金 灿*
(浙江工业大学 药学院,浙江 杭州 310006)
以3-硝基-2-氨基苯甲酸甲酯为原料,经三氟乙酰化、N-烷基化和脱保护反应制得坎地沙坦中间体2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯,其结构经1H NMR,13C NMR和MS(ESI)确证。
3-硝基-2-氨基苯甲酸甲酯; 2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯; 合成; 工艺优化
2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯(4)是降血压药物坎地沙坦的重要中间体。坎地沙坦属于血管紧张素Ⅱ受体抑制剂,在治疗高血压疾病中疗效显著、副作用小,作用时间长[1-2]。4的制备方法文献报道较多,但大都通过Curtius重排反应制得3-硝基-2-叔丁氧甲酰氨基苯甲酸甲酯,其实质是利用叔丁氧甲酰基对3-硝基-2-氨基苯甲酸甲酯(1)结构中氨基进行保护[3-5]。而Curtius重排反应需用污染重的氯化亚砜和昂贵、剧毒、易爆的叠氮化钠,制备工艺污染大,成本也高。
我们采用三氟乙酰基对1中氨基保护,成功绕开Curtius重排反应。同时,由于1中氨基较稳定,在常规条件下很难与乙酸酐、乙酰氯和氯甲酸乙酯三氟乙酸酐等发生反应而引入保护基团。以3-硝基-2-氨基苯甲酸甲酯(1)为原料,经三氟乙酰化、N-烷基化和脱保护反应制得4(Scheme 1),其结构经1H NMR,13C NMR和MS(ESI)确证。
1 实验部分
1.1 仪器与试剂
WRS-1B型熔点仪; Varian-400型核磁共振仪(CDCl3为溶剂,TMS为内标);Saturn-2000 MS型质谱仪。

Scheme 1
1参照文献[6-8]方法合成;3-硝基邻苯二甲酸,浙江华海药业;其余所用试剂均为分析纯。
1.2 合成
(1) 2的合成
在单口瓶中加入1 1.96 g(10 mmol),三氟乙酸酐15 mL和五氧化二磷0.02 g,升温至40 ℃反应40 min。冷却至室温,用二氯甲烷溶解,依次用水和碳酸钠水溶液洗涤至pH 7。蒸出二氯甲烷得2粗品,用甲醇重结晶得白色粉末状固体2 2.19 g,收率75%[9], m.p. 129.1~130.2 ℃;1H NMRδ: 3.83(s, 3H, CH3), 8.27(d,J=8.0 Hz, 1H, ArH), 8.17(d,J=8.0 Hz, 1H, ArH), 7.72~7.76(t,J=8.0 Hz, 1H, ArH), 11.69(s, 1H, NH);13C NMRδ: 164.02, 154.86(q,J=37.0 Hz), 146.06, 135.2, 129.20, 128.78, 128.43, 126.59, 116.90(q,J=285.0 Hz), 53.40; MS(ESI)m/z: 291.1{[M-H]+}。
(2) 2-{[(2′-氰基联苯基-4-基)甲基]三氟乙酰氨基}-3-硝基苯甲酸甲酯(3)的合成
在单口瓶中加入2 2.92 g(10 mmol), 2′-氰基-4-溴甲基联苯2.99 g(11 mmol),碳酸钾6.95 g(50 mmol),碘化钾0.002 g和乙腈45 mL,回流反应4 h(TLC监测)。蒸除溶剂,残余物经硅胶柱层析(梯度洗脱剂:A=PE ∶EA=4/1~2/1,V/V)纯化得白色粉末状固体3 4.10 g,收率85%[10], m.p. 128.3~130.1 ℃;1H NMRδ: 3.70(s, 3H, CH3), 3.87(s, 3H, CH3), 4.79(d,J=14.0 Hz, 1H, CH), 5.05(d,J=13.6 Hz, 1H, CH), 7.16(d,J=8.4 Hz, 2H, ArH), 7.38~7.45(m, 4H, ArH), 7.60~7.64(t,J=8.0 Hz, 2H, ArH), 7.74(d,J=8.0 Hz, 1H, ArH), 8.10(d,J=8.0 Hz, 1H, ArH), 8.18(d,J=8.0 Hz, 1H, ArH);13C NMRδ: 163.54, 157.29(q,J=37.0 Hz), 147.49, 144.19, 138.32, 135.61, 133.63, 133.28, 132.73, 131.85, 131.75, 130.85, 130.58, 130.02, 129.76, 129.64, 129.91, 128.80, 127.57, 118.20, 115.09(q,J=232.0 Hz), 111.04, 55.19, 53.20; MS(ESI)m/z: 506.2{[M+Na]+}。
(3) 4的合成
在单口瓶中加入3 4.83 g (10 mmol),无水甲醇50 mL和甲醇钠0.81 g (15 mmol),缓慢升温至回流(体系立即变为黄色澄清),反应1 h。蒸除溶剂,加二氯甲烷溶解,用水洗涤,蒸干溶剂得黄色粉末状固体4 3.56 g,收率92%, m.p. 140.1~141.2 ℃;1H NMRδ: 3.88(s, 3H, CH3), 4.24(s, 2H, CH2), 6.71(t,J=7.6 Hz, 1H, NH), 7.39~7.44(m, 3H, ArH), 7.47~7.53(m, 3H, ArH), 7.60~7.64(t,J=7.6 Hz, 1H, ArH), 7.74(d,J=8.0 Hz, 1H, ArH), 7.99(d,J=8.4 Hz, 1H, ArH), 8.08(d,J=8.0 Hz, 1H, ArH), 8.83(s, 1H, ArH); MS(ESI)m/z: 388.2{[M+H]+}。
2 结果与讨论
2.1 反应条件优化
(1) 2的合成
1中氨基较为稳定,常规条件下不与乙酰氯、乙酸酐及氯甲酸乙酯等反应。本文以P2O5/Al2O3或P2O5为催化剂,三氟乙酸酐为溶剂,催化1发生三氟乙酰化反应。考察了催化剂和反应温度对2收率的影响,结果见表1。由表1可知,P2O5/Al2O3和P2O5催化效果一样[9]。反应温度为40 ℃时,P2O5/Al2O3和P2O5为催化剂时收率均为75%,升高温度收率下降。温度为55 ℃时收率为70%,温度为85 ℃时收率为35%,温度为100 ℃时收率只有28%。因此最佳反应条件为:P2O5为催化剂,三氟乙酸酐为溶剂,于40 ℃反应40 min。

表1 反应温度和催化剂对2收率的影响*Table 1 Effect of temperature and catalyst on the yield of 2
*1 10 mmol,催化剂0.02 g,三氟乙酸酐15 mL,反应时间40 min。
(2) 3的合成
考察了反应温度和溶剂对3收率的影响。结果见表2。由表2可知,反应温度和溶剂对2进行N-烷基化反应影响较大。二氯甲烷为溶剂,回流条件下反应收率只有10%;温度为66 ℃时,分别以CH3CN, THF和DMF为溶剂,收率分别为79%, 75%和60%。当温度为82 ℃(CH3CN回流温度)时收率可以达到85%,而以甲苯为溶剂收率只有40%。因此,合成3的最佳条件为:乙腈为溶剂,回流反应6 h。
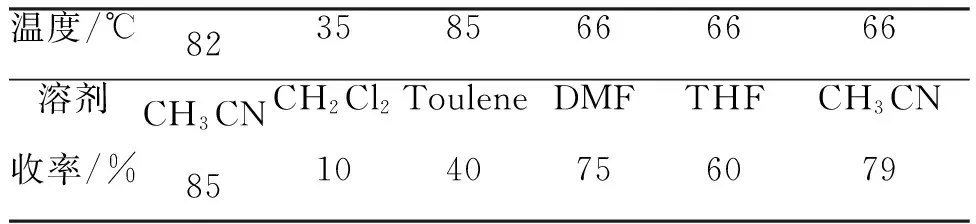
表2 温度和溶剂对反应收率影响*Table 2 Effect of reaction temperature and solvent on the yield of 3
*2 10 mmol,反应时间为6 h,溶剂25 mL。
(3) 4的合成
考察了碱和反应时间对4收率的影响。结果见表3。由表3可知, NaOH和KOH为碱时,收率73%,反应时间延长收率增加。甲醇钠为碱时,回流反应1 h,收率92%,而KOH为碱时,收率85%。甲醇钠为碱时,随着反应时间增加收率不变(92%)。由于甲醇钠的亲核性及在甲醇中的溶解性都较KOH和NaOH大,故收率较高。故合成4的最佳条件为:甲醇钠为碱,回流反应1 h。

表3 碱和反应温度对4收率影响*Table 3 Effect of temperature and alkali on the yield of 4
*3 10 mmol,无水甲醇50 mL,碱用量为15 mmol。
以3-硝基-2-氨基苯甲酸甲酯为原料,经三氟乙酰化、N-烷基化和脱保护反应制得坎地沙坦中间体2-{[(2′-氰基联苯基-4-基)甲基]氨基}-3-硝基苯甲酸甲酯,并对中间体合成条件进行了优化。
[1] Gavras H. Update on the clinical pharmacology of candesartan cilexetil[J].American Journal of Hypertension,2000,13(1):25-30.
[2] Cernes R, Mashavi M, Zimlichman M. Differential clinical profile of candesartan compared to other angiotensin receptor blockers[J].Vascular Health and Risk Management,2011,19:749-757.
[3] 吴奎伟,吴成军,孙铁民. 坎地沙坦酯的合成工艺研究[J].中南药学,2014,12(8):786-787.
[4] Kubo K, Kohara Y, Yoshimura Y,etal. Nonpeptide angiotesin Ⅱ receptor antagonists and biological activity of benzimidazolecarboxylic acide[J].J Med Chem,1993,36(16):2182-2196.
[5] 苏国强,郭涤亮,朱兰,等. 坎地沙坦的合成方法研究[J]. 中国药科大学学报,2005,36(2):190-192.
[6] Cheng J, Xie J T, Luo X J. Synthesis and antiviral activity against Coxsackie virus B3 of some novel benzimidazole derivatives[J].Bioorganic & Medicine Chemistry Letters,2005,15:267-269.
[7] Hosangadi B D, Dave R H. An efficient general method for esterification of aromatic caboxylic acids[J].Tetrahedron Letters,1996,37(35):6375-6378.
[8] 田志高,刘安昌,谭珍友,等. 3-硝基-2-氨基苯甲酸的合成[J].合成化学,2009,01(17):106-108.
[9] Zarei A, Hajipour A R, Khazdooz L. P2O5/Al2O3as an efficient heterogeneous catalyst for the acetylation of alcohols,phrnols,thiols,and amines under solvent-free conditions[J].Synthetic Communications,2011,41(12):1772-1785.
[10] 闫起强,郭拥政,谢苏豪,等. 氯沙坦的合成[J].合成化学,2010,01(18):83-85.
Synthesis of Methyl 2-{[(2′-Cyanobibenyl-4-yl)methyl] amino}-3-nitrobenzoate
XUAN Mei-jun, JIN-Can*
(College of Pharmaceutical Sciences, Zhejiang University of Technology, Hangzhou 310006, China)
Methyl 2-((2′-cyanobipheny-4-yl)methyl)amino)-3-nitrobenzoate, the key intermediate of Candesartan, was synthesized by trifluoroacetylation,N-alkylation, and deprotection from 2-amino-3-nitrobenzoate. The structure was confirmed by1H NMR ,13C NMR and MS(ESI).
2-amino-3-nitrobenzoate; methyl 2-(((2′-cyanobipheny-4-yl)methyl)amino)-3-nitrobenzoate; synthesis; process optimization
2016-11-24;
2017-04-11
浙江省科技计划资助项目(2015C31036)
宣美军(1989-),男,汉族,安徽合肥人,硕士,从事药物合成的研究。 E-mail: 1030176172@qq.com
金灿,副教授,硕士生导师, E-mail: jincan@zjut.edu.cn
O625.63; R914.5
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.16294
