以花生饼制花生酱的双菌种制曲工艺研究
2017-06-19张玲梁妍陈善美张钟
张玲,梁妍,陈善美,张钟
(广东石油化工学院 环境与生物工程学院,广东 茂名 525000)
以花生饼制花生酱的双菌种制曲工艺研究
张玲*,梁妍,陈善美,张钟
(广东石油化工学院 环境与生物工程学院,广东 茂名 525000)
以花生高温榨油产生的下脚料花生饼为原料,分别接种黑曲霉及米曲霉制备花生酱成曲。以成曲的糖化酶活力和氨基态氮含量为依据,考察了花生饼用量、制曲时间及孢子接种量对成曲制备效果的影响,并通过正交试验优化了两种霉菌制曲的最佳工艺条件。结果表明:米曲霉单独制曲的最佳条件为制曲时间44 h、接种孢子数4.40×108个/g、花生饼用量比例为80%,此条件下得到的成曲糖化酶活力为905 U/g,氨基态氮含量为0.434 g/dL;黑曲霉单独制曲的最佳条件为制曲时间26 h、接种孢子数8.03×109个/g、花生饼比例90%,此条件下得到的成曲糖化酶活力为926 U/g,氨基态氮含量为0.450 g/dL。研究结果为后续深入研究以高温花生饼制备花生酱奠定了基础。
花生饼;米曲霉;黑曲霉;制曲
花生酱含有丰富的蛋白质、维生素和矿物质等,其营养丰富、风味独特,是很好的佐餐和调味品[1]。目前我国对花生酱的重视程度不断提高,花生酱已占我国食用花生消费的37%[2]。随着人们生活水平的不断提高,酱类等调味品的市场需求方向逐渐趋向多样化、复合方便化、高档化和营养保健化[3,4]。花生酱由于营养价值极高,已被证实可以用作治疗营养不良的治疗性食品[5,6]。
花生饼是花生高温榨油后的副产物,含有近50%左右的粗蛋白质[7]。而高温榨油导致这些蛋白质变性严重,营养效价变低,使得花生饼的传统利用形式主要作为肥料或者饲料,这在很大程度上造成了资源的严重浪费。本文尝试利用花生饼发酵制花生酱,具有明显的经济和社会价值。
发酵法制备酱类调味品,前期需要制备合适的成曲。目前,相关研究较多,如张梦茹等[8]利用豆渣代替豆粕生产酱产品;周显青等[9]以碎米为原料,接种黑曲霉后制曲,采用响应面法优化米酱的制曲工艺。付雯等[10]研究不同条件对黑曲霉、根霉混合制曲效果的影响,确定黑曲霉、根霉混合制曲的最适条件。本文以花生饼为原料,采用米曲霉及黑曲霉为菌种的双菌种制曲工艺,依次进行斜面培养、种曲培养和成曲培养,比较制曲时间、接种孢子量、花生饼添加比例对成曲糖化酶活力和氨基态氮的影响,并在单因素试验基础上进行正交试验,确定了最优工艺参数,为花生饼制花生酱的生产提供技术支持。
1 材料与方法
1.1 材料与设备
1.1.1 原料
花生饼:由茂名嘉唛食品有限公司提供;面粉、麸皮:均为市售。
1.1.2 菌种
米曲霉:中科3.951(即沪酿3.042)米曲霉;黑曲霉:黑曲霉AS3.350;以上菌种均由春丰食用菌合作社提供。
1.1.3 主要设备
HH-S24型数显恒温水浴锅 深圳市三利化学有限公司;AUY 220型分析天平 日本岛津公司;HX-5022型电子天平 上海天平仪器厂;HPX-9162MBE型恒温培养箱 上海博讯实业有限公司医疗设备厂;XB.K.25型血球计数板 上海市求精生化试剂仪器有限公司;XFS-280A型高压灭菌锅 浙江新丰医疗器械有限公司;PHS-3C型台式pH计 上海雷磁仪电科学仪器股份有限公司;HW-23型恒温磁力搅拌器、80-2型电动离心机 常州澳华仪器有限公司;85-2型显微镜 江苏省金坛市精达仪器制造厂;XSP-02-640X型电热鼓风干燥箱 上海一恒科学仪器有限公司; RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;722N型可见分光光度计 上海精密科学仪器有限公司;C21-SK2105型电磁炉 广东美的生活电器制造有限公司。
1.1.4 主要试剂
百里酚酞 上海源叶生物科技有限公司;氢氧化钠 北京华宇永盛科技有限公司;甲醛 河北胜利建材化工有限公司;中性红 梯希爱(上海)化成工业发展有限公司;无水乙醇 禹城市创新化工有限公司;硫酸 天津市进丰化工有限公司;葡萄糖、乙酸钠 吴江市天翔化工有限公司;琼脂 河南三佳化工有限公司;硫酸铜 山西金顺达化工有限公司;次甲基蓝、碳酸钠、冰醋酸、硫代硫酸钠 天津市大茂化学试剂厂;酒石酸钾钠 洛阳市化学试剂厂;亚铁氰化钾 天津市福晨化学试剂厂;碘、碘化钾 天津市光复科技发展有限公司;硫酸、可溶性淀粉、乙酸锌 广东汕头新宁化工厂;以上试剂均为分析纯。
1.2 培养基
1.2.1 米曲霉及黑曲霉斜面培养基
马铃薯葡萄糖琼脂培养基(PDA)。
1.2.2 米曲霉及黑曲霉三角瓶扩大培养基
麸皮80 g、面粉20 g、水80~90 mL。将原料混匀后,分装于已经灭菌的250 mL三角瓶或玻璃罐头内,料厚度1 cm左右,121 ℃湿热灭菌30 min,灭菌后趁热把曲料摇散。
1.2.3 米曲霉及黑曲霉种曲培养基
麸皮8 g、花生饼4 g、水8 mL,混匀于250 mL三角瓶中,高温高压(121 ℃,0.1 MPa)灭菌20 min[11]。
1.2.4 米曲霉及黑曲霉成曲培养基
称取花生饼80 g,浸泡5 h,高温高压(121 ℃,0.1 MPa)蒸煮8 min,取出,待温度降至40 ℃,加入20 g已干蒸过的面粉拌匀[12]。
1.3 工艺流程
花生饼→去杂→粉碎→加水润水→蒸料→冷却→斜面培养→三角瓶扩大培养→种曲培养→测孢子数→成曲培养→氨基态氮含量测定→糖化酶活力测定。
1.4 操作工艺要点
1.4.1 粉碎
花生饼块大坚硬,需进行粉碎,以利于润水、蒸煮,加大曲霉菌丝生长总面积,增加酶的分泌量[13]。
1.4.2 加水、润水与加水量
向原料中加入适量的水分,原料均匀而完全吸收水分的过程称为润水,加水、润水的目的是:使原料中蛋白质含有一定的水分,以便于蒸煮时迅速适度变性;使原料中淀粉易于充分糊化,以便溶出曲霉生长所需的碳素营养成分,提供曲霉生长繁殖所必要的水分。
加水量的多少直接关系到成曲的质量。适当的加水量有利于蒸煮,使原料蛋白质变性和曲霉生长繁殖,水分过多或过少,都不利于米曲霉的生长繁殖和酶的分泌,对酱的质量产生不良影响。
生产实践表明:加水量以花生饼计,在80%~100%较合适,蒸熟后曲料含水量为48%~50%[14]。
1.4.3 蒸料
蒸料是为了使原料中的蛋白质完全适度地变性,即成为酶容易作用的状态,使原料中的淀粉糊化成为可溶性淀粉,供曲霉利用,并通过蒸煮消灭附着在原料上的微生物,提高制曲的安全性。因此,要掌握适当的蒸煮压力(温度)和时间,才能使原料蛋白质完全适度地变性,提高原料蛋白质利用率和酱的质量。
1.4.4 斜面菌种培养
斜面培养基接种后,于30 ℃恒温培养3天。
1.4.5 三角瓶扩大培养
待培养基曲料冷却至室温,无菌操作接入斜面孢子1~2环,充分摇匀后,将培养基堆积在瓶底一角,于30 ℃培养。18~20 h后,见白斑及菌丝生长,把培养基充分摇碎并平摊于瓶底。继续培养约6 h,菌丝大量生长又结成饼状,进行第2次摇瓶,把小团块亦充分摇松,仍平摊于瓶底培养。约经48 h,菌丝充分生长,形成结饼状即可扣瓶(将三角瓶斜倒,使底部曲料翻转,以充分接触空气)。扣瓶后,将瓶横放继续培养至孢子充分长满曲料,共需3天。培养好的三角瓶曲应及时使用,如果短时间保存,需置于4 ℃冰箱中,时间不宜超过10天。
1.4.6 种曲培养
先把三角瓶种曲与少量灭过菌的干麸皮拌和均匀后,撒在熟料上,均匀接种。厚度6~7 mm,稍予摊平,中间亦少。置于恒温培养箱中,30 ℃培养72 h。
种曲制成后,移出放置于阴凉通风处干燥保存,应及时使用。
1.4.7 孢子悬浮液的制备
精确称取种曲1 g(精确至0.002 g),倒入盛有玻璃珠的250 mL三角瓶内,加入95%酒精5 mL、无菌水20 mL、稀硫酸10 mL,充分振摇,使种曲分散,然后用3层纱布过滤,用无菌水反复冲洗,务使滤渣不含孢子,最后稀释至500 mL[15]。
1.4.8 孢子数的测定
采用血球计数器测定。
1.4.9 成曲培养
从种曲中接种定量孢子数到成曲培养基,放于30 ℃、湿度80%的恒温恒湿箱中培养。
1.5 氨基态氮含量测定
氨基酸态氮是豆酱发酵过程中的主要指标,其数值越高,表明菌种对蛋白质的分解能力越强,成品滋味越鲜美。由于黑曲霉孢子为棕黑色,制作酶液时颜色较深,不利于显色判定终点;而甲醛又有一定的毒性,所以以双指示剂甲醛滴定法测定米曲霉制曲时的氨基态氮含量,以电位滴定法测定黑曲霉制曲时的氨基态氮含量。
1.5.1 米曲霉制曲时的氨基态氮含量测定
采用双指示剂甲醛滴定法进行测定。移取一定量(约含20 mg的氨基酸)样品溶液2份,分别置于250 mL锥形瓶中,加水50 mL;其中一份加3滴中性红指示剂,用0.10 mol/L NaOH溶液滴定至琥珀色为终点;另一份加入中性甲醛10 mL及3滴百里酚酞指示剂,摇匀,静置1 min(此时蓝色应消失)。再用0.1 mol/L NaOH溶液滴定至淡蓝色。记录2次滴定所消耗的碱液毫升数,按下式计算:

式中:N为NaOH标准溶液当量浓度,mol/L;V1为测定样品消耗NaOH标准溶液的体积,mL;V2为测定空白消耗NaOH标准溶液的体积,mL;W为样品溶液相当样品的质量,g;0.014为氮的毫克当量。
测定时样品的颜色较深,应加活性炭脱色之后再滴定[16]。
1.5.2 黑曲霉制曲时的氨基态氮含量测定
采用电位滴定法进行测定。吸取样液5.0 mL,加水定容至100 mL。于200 mL烧杯中吸取20.0 mL试样,加60 mL蒸馏水,开启磁力搅拌器,待搅拌稳定后把酸度计的复合电极小心放入烧杯,用氢氧化钠标准溶液滴定至酸度计指示pH值为8.2,记下消耗氢氧化钠标准溶液的体积,计算总酸含量。
准确加入10.00 mL甲醛溶液,混匀,再用氢氧化钠标准溶液继续滴定至pH值为9.2,记录消耗氢氧化钠标准溶液的体积。同时量取80 mL蒸馏水,先用0.05 mol/L氢氧化钠标准溶液调节至pH值为8.2,再加入10 mL甲醛溶液,用氢氧化钠标准溶液滴定至pH值为9.2,作为试剂空白对照。
样品中氨基态氮含量按下式计算,结果保留两位有效数字。
式中:X为每百毫升样品中氨基态氮的含量,g;V1为测定样品在加入甲醛后滴定至终点(pH值为9.2)所消耗氢氧化钠标准溶液的体积,mL;V2为空白试验加入甲醛后滴定至终点(pH值为9.2)所消耗氢氧化钠标准溶液的体积,mL;C为氢氧化钠标准溶液的浓度,mol/L;0.014为与1.00 mL氢氧化钠标准溶液相当的氮的质量,g[17]。
1.6 糖化酶活力的测定
糖化酶有催化淀粉水解的作用,能从淀粉分子非还原性末端开始,分解α-1,4葡萄糖苷键生成葡萄糖,葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定,计算出酶活力。
1.6.1 操作步骤
1.6.1.1 待测酶液的制备
称取成曲1~2 g,精确至0.0002 g(或吸取液体酶1.00 mL),先用少量的乙酸缓冲液溶解,并用玻璃搅拌棒捣研,将上清液小心倾入容量瓶中。沉渣部分再加入少量缓冲液, 如此捣研3~4次,最后全部移入容量瓶中,用缓冲液定容至刻度摇匀,通过4层纱布过滤,滤液供测定用。
1.6.1.2 测定
于甲、乙2支50 mL比色管中,分别加入可溶性淀粉溶液25.0 mL及缓冲液5.00 mL,摇匀后,于(40±0.2 )℃恒温水浴中预热5 min。在甲管(样品)中加入待测酶液2.00 mL, 立刻摇匀,在此温度下准确反应30 min,立即各加氢氧化钠溶液0.2 mL,摇匀,将2管取出迅速冷却,并于乙管(空白)中补加待测酶液2.00 mL。
吸取上述反应液与空白液5.00 mL,分别置于碘量瓶中,准确加入碘溶液10.0 mL,再加氢氧化钠溶液15.0 mL,摇匀,密塞,于暗处反应15 min。取出,加硫酸溶液2.0 mL,立即用硫代硫酸钠标准溶液滴定,直至蓝色刚好消失为其终点。
1.6.2 计算
样品的酶活力计算公式如下:
X=(A-B)c×90.05×32.2/5×1/2×n×2=579.9×(A-B)c×n。
式中:X为样品的酶活力,U/g;A为空白消耗硫代硫酸钠标准溶液的体积,mL;B为样品消耗硫代硫酸钠标准溶液的体积,mL;c为硫代硫酸钠标准溶液的浓度,mol/L;n为稀释倍数;90.05为与1.00 mL硫代硫酸钠标准溶液相当的以克表示的葡萄糖的质量;32.2为反应液的总体积,mL;5为吸取反应液的体积,mL;1/2为吸取酶液2.00 mL,以1.00 mL计;2为反应30 min,换算成1 h的酶活力系数;所得的结果表示至整数。
1.7 单因素试验
1.7.1 制曲时间的确定
称取花生饼80 g,浸泡5 h,高温高压(121 ℃,0.1 MPa)蒸煮8 min,取出,待温度降至40 ℃,加入20 g已干蒸过的面粉麸皮(比例为11∶1)拌匀,然后从种曲中接种4.40×107个/g孢子,放于30 ℃、湿度80%的恒温恒湿箱中培养。每2 h定时取样,测定样品氨基态氮含量和糖化酶活力,确定制曲时间。
1.7.2 制曲接种孢子量的确定
称取花生饼80 g,浸泡5 h,高温高压(121 ℃,0.1 MPa)蒸煮8 min,取出,待温度降至40 ℃,加入20 g已干蒸过的面粉麸皮(比例为11∶1)拌匀,然后从种曲中接种不同数量的孢子,放于30 ℃、湿度80%的恒温恒湿箱中培养,42 h后测定样品氨基态氮含量,并根据氨基态氮含量的变化、糖化酶活力确定制曲接种孢子数。
米曲酶接种的孢子量依次是:4.40×105,4.40×106,4.40×107,4.40×108,4.40×109个/g,以接种孢子量的对数作图。
黑曲酶接种的孢子量依次是:8.03×105,8.03×106,8.03×107,8.03×108,8.03×109个/g,以接种孢子量的对数作图。
1.7.3 花生饼添加比例的确定
称取花生饼60,70,80,90,100 g,浸泡5 h,高温高压(121 ℃,0.1 MPa)蒸煮8 min,取出,待温度降至40 ℃,分别加入40,30,20,10,0 g已干蒸过的面粉麸皮(比例为11∶1)拌匀,然后从种曲中接种4.40×107个/g孢子,放于30 ℃、湿度80%的恒温恒湿箱中培养,42 h后测定样品氨基态氮含量,并根据氨基态氮含量的变化、糖化酶活力确定制曲面粉添加量[18]。
1.8 正交试验
在单因素试验的基础上,进行正交试验,确定最优工艺参数。
2 结果与讨论
2.1 单因素试验结果与分析
2.1.1 制曲时间对糖化酶活力和氨基态氮含量的影响
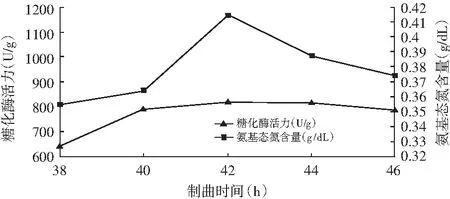
图1 米曲酶制曲时间对糖化酶活力和氨基态氮含量的影响

图2 黑曲霉制曲时间对糖化酶活力和氨基态氮含量的影响
由图1和图2可知,糖化酶活力和氨基态氮含量随着曲酶制曲时间的延长而上升,米曲霉和黑曲霉分别在制曲时间42,26 h时,其糖化酶活力和氨基态氮含量达到最大值,之后酶活力稍微下降,这是因为制曲时间过短,霉菌不能充分生长,菌丝没有完全深入到基质,导致原料未分解彻底,降低了原料利用率且成曲也未达到最高酶活;制曲时间过长,一方面,感染杂菌的几率增加,且生产效率降低;另一方面,糖化酶活达到峰值后,米曲霉和黑曲霉的孢子已经过了生长、成熟的阶段,处于生长后期,活性已不再那么强。
2.1.2 制曲接种孢子量对糖化酶活力和氨基态氮含量的影响
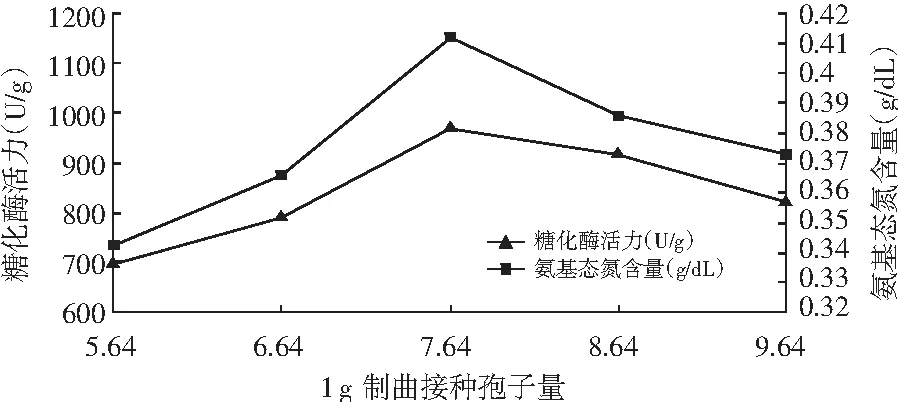
图3 米曲霉制曲接种孢子量对数对糖化酶活力和氨基态氮含量的影响
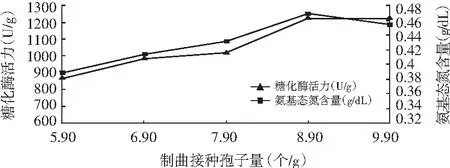
图4 黑曲霉制曲接种孢子数对数对糖化酶活力和氨基态氮含量的影响
由图3和图4可知,糖化酶活力和氨基态氮含量随着接种量的增加而提高,达到一定的峰值后下降。米曲霉和黑曲霉制曲接种孢子数分别为7.64和9.90时,其糖化酶活力和氨基态氮含量达到最大值。初步确定米曲霉接种孢子数为7.64,黑曲霉接种孢子数为9.90,这是因为不同的接种量对米曲霉活性有很大的影响,接种量太大,培养基中的营养物质有限,不足以维持米曲霉的生长所需,将形成大量的休眠孢子,降低酶的活性,接种量太小,接入的生物量不足,培养基的营养过剩,容易造成浪费。
2.1.3 花生饼添加比例对糖化酶活力和氨基态氮含量的影响
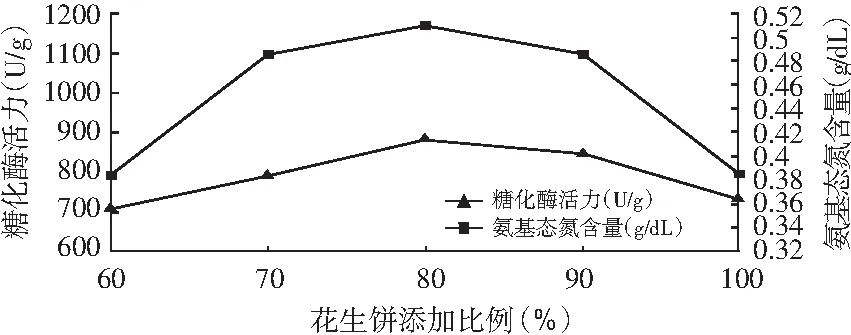
图5 米曲酶制曲花生饼添加比例对糖化酶活力和氨基态氮含量的影响

图6 黑曲霉制曲花生饼添加比例对糖化酶活力和氨基态氮含量的影响
由图5和图6可知,糖化酶活力和氨基态氮含量随着花生饼添加比例的增加而提高,达到一定的峰值后下降。花生饼添加比例达80%时,用黑曲霉和米曲霉制曲所得的曲的糖化酶活力和氨基态氮含量都达到最高值,这是因为麸皮质地疏松、体轻、表面积大,含有粗蛋白质、粗脂肪、粗纤维素,还有钙、铁等无机盐,能促进曲霉生长和产酶,提高酱原料的利用率和出品率。如果面粉添加太少,仅依靠花生饼不可以提供全面的营养给菌种;如果面粉添加比例太多,面粉包裹饼料,不利于制曲。
2.2 制曲条件的优化
米曲霉制曲因素水平表见表1。

表1 米曲霉制曲因素水平表
黑曲霉制曲因素水平表见表2。
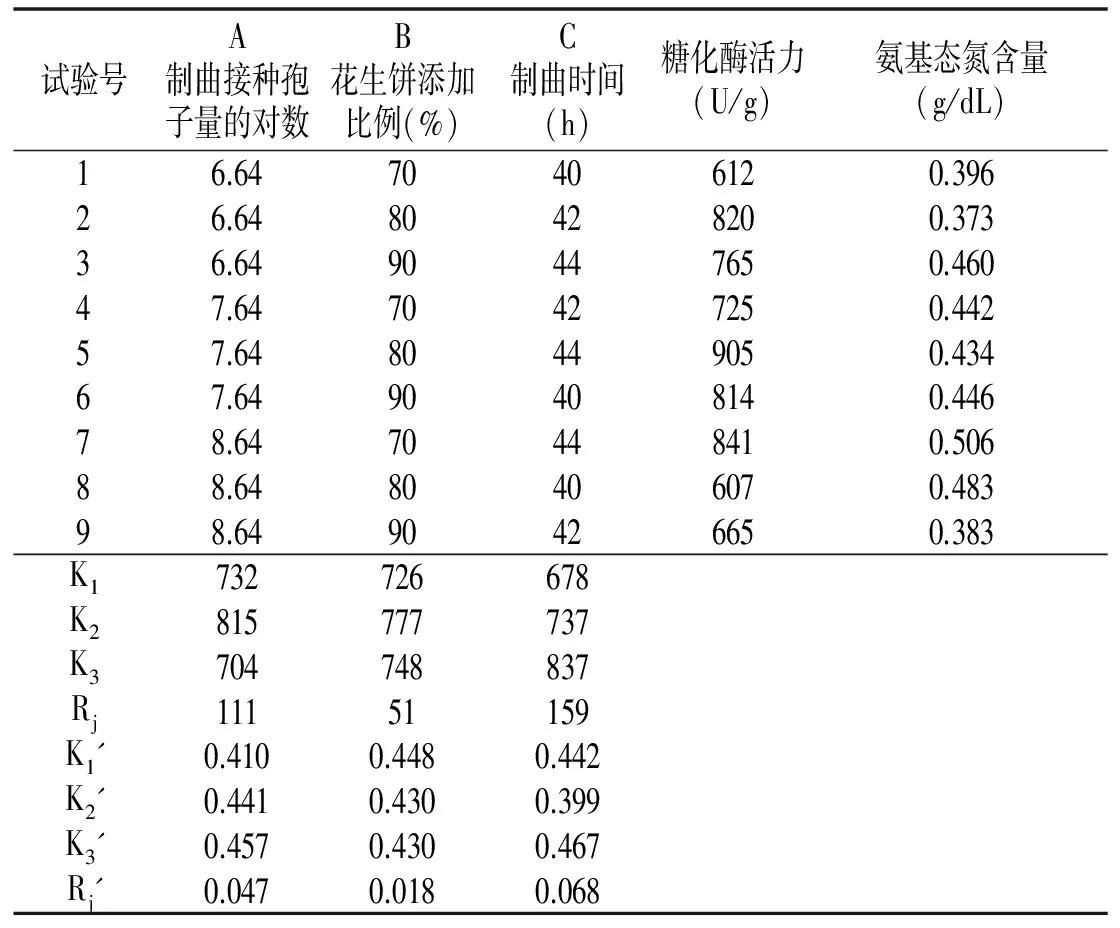
表3 米曲霉制曲正交试验结果
由表3可知,以糖化酶活力为依据,米曲霉单独制曲的最佳工艺为A2B2C3;以氨基态氮含量为依据,米曲霉单独制曲的最佳工艺为A3B1C3或A2B2C3。同时以糖化酶活力和氨基态氮含量为依据,综合考虑,可确定最佳工艺参数组合为A2B2C3,即试验序号5,制曲时间44 h,制曲接种孢子数7.64,即4.40×108个/g ,花生饼比例80%,糖化酶活力为905 U/g,氨基态氮含量为0.434 g/dL。
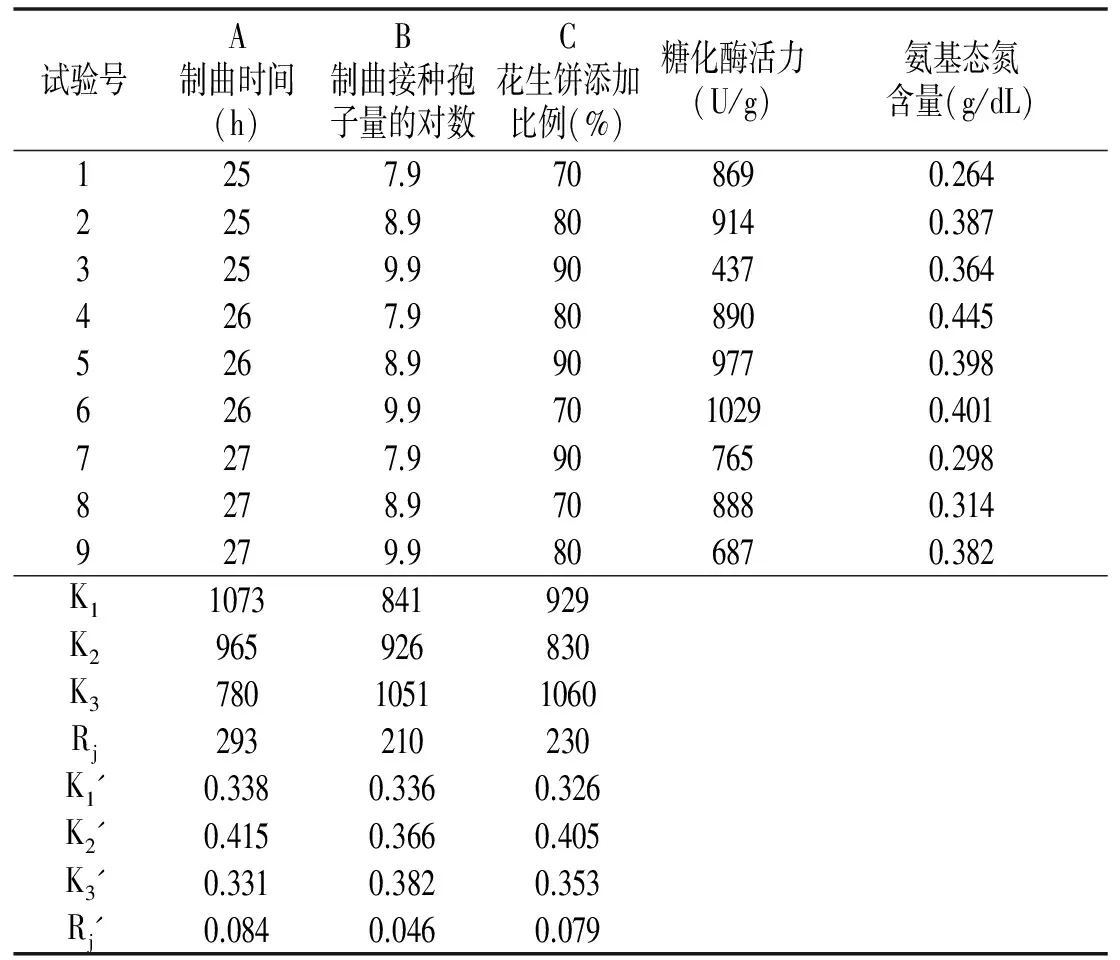
表4 黑曲霉制曲正交试验结果
由表4可知,以糖化酶活力为依据,黑曲霉单独制曲的最佳工艺为A1B3C3或A2B3C3;以氨基态氮含量为依据,黑曲霉单独制曲的最佳工艺为A2B3C2或A2B3C3;同时以糖化酶活力和氨基态氮含量为依据,综合考虑,可确定最佳工艺参数组合为A2B3C3。
另用最佳生产工艺参数组合A2B3C3制曲,测得其糖化酶活力为926 U/g,氨基态氮含量为0.450 g/dL。比正交试验各试验号都高,确定最佳生产工艺参数组合为A2B3C3,制曲时间26 h,制曲接种孢子数9.90,即8.03×109个/g ,花生饼比例90%,糖化酶活力为926 U/g,氨基态氮含量为0.450 g/dL。
3 结论
以花生饼为制曲培养基,以糖化酶活力和氨基态氮含量为依据,对培养时间、孢子接种量、花生饼原料比例分别进行单因素试验,确定单因素最佳值。再以单因素最佳值为参考,进行三因素三水平的正交试验。
米曲霉单独制曲的最佳工艺为:制曲时间44 h,制曲接种孢子数4.40×108个/g,花生饼比例80%,糖化酶活力为905 U/g,氨基态氮含量为0.434 g/dL;黑曲霉单独制曲的最佳工艺为:制曲时间26 h,制曲接种孢子数8.03×109个/g ,花生饼比例90%,糖化酶活力为926 U/g,氨基态氮含量为0.450 g/dL。实验结果表明:可以采用双菌种制曲工艺将花生饼制成花生酱,此研究结果为发酵法生产花生酱提供了理论依据。
[1]周琦,杨湄,黄凤洪.国外花生休闲食品研究进展[J].食品工业科技,2010(7):401-405.
[2]王强.花生加工品质学[M].北京:中国农业出版社,2013.
[3]郑海燕.传统发酵调味品的二次开发[J].中国调味品,2002(1):3-6.
[4]励建荣,姚蕾.中国传统调味品的现代化[J].中国调味品,2004(5):18-19.
[5]李旭,王新梅,魏莹,等.浅谈我国常用调味品的发展与展望[J].中国调味品,2013,38(9):18-23.
[6]Rozalli N H M,Chin N L,Yusof Y A, et al. Quality changes of stabilizer-free natural peanut butter during storage[J]. Journal of Food Science and Technology,2016,53(1):1-9.
[7]段家玉.冷榨花生饼制备花生蛋白和多肽的研究[D].武汉:华中农业大学,2006.
[8]张梦茹,刘美蓉,朱娜丽,等.豆渣发酵酱油关键技术[J].食品与发酵工业,2013,39(12):104-109.
[9]周显青,孟欢,张玉荣,等.基于响应面法米酱制曲工艺的优化[J].粮食与饲料工业,2015(9):38-41.
[10]付雯,李冬生,李卫,等.甜面酱双菌种制曲工艺条件的研究[J].中国调味品,2010,35(10):15-16.
[11]张振山,叶素萍,李泉,等.豆渣的处理与加工利用[J].食品科学,2004,25(10):400-405.
[12]邓静,吴华昌.不同诱变方法对米曲霉酶系的影响[J].中国酿造,2005(12):39-42.
[13]川阐,清华.酱油多菌种发酵关键技术研究[D].芜湖:安徽工程大学,2010.
[14]李旋,王君高,孙希叶,等.水分控制对酱油酿造的影响[J].中国调味品,2011,36(1):71-73.
[15]Fontana C,Vignolo G,Cocconcelli P S.PCR-DGGE analysis for the identification of microbial populations from Argentinean dried fermented sausages[J].Journal of Microbiological Methods,2006,63(3):254-263.
[16]大连轻工业学院.食品分析[M].北京:中国轻工业出版社,2009.
[17]张水华.食品分析实验[M].北京:化学工业出版社,2006.
[18]严鹤松.黑曲霉发酵豆粕的研究[D].武汉:华中农业大学,2009.
Study on Koji-making Process of Peanut Butter Made from Peanut Cake with Double Strains
ZHANG Ling*, LIANG Yan, CHEN Shan-mei, ZHANG Zhong
(College of Environment and Biological Engineering, Guangdong University of Petrochemical Technology,Maoming 525000, China)
Use the peanut cake scraps produced by high temperature oil extraction as raw material,inoculateAspergillusnigerandAspergillusoryzaeto prepare finshed koji of peanut butter respectively. Use saccharifying enzyme activity and amino nitrogen content of finshed koji as basis to examine the effect of peanut cake dosage, koji making time and spore inoculation amount on preparation of finshed koji, and use orthogonal test to optimize the optimum process conditions of two kinds of strains. The results show that the best conditions ofAspergillusoryzaekoji making are time of 44 h, spore inoculation amount of 4.40×108per g, peanut cake dosage proportion of 80%, under such conditions, the saccharifying enzyme activity of finished koji is 905 U/g, amino nitrogen content is 0.434 g/dL; the best conditions ofAspergillusnigerkoji making are time of 26 h, spore inoculation amount of 8.03×109per g, peanut cake dosage proportion of 90%, under such conditions, the saccharifying enzyme activity of finished koil is 926 U/g, amino nitrogen content is 0.450 g/dL. The results have provided foundation for the following study of using high-temperature peanut cake to prepare peanut butter.
peanut butter;Aspergillusoryzae;Aspergillusniger; koji making
2016-12-18 *通讯作者
茂名市科技计划项目(20140310);广东石油化工学院创新强校培育项目
张玲(1979-),女,副教授,硕士,主要从事农产品加工与贮藏方面的教学与研究工作。
TS201.1
A
10.3969/j.issn.1000-9973.2017.06.018
1000-9973(2017)06-0086-07
