草鱼鱼糜漂洗液中蛋白肽的制备及其功能性质的研究
2017-06-19丁小强陈丽丽白春清袁美兰赵利
丁小强,陈丽丽,白春清,袁美兰,赵利
(江西科技师范大学 生命科学学院 国家淡水鱼加工技术研发分中心,南昌 330013)
草鱼鱼糜漂洗液中蛋白肽的制备及其功能性质的研究
丁小强,陈丽丽,白春清,袁美兰,赵利*
(江西科技师范大学 生命科学学院 国家淡水鱼加工技术研发分中心,南昌 330013)
以草鱼鱼糜漂洗液回收蛋白为原料,短肽得率和水解度为指标,从5 种常用蛋白酶中选出碱性蛋白酶作为酶解回收蛋白的最适酶,通过单因素和响应面优化试验得出最佳酶解条件:酶解温度为52.51 ℃,酶解pH 为9.06,酶添加量为1.42%,酶解时间为60 min,酶解底物蛋白浓度为1 g/dL。在此条件下回收蛋白的水解度为20.86%,短肽得率为73.5%;比较酶解前后回收蛋白的功能性质,发现酶解后多肽的溶解性、乳化性和起泡能力有所增加,乳化稳定性、泡沫稳定性和持油性较酶解前有所降低。
碱性蛋白酶;蛋白质;水解度;多肽;功能性质
鱼糜是我国水产制品加工中重要的中间原料,在鱼糜生产加工中会产生大量富含蛋白质的废水,蛋白质的含量高达0.9%~2.8%,约占鱼肉蛋白的30%~40%[1]。鱼糜漂洗液回收蛋白中氨基酸种类齐全,比例均衡,符合FAO/WHO推荐的理想蛋白质模式,是理想的优质蛋白[2]。目前,关于从鱼糜漂洗液中回收蛋白的方式研究报道较多[3-5],可是对回收蛋白进行酶解深加工的研究报道较少。使用蛋白酶把回收蛋白降解成小分子肽,不但可以提高回收蛋白的利用率,且小分子肽也许存在多种生物活性和更好的功能性质,拥有很好的开发利用价值。
本文采用碱性蛋白酶对鱼糜漂洗液中的回收蛋白进行酶解,以水解度为指标,在温度、pH值、酶添加量、酶解时间、底物浓度5个单因素试验的基础上,运用响应面分析法对回收蛋白水解工艺进行优化,同时比较回收蛋白水解前后的功能性质,旨在为鱼糜漂洗液回收蛋白的深加工利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
漂洗液回收蛋白 实验室自制;中性蛋白酶(Neutrase)、复合蛋白酶(Protamex)、碱性蛋白酶(Alcalase)、风味蛋白酶(Flavourzyme) 北京诺维信生物技术有限责任公司;木瓜蛋白酶(Papain) 广西庞博生物工程有限公司;氢氧化钠、硫酸铜、硫酸钾等试剂 均为分析纯。
1.2 仪器与设备
12-H绞肉机 上海标本模型厂;85-1型磁力搅拌器 常州国华电器有限公司;TDL-5A离心机 上海菲恰尔分析仪器有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;BSA224S-CW型电子分析天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 鱼糜漂洗液中蛋白的回收
新鲜鱼肉绞碎→加水搅拌10 min→4层纱布过滤→调节漂洗液pH为5.5→5000 r/min离心5 min→回收蛋白。
1.3.2 回收蛋白的基本成分分析
水分含量的测定:干燥法(GB/T 5009.3-2010);粗蛋白含量的测定:凯氏定氮法(GB/T 5009.5-2010);灰分含量的测定:灼烧称重法(GB/T 5009.4-2010);粗脂肪含量的测定:索氏提取法(GB/T 5009.6-2003)。
1.3.3 回收蛋白酶解工艺流程
回收蛋白→加水匀浆→水浴加热→调pH值→加酶保温酶解→滴加1 mol/L氢氧化钠标准溶液维持pH不变→90 ℃以上灭酶10 min→4000 r/min离心15 min→上清液过滤→回收蛋白酶解液。
1.3.4 短肽得率的测定[6]
采用三氯乙酸-可溶性氮指数(TCA-NSI)对短肽得率进行测定,短肽得率计算公式如下:

式中:N1为离心上清液中可溶性氮含量;N0为酶解液中总含氮量。
1.3.5 水解度的测定
采用pH-State法[7]进行测定,水解度计算公式如下:
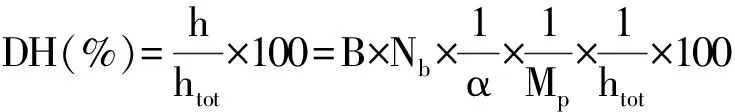
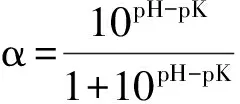
1.3.6 蛋白酶的选择
在底物蛋白浓度为1 g/dL、酶解90 min、酶添加量为底物蛋白1%时,分别选用中性蛋白酶、复合蛋白酶、碱性蛋白酶、风味蛋白酶以及木瓜蛋白酶对回收蛋白进行酶解,酶解温度和pH值参考推荐的最适酶解条件,见表1。

表1 蛋白酶酶解最适温度和pH值
1.3.7 碱性蛋白酶酶解条件的单因素试验
1.3.7.1 pH的选择
分别调整酶解pH值为7,8,9,10,11,其他酶解条件为底物蛋白浓度1 g/dL、酶添加量为底物蛋白的1%、酶解温度50 ℃、酶解时间90 min。
1.3.7.2 酶添加量的选择
分别调整酶添加量为底物蛋白的0.5%,1%,1.5%,2%,2.5%,其他酶解条件为底物蛋白浓度1 g/dL、酶解温度50 ℃、酶解pH值9、酶解时间90 min。
1.3.7.3 酶解温度的选择
分别调整酶解温度为30,40,50,60 ℃,其他酶解条件为底物蛋白浓度1 g/dL、酶添加量为底物蛋白的1%、酶解pH值9、酶解时间90 min。
1.3.7.4 酶解时间的选择
分别调整水解时间为30,60,90,120,150 min,其他酶解条件为底物蛋白浓度1 g/dL、酶解温度50 ℃、酶添加量为底物蛋白的1%、酶解pH值9。
1.3.7.5 底物蛋白浓度的选择
分别调整底物蛋白浓度为0.5,1,1.5,2,2.5 g/dL,其他酶解条件为温度50 ℃、酶解时间60 min、酶添加量为底物蛋白的1%、酶解pH值9。
1.3.8 响应面分析试验
在酶解单因素试验的基本上,运用 Box-Behnken 的中心组合[10],以水解度为响应值,选用酶解温度、酶解pH和酶添加量3个因素进行三因素三水平的响应面分析试验,试验因素水平及编码见表2。
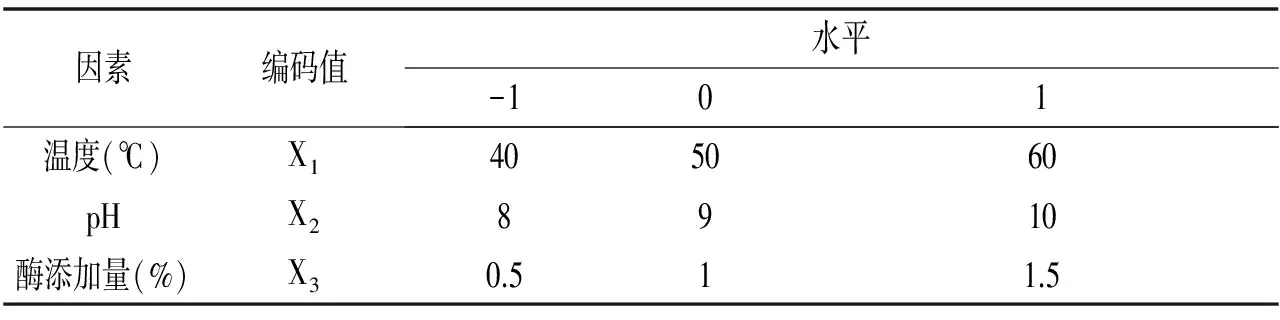
表2 碱性蛋白酶Box-Behnken试验计划
1.3.9 相对分子质量分布的测定
分别采用SDS-PAGE聚丙烯酰胺凝胶电泳法和HPLC[11]测定回收蛋白酶解前后相对分子质量分布。
1.3.10 溶解性[12]
蛋白质的溶解性通常采用氮溶指数(NSI)进行评价。0.1 g样品与20 mL去离子水混合,用5 mol/L HCl或NaOH溶液调节样液pH值(pH 3~10)。漩涡震荡5 min,5000 r/min离心10 min,采用考马斯亮蓝法测定样品溶液氮含量,氮溶指数计算公式如下:
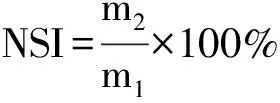
式中:m1为离心前溶液氮含量;m2为离心后溶液氮含量。
1.3.11 乳化性[13]
乳化性采用浊度法进行测定。取蛋白浓度为5 mg/mL的溶液40 mL,加入5 mL大豆色拉油,12000 r/min均质2 min,分别在0,10 min时快速从底部汲取样液0.1 mL,用15 mL 0.1%的SDS溶液进行稀释,稀释混匀后于500 nm处测定吸光值,以SDS溶液作为空白对照,乳化性(EAI)和乳化稳定性(ESI)计算公式如下:
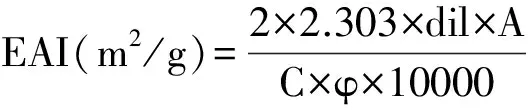

式中:dil为稀释倍数;A为乳化液的吸光值;C为样品浓度(g/mL);φ为乳化液中油相的比例;A0为初始乳化液的吸光值;At为10 min后的吸光值。
1.3.12 起泡性及泡沫稳定性[14]
取样品浓度为3%(W/V)的溶液100 mL,12000 r/min均质2 min,快速倒入250 mL的量筒中,起泡性(Fc)及泡沫稳定性(Fs)计算公式如下:

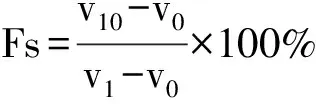
式中:v0为均质前体积;v1为均质后溶液与泡沫总体积;v10为均质10 min后溶液与泡沫总体积。
1.3.13 持油性[15]
将0.5 g蛋白样品置于离心管中,加入5 g大豆色拉油混匀,常温静置30 min后4000 r/min离心30 min,持油性(OHC)计算公式如下:
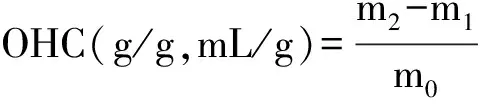
式中:m0为蛋白样品质量;m1为离心管质量;m2为离心后离心管与蛋白样品总质量。
2 结果与讨论
2.1 回收蛋白的基本成分分析
回收蛋白的基本成分含量见表3。

表3 回收蛋白的基本成分分析
由表3可知,回收蛋白中水分含量最高,其次为蛋白质含量,脂肪和灰分的含量较少。回收蛋白样品的蛋白含量为11.28%,约占干基总量的67.34%。
2.2 酶种类的选择
5种蛋白酶对回收蛋白的酶解效果见图1。
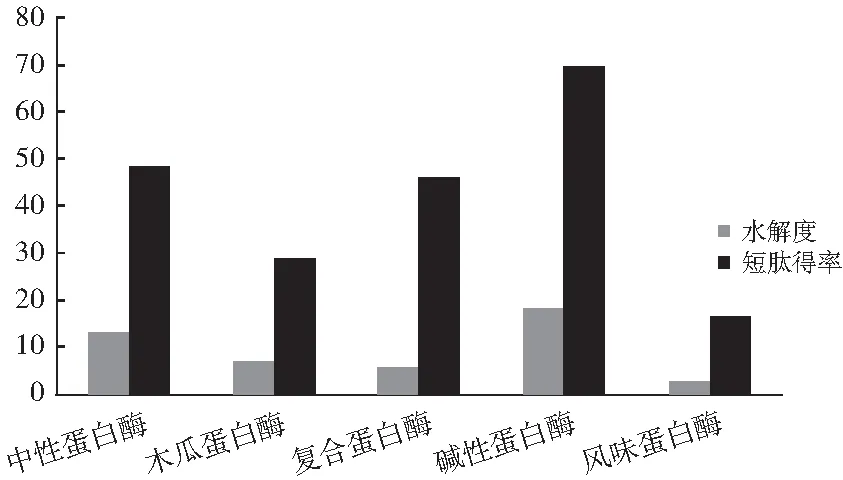
图1 不同酶酶解效果对比
由图1可知,水解度和短肽得率由高到低的次序均为碱性蛋白酶>中性蛋白酶>复合蛋白酶>木瓜蛋白酶>风味蛋白酶。因此,本试验选用碱性蛋白酶对回收蛋白进行酶解优化。
2.3 碱性蛋白酶酶解工艺的单因素试验
2.3.1 pH的影响
pH对回收蛋白酶解的影响见图2。
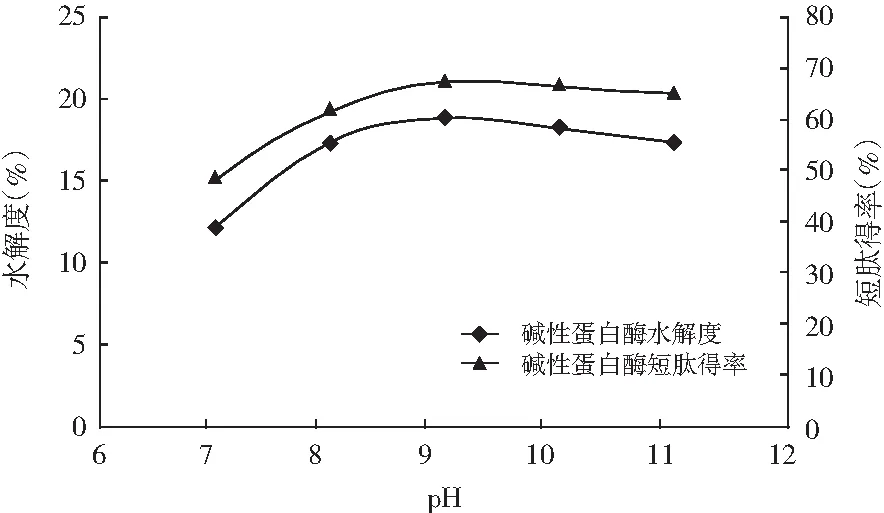
图2 pH对DH和TCA-NSI的影响
由图2可知,回收蛋白酶解物的短肽得率和水解度均随酶解pH值的增大呈先升后降的趋势。在pH值为9时,回收蛋白酶解物的短肽得率和水解度达到最大值。这主要是因为过酸、过碱会使酶的空间结构发生变化或者导致酶的活性部分丧失,从而降低酶的活性[16]。因此,本试验选择酶解pH为9。
2.3.2 酶添加量的影响
酶添加量对回收蛋白酶解的影响见图3。

图3 酶添加量对DH和TCA-NSI的影响
由图3可知,在酶添加量为底物蛋白的0.5%~1%范围时,回收蛋白酶解物的短肽得率和水解度快速上升;当酶添加量大于底物蛋白1% 时,短肽得率几乎不再增长,水解度也趋于平缓。因此,本试验选择酶添加量为1%。
2.3.3 酶解温度的影响
温度对回收蛋白酶解的影响见图4。
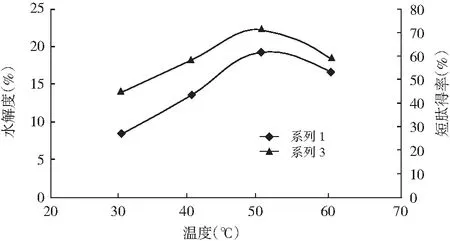
图4 温度对DH和TCA-NSI的影响
由图4可知,回收蛋白酶解物的短肽得率和水解度均随着酶解温度的上升呈先升后降的趋势,在50 ℃时,回收蛋白酶解物的短肽得率和水解度均达到最大值。这是因为温度较低时,酶活性较低,不利于与底物结合;温度较高时,酶部分失活,同时底物蛋白部分变性,影响酶与底物的相互作用[17]。因此,本试验选择酶解温度为50 ℃。
2.3.4 酶解时间的影响
酶解时间对回收蛋白酶解的影响见图5。

图5 酶解时间对DH和TCA-SNI的影响
由图5可知,回收蛋白酶解物的短肽得率和水解度均随酶解时间的增加呈先快速上升后趋于平缓的趋势。当酶解时间超过60 min时,水解度及短肽得率变化不明显。因此,本试验选择酶解时间为60 min。
2.3.5 底物浓度的影响
底物浓度对回收蛋白酶解的影响见图6。

图6 底物浓度对DH和TCA-SNI的影响
由图6可知,回收蛋白酶解物的短肽得率和水解度均随底物蛋白浓度增加呈下降的趋势,在底物蛋白浓度为0.5~1 g/dL时,两者下降幅度较小;在底物蛋白浓度大于1 g/dL时,下降幅度均较大。这可能是因为底物浓度太大,会导致底物不在酶分子附近,使得酶解速率降低,同时妨碍酶解产物的分散。在工业生产中,底物浓度过低时,不利于企业快速生产,所以结合酶解效果和经济效益,本试验选择酶解底物蛋白浓度为1 g/dL。
2.4 碱性蛋白酶酶解回收蛋白条件的响应面优化
2.4.1 响应面试验及方差分析
研究单因素试验结果发现:在同一条件下,回收蛋白的水解度和短肽得率变化趋势基本一致。为了简化试验,选择水解度为指标,使用 Box-Behnken 试验设计的基本思路,以pH值、酶添加量、温度为变量,实施三因素三水平的响应面试验,见表4。

表4 Box-Behnken试验设计及结果
使用Design Expert 7.0 软件处理,得出各项回归系数,形成水解度及三因素的数学回归模型:水解度=-222.49025+3.48962X1+29.5815X2+25.32150X3+0.017X1X2+0.0735X1X3+0.07X2X3-0.035692X12-1.68675X22-10.477X32。
水解度回归模型方差分析表见表5。
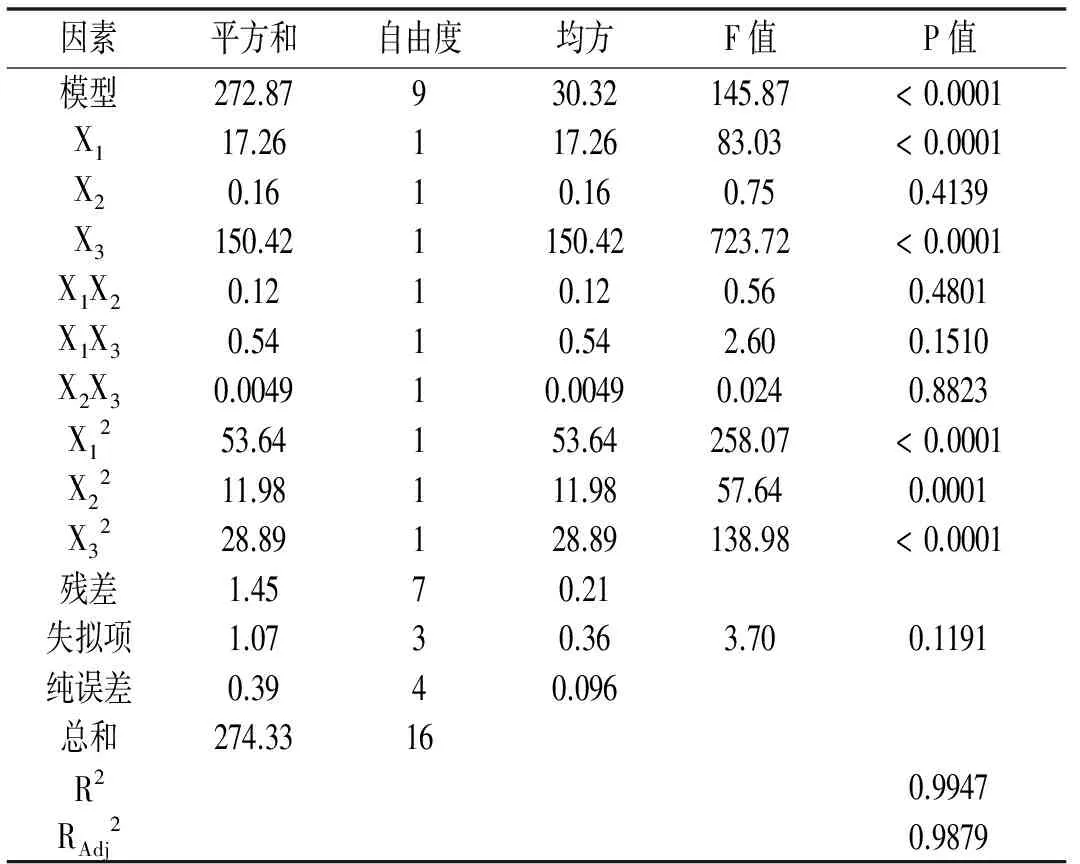
表5 水解度回归模型方差分析表
注:P<0.05表示差异显著;P<0.01表示差异极显著。
由表5可知,水解度的回归模型具有高度显著性;且失拟项P=0.1191>0.05,不显著,由于失拟项用来表示预测值与真实值不相符的概率[18],因此此模型合理;RAdj2=0.9879,表明此模型能反映约98.79%实际值,所以此模型可以用来分析和预测碱性蛋白酶酶解回收蛋白中各要素对水解度的影响。分析均方可知,三因素对水解度的影响次序是酶添加量>酶解温度>酶解pH值。
2.4.2 最佳工艺条件及验证
经响应面分析得出酶解最佳工艺条件,即温度52.51 ℃、pH值9.06、酶添加量1.42%、时间60 min、底物浓度1 g/dL,此时蛋白质水解度为21.19%。为了检验此模型的正确性,选用碱性蛋白酶酶解温度为52.5 ℃、酶解pH值为9、酶添加量为1.40%、酶解时间为60 min、底物蛋白浓度为1 g/dL的前提下进行反应,得出碱性蛋白酶水解度实际值为20.86%,短肽得率为73.5%。模型预测值与真实值基本相同,表明模型可靠有用。
2.5 相对分子质量分布的测定

图7 回收蛋白的SDS-PAGE电泳分析
利用SDS-PAGE对回收蛋白进行相对分子质量分析,由图7可知,回收蛋白的分子量主要分布在30~250 kDa,且在分子量40~50 kDa出现比较明显的条带,说明回收蛋白的组分主要为大分子蛋白质。
回收蛋白酶解物相对分子质量见表6。

表6 回收蛋白酶解后的相对分子质量分布

续 表
由表6可知,回收蛋白经碱性蛋白酶酶解后,相对分子质量分布明显变小,酶解物的相对分子质量主要分布在180~1000 Da之间,其中相对分子质量在180~500 Da之间所占比例为43.14%。
2.6 回收蛋白和多肽功能性质的比较
2.6.1 溶解性
pH值对回收蛋白溶解性的影响见图8。
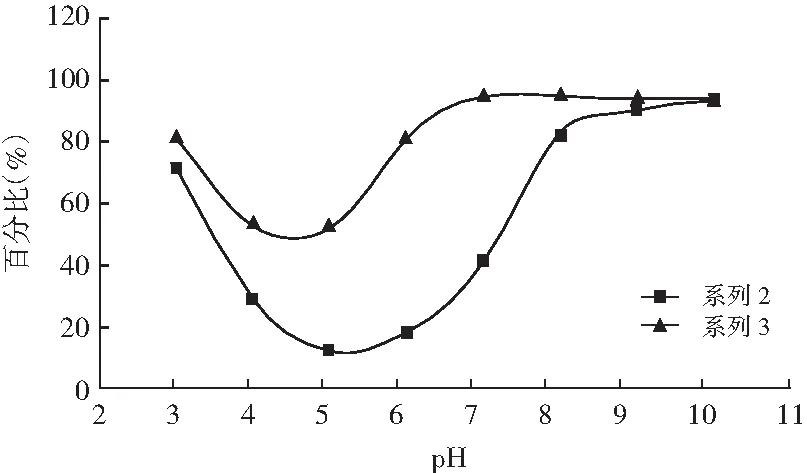
图8 pH值对回收蛋白溶解性的影响
由图8可知,在pH为4~6时,两者溶解性均有所降低,但是回收蛋白酶解后,溶解性明显提高。这是因为蛋白酶解后,蛋白肽健断裂,分子量有所降低,暴露在外的氨基和羧基等亲水性基团数量增加,从而提高了酶解产物的溶解性[19]。
2.6.2 乳化性及乳化稳定性
pH对回收蛋白酶解前后乳化性的影响见图9。

图9 pH对回收蛋白酶解前后乳化性的影响
由图9可知,回收蛋白酶解前后的乳化性均随pH值的升高出现先降后升的趋势。在pH 5.0时,两者乳化性最小。这是由于在pH 5.0时,蛋白溶解性较低,致使较少蛋白在油/水界面分散,所以乳化性最低;相反,溶解性增大,乳化性增强[20]。由图9还可知,回收蛋白酶解后的乳化性有所增强,这是由于酶解后的蛋白溶解性增大,容易在油/水界面扩散[21]。
pH对回收蛋白酶解前后乳化稳定性的影响见图10。

图10 pH对回收蛋白酶解前后乳化稳定性的影响
由图10可知,回收蛋白酶解后的乳化稳定性较酶解前在不同pH下均有所减少。这是因为蛋白酶解之后,相对分子质量减小,吸附在膜上的能力下降,从而在油滴周围形成的蛋白质层变动,乳化稳定性下降[22]。
2.6.3 起泡性和泡沫稳定性
回收蛋白酶解前后在pH 3~10范围内的起泡性见图11。

图11 pH对起泡性的影响
由图11可知,二者均随pH值的增大出现先下降后上升的趋势,在pH 5.0时,两者起泡性最低,这可能是由于蛋白的起泡与溶解度有关;在pH 5.0时,溶解度最差,不利于蛋白在水与空气的界面进行扩散和捕获空气粒子,从而泡沫性最小;相反溶解度增大,起泡性增加[23],因为酶解后的蛋白溶解性增大,易于捕获空气粒子,所以回收蛋白酶解后的起泡性有所增加。
回收蛋白酶解前后在pH 3~10范围内的泡沫稳定性见图12。

图12 pH对泡沫稳定性的影响
由图12可知,回收蛋白酶解前后的起泡性随pH值的增大均呈先升后降的趋势,在pH 5.0时,二者起泡稳定性最大,这是由于在pH 5.0时靠近蛋白等电点,泡沫在等电点范围内破损较为缓慢。同时,回收蛋白酶解后的泡沫稳定性不如酶解前,这是由于回收蛋白酶解后分子量减少,而小分子量的蛋白维持泡沫稳定的能力较弱,所以起泡稳定性有所降低[24]。
2.6.4 持油性
回收蛋白酶解前后的持油性见图13。

图13 pH对回收蛋白酶解前后持油性的对比
由图13可知,回收蛋白酶解后的持油性有所下降,这是因为酶解把蛋白质的一、二级结构摧毁了,破坏了蛋白的网络结构,物理截留油粒的作用降低,酶解后吸油性有所下降[25]。
3 结论
选用5种蛋白酶酶解回收蛋白,以酶解物短肽得率及水解度为指标,观察各自最适前提下的酶解能力,得出碱性蛋白酶为最优酶。
碱性蛋白酶酶解回收蛋白的最适条件为:温度52.51 ℃、pH值9.06、酶添加量1.42%、时间60 min、底物蛋白浓度1 g/dL。
酶解使回收蛋白的溶解性增加较为明显,同时起泡性和乳化性也有所改良;而泡沫稳定性、乳化稳定性及持油性有所下降,这些结果表明回收蛋白酶解物可以作为一种具备优良溶解度的食品添加剂,为回收蛋白开发使用开拓了新路径。
[1]汪之和,陶妍,刘振华.白鲢漂洗鱼糜和未漂洗碎鱼肉营养成分的分析比较[J].淡水渔业, 1999,29(8):16-18.
[2]丁小强,赵利,付雪军,等.鱼糜漂洗液蛋白质回收工艺的研究[J].科学养鱼,2016(2):76-78.
[3]Huang L, Morrissey M T.Fouling of membranes during microfiltration of surimi wash water: roles of pore blocking and surface cake formation[J].Journal of Membrane Science,1998,144(1):113-123.
[4]Honer C.Nature's "nearly-perfect protein"[J].Dairy Food,1986,87:45.
[5]Nishioka F,Shimizu Y.Recovery of proteins from washings of minced fish meat by pH-shifting method[J].Bulletin of the Japanese Society of Scientific Fisheries(Japan),1983, 49:795-800.
[6]Chavan U D, McKenzie D B, Shahidi F. Functional properties of protein isolates from beach pea(LathyrusmaritimusL.)[J].Food Chemistry,2001,74(2):177-187.
[7]袁斌,吕桂善,刘小玲.蛋白质水解度的简易测定方法[J].广西农业生物科学,2002,21(2): 113-115.
[8]李雪,罗永康,尤娟.草鱼鱼肉蛋白水解物抗氧化性及功能特性研究[J].中国农业大学学报,2011,16(1): 94-99.
[9]Linder M,Fanni J,Parmentier M,et al.Protein recovery from veal bones by enzymatic hydrolysis[J].Journal of Food Science,1995,60(5):949-952.
[10]Box G E P, Behnken D W.Some new three level designs for the study of quantitative variables[J].Technometrics,1960,2(4):455-475.
[11]石岭.草鱼多肽粉及其功能性质的研究[D].南昌:江西科技师范大学,2014.
[12]Ponnampalam R, Goulet G, Amiot J, et al. Some functional and nutritional properties of oat flours as affected by proteolysis[J].Journal of Agricultural and Food Chemistry,1987,35(2):279-285.
[13]Pearce K N, Kinsella J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[14]Pedroche J, Yust M M, Lqari H, et al. Brassica carinata protein isolates: chemical composition, protein characterization and improvement of functional properties by protein hydrolysis[J].Food Chemistry,2004,88(3):337-346.
[15]Bencina M. Functional properties of drum-dried chickpea flours[J].Journal of Food Science,1996,51:1518-1526.
[16]张宇昊,王强酶.水解花生蛋白制备花生短肤的研究[J].农业工程学报,2007,23(4):258-263.
[17]Tello P G,Camacho F,Jurado E, et al. Enzymatic hydrolysis of whey protein: I kinetic models[J].Biotechnology and Bioengineering,1994,44(4):523-528.
[18]Rastogi N K, Rashmi K R.Optimization of enzymatic liquefaction of mango pulp by response surface methodology[J].European Food Research and Technology,1999,209(1):57-62.
[19]朱艳华.玉米多肽的制备、理化性质及生物活性的研究[D].武汉:华中农业大学,2007.
[20]Nie L, Siebert K J. Modeling physicochemical properties and activity of aspartyl proteinases based on amino acid composition[J].Journal of Agricultural and Food Chemistry,2009,57(6):2536-2543.
[21]孙英.茶籽饼粕多肽的制备、纯化及抗氧化活性研究[D].广州:华南农业大学,2013.
[22]Qi M, Hettiarachchy N S, Kalapathy U. Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J].Journal of Food Science, 1997, 62(6): 1110-1115.
[23]Lawal O S, Adebowale K O, Ogunsanwo B M, et al. On the functional properties of globulin and albumin protein fractions and flours of African locust bean(Parkiabiglobossa)[J].Food Chemistry,2005,92(4):681-691.
[24]Shahidi F,Han X Q, Synowiecki J. Production and characteristics of protein hydrolysates from capelin(Mallotusvillosus)[J].Food Chemistry,1995,53(3):285-293.
[25]陈志军,李向红,刘永乐,等.鲢鱼蛋白酶法水解产物的功能性质[J].食品科学,2012,33(5):62-65.
Study on Preparation and Functional Properties of Polypeptides from Wash Liquid of Grass Carp Surimi
DING Xiao-qiang, CHEN Li-li, BAI Chun-qing, YUAN Mei-lan, ZHAO Li*
(National Freshwater Fish Processing Technology Research and Development Branch Center, College of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China)
Proteins recovered from grass carp surimi wash liquid are as raw materials, alkaline protease is identified as the most suitable enzyme for enzymatic hydrolysis of protein among 5 commonly used enzymes based on simultaneous consideration of trichloroacetic acid nitrogen solubility index (TCA-NSI) and degree of hydrolysis (DH). According to single factor experiment and response surface methodology, the optimal enzyme reaction system is obtained as follows: hydrolysis temperature is 52.51 ℃, hydrolysis pH is 9.06, enzyme additive amount is 1.42%, hydrolysis time is 60 min and substrate concentration is 1 g/dL. Under the optimal hydrolysis conditions, the TCA-NSI and DH are 73.5% and 20.86%. The functional properties of protein before and after hydrolysis are compared; the results show that the solubility, emulsifying and foaming of protein have been increased after enzymatic hydrolysis than before. However, the emulsifying stability, oilabsorption capacity and foaming stability are decreased.
alkaline protease; protein; degree of hydrolysis; polypeptides; functional properties
2016-12-15 *通讯作者
江西省高等学校科技落地计划项目(KJLD12009);江西省现代农业产业技术体系建设专项资金资助(赣财教指2013-258);国家农业科技成果转化项目(国科办农[2014]42号)
丁小强(1989-),男,江西新余人,硕士,研究方向:食品化学; 赵利(1967-),女,江西南昌人,教授,博士,研究方向:食品化学。
TS201.21
A
10.3969/j.issn.1000-9973.2017.06.007
1000-9973(2017)06-0034-08
