一种功能型酵母菌的构建及功能验证
2020-09-09刘辉何太波赵国淼
刘辉 何太波 赵国淼

摘 要:采用Golden Gate Assembly的方法,将糖化酶基因glaA导入到实验室前期筛选的一株耐高温酿酒酵母S.C HR的基因组中,筛选到了一株同时具有耐高温及产糖化酶特性的功能型酵母COTYT-H。发酵实验结果表明:所构建的COTYT-H菌株能够分泌糖化酶,且能够在高温条件下具有良好的发酵性能,应用该菌株可在减少冷却水用量、糖化酶用量、降低能耗、节约生产成本的同时,提高原料利用率,提升生产效益。
关 键 词:糖化酶;酵母;乙醇
中图分类号:TQ 926.4 文献标识码: A 文章编号: 1671-0460(2020)08-1703-04
Abstract: The Golden Gate Assembly method was used to introduce the glucoamylase gene glaA into the genome of a thermotolerant yeasts SC HR which was screened earlier in the laboratory. A functional yeast COTYT with both high temperature resistance and saccharifying enzyme properties was selected. The fermentation experiment results showed that the COTYT-H strain constructed in this research could secrete saccharifying enzymes and had good fermentation performance under high temperature conditions. The application of this strain could reduce the amount of cooling water, the amount of saccharifying enzymes, reduce energy consumption and costs, as well as increase the utilization rate of raw materials and improve production efficiency.
Key words: Glucoamylase1; Yeast; Alcohol
釀酒酵母(Saccharomyces cerevisiae)是长期并广泛应用于发酵工业、乙醇生产及食品等行业的重要微生物[1]。酵母不能直接利用淀粉生产乙醇,因此通常采用糖化酶来分解淀粉[2-3]以供酵母利用。糖化酶亦称葡萄糖淀粉酶、α-1,4-葡萄糖水解酶,从淀粉非还原性末端依次水解α-1,4-葡萄糖苷键,并使水解下来的葡萄糖构象发生改变,形成β-D-葡萄糖[4-6]。把糖化酶基因引入到酿酒酵母中,构建能分泌糖化酶的酿酒酵母,是目前酒精工业的研究方向之一[7-9]。目前酒精生产中广泛应用的糖化酶主要产自黑曲霉(Aspergillus niger)、臭曲霉(Aspergillus foetides)、得氏根霉(Rhizopus niveus)和泡盛曲霉(Aspergillus awamori)等[10]。
在工业生产过程中,酿酒酵母需要面对高温、渗透压和乙醇等多种环境因素的胁迫[11-12]。传统的酿酒酵母乙醇发酵的最适温度在28~33 ℃,最高耐受温度为35 ℃[13]。但在我国南方及盛夏时的北方地区,由于环境温度较高以及发酵设备换热能力不足,导致发酵罐内部核心温度可达到40 ℃以上,严重抑制了酵母菌的生长和代谢,严重降低了生物乙醇的生产效率[14]。应用既能产糖化酶又能在高温环境下具有良好发酵性能的酿酒酵母菌株,在发酵温度较高时,可在保证酵母代谢正常进行的同时减少冷却水用量,降低生产负荷,减少生产能耗。另外,其产糖化酶的特性,可自身分泌一部分的糖化酶,减少糖化酶的使用量,节约生产成本[15]。
本研究采用Golden Gate重组的方法[16-18]构建糖化酶基因glaA在酿酒酵母中的表达载体,将表达载体导入到实验室前期筛选的一株耐高温酿酒酵母S.C HR中进行整合,筛选出3株具有糖化功能的耐高温酿酒酵母。进一步的发酵实验结果表明,COTYT-H菌株具有耐高温及产糖化酶的性能,能减少糖化酶的使用量,节约辅料成本。同时,其耐高温的特性在维持生产稳定的同时降低冷冻水用量,降低能耗,节约生产成本,适合于乙醇的大规模生产。
1 实验部分
1.1 材料
1.1.1 菌株和质粒
出发菌株S.C HR为前期实验室诱变筛选到的耐高温酿酒酵母;用于活性检测酶表达用的毕赤酵母P. pastoris GS115和用于质粒构建、基因克隆的克隆宿主大肠杆菌(E. coli)DH5α均来自本实验室;P. pastoris的表达质粒pGAPZa为组成型表达质粒,由实验室前期自行构建保存;糖化酶表达盒的构建采用Golden Gate Assembly的方式进行组装,中间构建质粒均为实验室自行构建保存。
1.1.2 培养基
YPD固体培养基(质量分数):1%酵母提取物,2%蛋白胨,2%葡萄糖,15%琼脂。
YPS固体培养基(质量分数):1%酵母提取物,2%蛋白胨,2%可溶性淀粉,15%琼脂。
2YT固体培养基(质量分数):1%酵母提取物,1.6%蛋白胨,0.5%NaCl,15%琼脂。
1.2 分析方法
1.2.1 糖化酶基因筛选
通过对brenda-enzymes、PDB、NCBI数据库进行搜索比对,获得来源多个微生物的glaA基因,通过序列比对分析,选中来源扣囊复膜酵母Saccharomycopsis fibuligera的糖化酶glaA(Accession 19032257),氨基酸序列如下:
MIRLTVFLTAVFAAVASCVPVELDKRNTGHFQAYSGYTVARSNFTQWIHEQPAVSWYYLLQNIDYPEGQFKSAKPGVVVASPSTSEPDYFYQWTRDTAITFLSLIAEVEDHSFSNTTLAKVVEYYISNTYTLQRVSNPSGNFDSPNHDGLGEPKFNVDDTAYTASWGRPQNDGPALRAYAISRYLNAVAKHNNGKLLLAGQNGIPYSSASDIYWKIIKPDLQHVSTHWSTSGFDLWEENQGTHFFTALVQLKALSYGIPLSKTYNDPGFTSWLEKQKDALNSYINSSGFVNSGKKHIVESPQLSSRGGLDSATYIAALITHDIGDDDTYTPFNVDNSYVLNSLYYLLVDNKNRYKINGNYKAGAAVGRYPEDVYNGVGTSEGNPWQLATAYAGQTFYTLAYNSLKNKKNLVIEKLNYDLYNSFIADLSKIDSSYASKDSLTLTYGSDNYKNVIKSLLQFGDSFLKVLLDHIDDNGQLTEEINRYTGFQAGAVSLTWSSGSLLSANRARNKLIELL。
送往上海生工生物工程有限公司进行全基因合成并进行参照酿酒酵母偏爱的密码子进行优化,根据密码子优化后的基因序列信息设计扩增引物GA-F1和GA-SP-R1,并以全基因合成的glaA质粒为模板扩基因。其中扩增引物为:
GA-F1:AACACTGGACATTTCCAAGC;GA-SP-R1:TCAAAGAAGTTCAATCAATTTGTT。
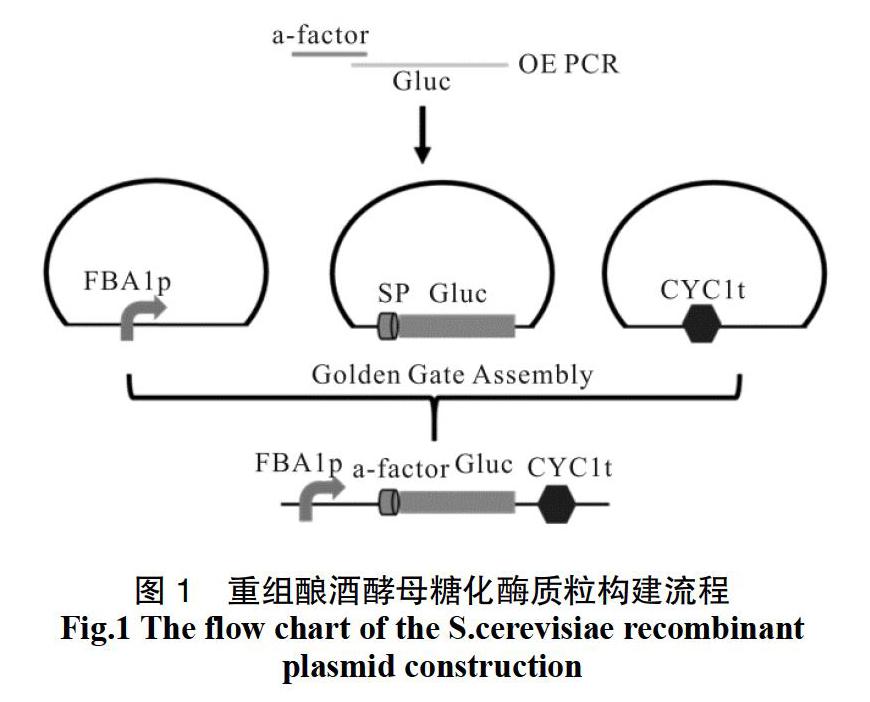
选用酿酒酵母强启动子和a-factor信号肽,采用OE PCR扩增获得带有信号肽的糖化酶片段,隨后采用golden gate assembly的方法构建完成糖化酶表达盒(图1)。经测序验证表达盒无误后,采用OE PCR 连接抗性基因表达盒,选取酿酒酵母基因组多拷贝的rDNA为糖化酶基因的整合位点,采用Q5高保证酶一步扩增获得组装完成的基因组整合大片段。
1.2.2 耐高温糖化酵母的构建
利用质粒提取试剂盒提取大肠杆菌中测序验证正确的阳性克隆质粒。按照Bln I酶切体系将5~10 μg质粒在37 ℃水浴锅中酶切线性化过夜;酶切产物的纯化按照DNA纯化回收试剂盒进行操作,回收后的线性化片段与80 μL GS115感受态细胞混合,电击后立刻加入1 mL 1 mol·L-1预冷山梨醇,然后在30 ℃培养箱静置孵育1~2 h。5 000 r·min-1离心1 min,弃上清液,用 100 μL 1 mol·L-1的山梨醇重悬,重悬的细胞涂布于含有zeocin抗生素的YPD平板,30 ℃倒置培养3 d,观察菌落生长情况;以平板上挑取的单菌落作为模板,所述菌落PCR条件进行阳性克隆鉴定,PCR反应结束后琼脂糖凝胶电泳检测,筛选得到阳性菌株。挑取生长出来的单克隆转板至YPS平板进行糖化酶活性粗筛,整合糖化酶的基因工程菌在YPS平板上可见明显的淀粉水解圈。进而挑取具有水解圈的转化子,进行摇瓶培养3 d后,对其培养集中的糖化酶采用DNS方法进行酶活检测。
1.2.3 重组酿酒酵母减糖化酶发酵性能验证
以液化醪为底物,将目前工业生产使用商业酿酒酵母菌株(商业酵母)及构建获得的菌株分别接种YPD摇瓶(500 mL),经过培养达到一定的酵母数,按0.125亿·mL-1液化醪折算用量,离心、水洗一次,用生理盐水悬浮至2.5 mL,洗净后分别接种至加量0.9 kg·t-1粮(添加比例100%)和0.45 kg·t-1粮(添加比例50%)外源糖化酶的350 g液化醪中,发酵72 h,其中商业酵母一实验组(100%糖化酶加量)发酵温度32 ℃至发酵结束,期间温度不调整,剩余实验组进行调整发酵,调整方案:0~16 h温度32 ℃,17 h温度调至33 ℃,18 h温度调至34 ℃,19 h温度调至35 ℃至发酵结束。
2 结果与分析
2.1 糖化酶基因克隆及检测
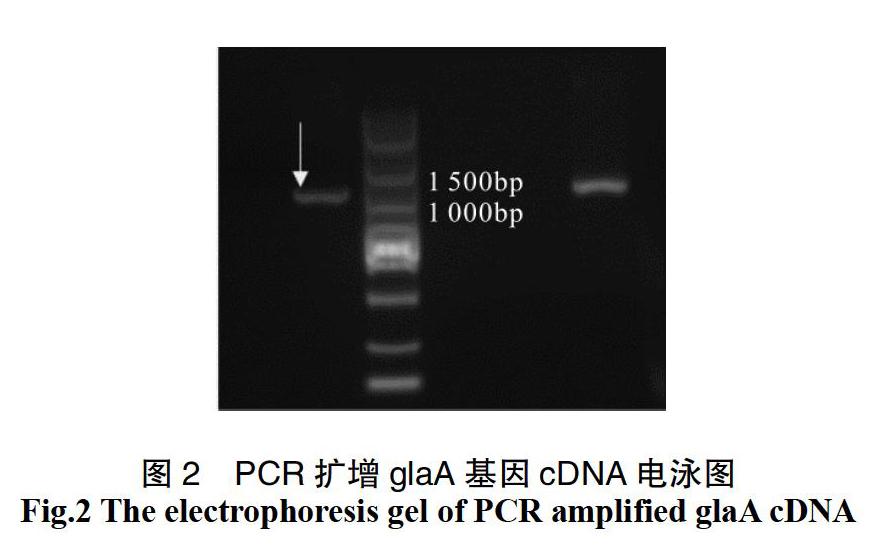
用高保真Pfu DNA聚合酶扩增得到glaA的cDNA序列约1 500 bp,与目的基因大小相符(图2)。PCR产物经纯化试剂盒纯化回收后,与克隆载体pMD18相连转入大肠杆菌E.coli DH5α感受态细胞,提取阳性克隆后送测序。测序结果表明,与S.fibuligera糖化酶(Accession 19032257)序列相似性为100%,证明已克隆得到glaA基因。
2.2 重组表达载体的构建与转化
glaA与GS115连接转化后,在LB/zeocin抗性平板上挑取单菌落于LB液体培养基中培养,提取质粒后经双酶切得到约1 500 bp的产物,证明酵母重组表达载体GS115-glaA构建成功。选用酿酒酵母强启动子和a-factor信号肽(引导糖化酶分泌胞外表达)构建糖化酶表达盒,采用OE PCR扩增获得带有信号肽的糖化酶片段,随后采用golden gate assembly的方法构建完成糖化酶表达盒,扩增结果如图3。经测序验证表达盒无误后,进一步用Q5高保证酶扩增糖化酶表达盒,采用OE PCR连接抗性基因表达盒,选取酿酒酵母基因组多拷贝的rDNA为糖化酶基因的整合位点,采用Q5一步扩增获得组装完成的基因组整合大片段,电泳结果如图4。
2.3 糖化酶基因克隆及检测
对挑取出的具有水解圈的转化子,进行摇瓶培养3天后,对其培养基中的糖化酶采用DNS方法进行酶活检测。由表1结果可知,整合耐高温酿酒酵母S.C HR基因组后获得了不同酶活水平的糖化酶酿酒酵母COTYT-H、COTYT-M和COTYT-L,其中COTYT-H酶活较高,COTYT-M次之,COTYT-L酶活最低。
2.4 功能型酵母发酵效果评价
2.4.1 成熟醪残糖对比
残总糖是酒精发酵后醪液内残留的糖分,是衡量酒精发酵程度的重要指标之一,控制残糖可有效提高发酵水平,提升经济效益。通过表2的数据可以看出,商业酵母在高温发酵条件下,残总糖含量明显升高,而功能型酵母在高温发酵条件下仍能保持较低的残总糖含量,在糖化酶加量降低50%以后,COTYT-H菌种仍具有较好的发酵效果。
2.4.2 成熟醪酒精度对比
通过图5的数据可以看出,商业酵母在高温发酵条件下,成熟醪内酒分含量明显降低,而使用功能型酵母,高温发酵条件下仍能保持较好的发酵水平,在糖化酶加量降低50%以后,COTYT-H菌种成熟醪酒分仍高于商业酵母(糖化酶100%,不调整温度)实验组。
3 结束语
本研究成功将糖化酶基因导入耐高温酿酒酵母基因组中,并最终获得了3株可用于工业发酵验证的糖化酵母COTYT-H、COTYT-M和COTYT-L。发酵性能测定结果显示:糖化酵母COTYT-H经真实物料中试验证可有效节省50%糖化酶的使用,发酵的各项指标与糖化酶不减量的市售酿酒酵母发酵性能一致,达到实际生产对菌株发酵指标的各项要求,可用于乙醇工业化生产。
参考文献:
[1]齐显尼,甘雨满,王钦宏.耐高温酿酒酵母的选育及其在乙醇发酵生产中的应用[J].生物产业技术,2018(4):84-89.
[2]PACIELLO L, ZUECO J. On the fermentative behavior of auxotrophic strains of Saccharomyces cerevisiae[J]. Electronic Journal of Biotechnology, 2014, 17(5):246-249.
[3]PEREIRA A P, MENDES-FERREIRA A. High-cell-density fermentation of Saccharomyces cerevisiae for the optimisation of mead production[J]. Food Microbiology, 2013,33(1):114-123.
[4]黎卫强.糖化酶在食品工业中的应用研究进展[J].沿海企业与科技,2010(4):65-6.
[5]LORENZO, FAVARO. Codon-optimized glucoamylase sGAI of Aspergillus awamori improves starch utilization in an industrial yeast[J]. Applied Microbiology & Biotechnology, 2012, 95:957-968.
[6]武金霞,王沛,李晓明.糖化酶的研究进展及趋势[J].自然杂志,2003(3):161-163.
[7]陈启和,何国庆.糖化酶及其基因研究进展[J].微生物学杂志,2000(4):46-50.
[8]ACOURENE S , AMMOUCHE A . Optimization of ethanol, citric acid, and α-amylase production from date wastes by strains of Saccharomyces cerevisiae, Aspergillus niger, and Candida guilliermondii[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(5):759-766.
[9]郭彦言,王红蕾,左小明.糖化酵母糖化酶基因在酿酒酵母中的克隆与表达[J].安徽农业科学,2015,43(22):8-10.
[10]马丽娜陈,陈德富,王绘砖,等.曲霉属糖化酶基因的克隆及其在毕赤酵母中的表达[J].南开大学学报(自然科学版),2007(5):85-90.
[11]张淑娴.基于酿酒酵母原始株与乙醇适应株间的差异分析乙醇耐受性机制[D].北京:北京化工大学,2014.
[12]?AKAR Z, PETEK. Evolutionary engineering of multiple-stress resistant Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2014, 5(6-7):569-578.
[13]赵文萱.高產β-葡萄糖苷酶工程菌构建及对酿酒酵母WXY12发酵产乙醇的影响研究[D].长春:吉林农业大学,2019.
[14]刘建军,姜鲁燕,赵祥颖,等.高产酒精酵母菌种的选育[J].酿酒,2003(1):57-59.
[15]田沈,任普鲜,周桂雄,等.一株酵母菌高温驯化与同步糖化发酵研究[J].太阳能学报,2011(3):98-102.
[16]MARILLONNET S, GrüTZNER R. Synthetic DNA assembly using golden gate cloning and the hierarchical modular cloning pipeline [J]. Current Protocols in Molecular Biology, 2020, 130(1): 115.
[17]CHOCKALINGAM K, PENG Z. Golden gate assembly with a bi-directional promoter (GBid): A simple, scalable method for phage display Fab library creation [J]. Scientific Reports, 2020, 10(1): 1-14.
[18]FABER M S,VAN L J T, EDERER M M, et al. Saturation Mutagenesis Genome Engineering of Infective ΦX174 Bacteriophage via Unamplified Oligo Pools and Golden Gate Assembly[J]. ACS synthetic biology, 2020,9(1):125-131.
