miR-216b在体外培养细胞中加速长非编码RNA UCA1的降解
2017-06-09郑伟郭晓华董洁李少华丁红梅李慧黄皑雪夏伟白琛俊李达耿介李洁邵宁生
郑伟,郭晓华,董洁,李少华,丁红梅,李慧,黄皑雪,夏伟,白琛俊,李达,耿介,李洁,邵宁生
军事医学科学院 基础医学研究所,北京 100850
miR-216b在体外培养细胞中加速长非编码RNA UCA1的降解
郑伟,郭晓华,董洁,李少华,丁红梅,李慧,黄皑雪,夏伟,白琛俊,李达,耿介,李洁,邵宁生
军事医学科学院 基础医学研究所,北京 100850
目的:探讨长非编码RNA(lncRNA)UCA1作为miR216b的“分子海绵”结合miR-216b后的命运变化。方法:提取人HEK293T细胞基因组,以特异性引物PCR扩增UCA1基因并克隆至pcDNA6.0b载体,用氨苄西林抗性筛选阳性克隆,重组质粒pcDNA6-UCA1转染HEK293T和HeLa细胞并鉴定其表达水平。向HEK293T和HeLa细胞转染miR-216b类似物,同时用放线菌素D抑制细胞转录,收取3个时间点的细胞总RNA并鉴定其完整性,反转录获得cDNA后,采用实时荧光定量PCR技术检测各时间点UCA1的水平,测定其半衰期。pcDNA6-UCA1转染细胞24 h后,转染miR-216b类似物或miR-216b抑制剂,并使用放线菌素D抑制转录,收取3个时间点的细胞总RNA,qRTPCR检测UCA1半衰期。结果:构建的pcDNA6-UCA1过表达质粒转入HEK293T细胞后,qRT-PCR检测UCA1表达水平显著提高;miR-216b能够降低细胞内源或外源过表达的UCA1稳定性,加速UCA1的降解,显著缩短其半衰期;使用miR-216b的抑制剂,UCA1的半衰期延长。结论:miR-216b能够加速lncRNA-UCA1的降解,为研究miRNA与lncRNA的相互作用提供了新的思路。
UCA1;长非编码RNA;miR-216b;降解
microRNA(miRNA)是一类长度为22 nt左右的非编码小RNA,其可通过碱基互补配对的方式与 mRNA的3'端非翻译区(untranslated region,UTR)结合,导致mRNA的剪切降解或抑制mRNA的翻译,进而调控靶基因的表达[1-3]。miRNA参与细胞分裂增殖、分化和机体发育及物质代谢等多种极其重要的生物学过程[3]。迄今,已确定了超过3700个具有统计学意义的人成熟miRNA,并获得了3494个新的前体,而且新发现的miRNA数量还在不断上升,相信未来将会有更多的miRNA及其靶基因被鉴定出来[4]。
长非编码 RNA(long non-coding RNA,lncRNA)指的是长度大于200 nt,不编码蛋白质的一类非编码RNA[5]。近年来,随着研究的深入,人们发现lncRNA能够在表观遗传学、转录水平、转录后水平等多个层面对基因的表达进行调控,从而通过多种机制发挥其生物学功能。已有研究报道显示,lncRNA对细胞分化、迁移及增殖等过程的调控起到相当重要的作用[6]。自lncRNA被发现可以作为miRNA的“分子海绵”后,它与miRNA之间的关系逐渐引起了人们较大的研究兴趣。lncRNA能够通过与互补miRNA结合,抑制后者对miRNA靶基因的沉默效应,但lncRNA与互补miRNA结合后的自身命运变化鲜有报道。
有报道,作为一种肿瘤抑制miRNA,miR-216b在咽喉癌和肝细胞肝癌中能够起到抑癌作用。miR-216b能够通过调控K-ras基因的表达,抑制鼻咽癌、肝细胞肝癌细胞的增殖和侵袭,及细胞周期的阻滞[7-8]。
尿路上皮癌抗原1(urothelial carcinoma associated 1,UCA1)最早是由Wang等在膀胱癌细胞中鉴定的高表达的lncRNA,并命名为UCA1[9]。研究发现,UAC1在膀胱癌、宫颈癌、食管癌、结直肠癌、卵巢癌、黑色素瘤和胰腺癌等多种恶性肿瘤中均有异常高表达,而在正常组织中表达量低或不表达[10-15],表明UAC1有成为肿瘤标志物的可能性。此外,UCA1还被证明具有作为miR-216b的“分子海绵”的功能,通过与miR-216b结合,减弱miR-216b的功能,从而影响miR-216b的靶基因成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1),进而调控FGFR1所参与的ERK信号通路[8]。
lncRNA-UCA1能够通过与miR-216b结合,抑制miR-216b对靶基因的沉默效应,但UCA1结合miR-216b之后的自身命运变化尚无报道。我们通过构建UCA1的过表达质粒并转染细胞,并通过转染miR-216b mimic和miR-216b inhibitor,利用实时荧光定量PCR检测了UCA1的半衰期,为进一步研究UCA1与miR-216b相互作用的确切分子机制奠定了基础。
1 材料和方法
1.1 材料
HEK293T和HeLa细胞株、pcDNA6.0b载体由本室保存;DMEM培养基购自Gibco公司;TRIzol试剂购自Sigma公司;反转录酶购自Promega公司;dNTP、T4DNA连接酶、基因组提取试剂盒购自天根公司;RNA酶抑制剂、Phusion DNA扩增酶、限制性内切酶、切胶回收和质粒提取试剂盒购自Thermo公司;实时荧光定量检测试剂SYBR Green mix购自Toyobo公司;琼脂糖购自Lonza公司;Tris base和甘氨酸购自Novon公司;PCR引物、反转录引物和qPCR引物由上海生工公司合成;miR-216b mimic及对照、miR-216b inhibitor及对照由广州锐博公司合成。
1.2 pcDNA6-UCA1重组质粒的构建与测序
提取HEK293T细胞的基因组,以其为模板,用上游引物UCA1-F1(5'-CGGAATTCGATCTCTC CTCTTCCTCCTGGAAGC-3')和下游引物UCA1-R1(5'-CCGCTCGAGAGGAAGATTTCTTTTCTGTCACC T-3')扩增UCA1基因[6]。PCR扩增条件:预变性98℃ 30 s;变性98℃ 10 s,退火62℃ 30 s,延伸72℃ 1 min,35个循环;终延伸72℃ 5 min。PCR产物通过1%琼脂糖电泳后切胶回收,和载体pcDNA6.0b分别用EcoRⅠ和XhoⅠ双酶切,回收酶切产物,用T4DNA连接酶连接目的基因与载体,16℃连接过夜;连接产物转化大肠杆菌DH5α感受态细胞,培养过夜,挑选单克隆菌落接种于1 mL含50 mg/L氨苄西林的培养基,37℃培养6 h,菌液PCR鉴定克隆,将鉴定得到的阳性克隆送奥科鼎盛生物科技有限公司测序。
1.3 细胞转染
将HEK293T细胞接种于12孔板中,24 h后取1μg pcDNA6、pcDNA6-UCA1质粒稀释于100 μL无血清 DMEM中,分别与含 3μL LipofectAMINE 2000转染试剂的 100 μL无血清DMEM培养基混合,室温孵育20 min后加入相应的细胞培养孔中,培养5 h后更换含10%胎牛血清的培养基继续培养48 h。
将生长良好的HeLa细胞和HEK293T细胞接种于12孔板中,于37℃、5%CO2条件下培养24 h;按LipofectAMINE 2000说明书将50 pmol miR-216b mimic及对照分别稀释于100μL无血清DMEM培养基中,与含3μL LipofectAMINE 2000的100μL无血清DMEM培养基混合,室温孵育20 min后加入相应的细胞培养孔中,同时用终浓度为10μg/mL的放线菌素D抑制细胞转录,分别收取3个时间点的细胞总RNA待检测。
接种状态良好的HEK293T和HeLa细胞于12孔板中并培养24 h,将0.5μg pcDNA6-UCA1稀释于100μL无血清DMEM中,与含3μL LipofectAMINE 2000的100μL无血清DMEM培养基混匀,室温孵育20 min后加入相应的细胞培养孔中,培养5 h后更换含10%胎牛血清的培养基继续培养24 h,将50 pmol miR-216b mimic及对照或100 pmol miR-216b inhibitor及对照分别稀释于100μL无血清DMEM培养基中,与含3μL LipofectAMINE 2000的100μL无血清DMEM培养基混合,室温孵育20 min,将混合液加入相应的细胞培养孔中,同时用终浓度为10μg/mL的放线菌素D抑制细胞转录,收取细胞总RNA。
1.4 RNA提取及其完整性鉴定
按TRIzol试剂说明书提取细胞总RNA后稀释至1/50,在紫外分光光度计上检测RNA的浓度以及D260mm/280mm值。取1μg RNA,用1%琼脂糖电泳鉴定RNA的完整性。
1.5 细胞总RNA逆转录
取1μg细胞总RNA,加入1μL oligo(dT),用DEPC水补至13μL,混匀后70℃热变性5 min,立即置于冰上退火,加入7μL混合物(5×MMLV缓冲液4μL,dNTP 2μL,M-MLV逆转录酶0.5μL,RNase抑制剂0.5μL),42℃反应90 min,95℃灭活酶5 min,置于-20℃备用。
1.6 实时荧光定量PCR
用Stratagene公司的Mx3000P qPCR仪检测UCA1 mRNA水平。反应体系包括1μL cDNA、1μL特异引物(表1)、2×qPCR SYBR Green mix 10μL、ddH2O 8μL。反应条件:预变性95℃ 3 min,变性95℃ 15 s,退火56℃ 20 s,延伸72℃ 20 s,40个循环。采集熔解曲线,用Mx3000P软件分析结果。
2 结果
2.1 lncRNA-UCA1含有miR-216b结合位点
用生物信息学软件预测,结果显示lncRNAUCA1含有miR-216b的潜在结合位点(图1),同时结合相关文献报道,萤光素酶实验显示共转染miR-216b和UCA1萤光素酶载体后,萤光素酶活性出现显著抑制[8]。因此,UCA1能够与miR-216b结合。
2.2 UCA1基因的PCR扩增
以提取的HEK293T细胞基因组(图2)为模板,用Phusion酶PCR扩增35个循环得到目的片段,1%琼脂糖电泳分析表明,得到的扩增片段与预期1615 bp大小一致(图3),用切胶回收试剂盒对PCR产物进行纯化。
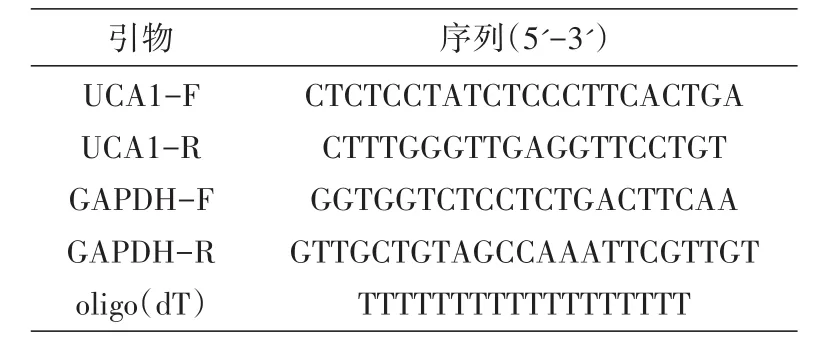
表1 实时荧光定量PCR所用引物序列

图1 生物信息学预测lncRNA-UCA1含有miR-216b结合位点
2.3 pcDNA6-UCA1表达载体的构建与鉴定
用EcoRⅠ和XhoⅠ分别对纯化后的扩增片段和pcDNA6.0b双酶切,将酶切片段与酶切质粒用T4DNA连接酶连接,连接产物转化大肠杆菌DH5α感受态细胞,37℃培养过夜,挑选单克隆,在含氨苄西林的LB培养基中培养6 h,以菌液为模版进行PCR扩增鉴定,电泳结果显示2、4、5号菌液与预期相符(图4)。将2、4、5号菌液送公司测序,序列与目的基因进行比对,结果无误,表明目的基因已正确插入pcDNA6.0b表达载体,提取质粒,载体可用于后续实验。

图2 HEK293T细胞基因组电泳鉴定
图3 UCA1 cDNA扩增产物电泳鉴定

图4 pcDNA6-UCA1克隆的PCR鉴定
2.4 HEK293T细胞转染pcDNA6-UCA1后UCA1水平显著升高
为了验证pcDNA6-UCA1在细胞中的表达水平,分别将构建的过表达质粒pcDNA6-UCA1和pcDNA6.0b空载体转染HEK293T细胞,48 h后收取细胞,提取细胞的总RNA,1%琼脂糖电泳检测显示细胞总RNA质量良好(图5)。反转录获得cDNA后进行实时荧光定量PCR检测,相对于对照组(转染pcDNA6.0b),转染过表达质粒pcDNA6-UCA1后,HEK293T细胞内UCA1 RNA水平显著升高(图6)。
2.5 miR-216b加速细胞内源lncRNA-UCA1的降解
在HEK293T和HeLa细胞中转染miR-216b mimic及对照,同时用放线菌素D抑制细胞转录,收取3个时间点(转染后0、4、8 h)的细胞总RNA,1%琼脂糖检测显示RNA完整性良好。反转录获得cDNA后,用实时荧光定量PCR检测转染对照组与miR-216b mimic组HEK293T细胞(图7)和HeLa细胞(图8)各时间点的UCA1水平。结果发现,在2种细胞中,相较于对照组,转染miR-216 mimic组UCA1的半衰期明显减短,UCA1的降解速率显著增加,UCA1与miR-216b竞争结合后,miR-216b能够与UCA1结合影响其稳定性,加速细胞内源lncRNA-UCA1分子的降解。

图5 转染过表达质粒细胞总RNA质量检测

图6 qPCR检测UCA1的表达
2.6 miR-216b加速外源过表达的lncRNA-UCA1的降解
将0.5μg pcDNA6-UCA1分别转染HEK293T和HeLa细胞,24 h后再转染50 pmol miR-216b mimic及对照,并用放线菌素D抑制转录,收取3个时间点的细胞总RNA,电泳检测总RNA质量。反转录得到cDNA,用实时荧光定量PCR检测HEK293T细胞(图9)和HeLa细胞(图10)中UCA1的半衰期。结果显示,与对照组相比,转染miR-216b mimic组的lncRNA-UCA1的半衰期缩短,lncRNA-UCA1的降解明显加快,miR-216b能够加速降解外源表达的UCA1。
2.7 miR-216 inhibitor抑制miR-216b对UCA1的加速降解作用

图7 qRT-PCR检测HEK293T细胞多个时间点UCA1水平

图8 qRT-PCR检测HeLa细胞多个时间点UCA1水平
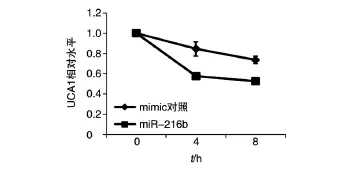
图9 qRT-PCR检测过表达UCA1并转染miR-216后HEK293T细胞的UCA1水平
在HEK293T和HeLa细胞中分别转染0.5μg pcDNA6-UCA1,24 h后转染100 pmol miR-216b inhibitor及对照,同时用放线菌素D抑制细胞转录,收取3个时间点的细胞总RNA,1%琼脂糖电泳检测RNA质量。反转录获得cDNA,实时荧光定量PCR检测HEK293T细胞(图11)和HeLa细胞(图12)的UCA1半衰期。结果显示,miR-216b inhibitor实验组lncRNA-UCA1的半衰期相比于对照组明显增长。
3 讨论

图10 qRT-PCR检测过表达UCA1并转染miR-216后HeLa细胞的UCA1水平

图11 qRT-PCR检测过表达UCA1并转染miR-216 inhibitor后HEK293T细胞的UCA1水平
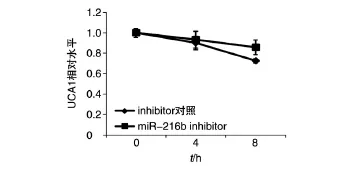
图12 qRT-PCR检测过表达UCA1并转染miR-216 inhibitor后HeLa细胞的UCA1水平
越来越多的研究表明,lncRNA和miRNA皆可广泛参与基因的转录后调控,它们能够参与细胞内几乎所有的生物学过程。随着研究的不断深入,miRNA对基因的调控及受其他分子调控的机制也越来越清楚,miRNA结合靶mRNA后能导致靶mRNA的剪切或翻译抑制,miRNA本身的产生与代谢也受多种水平的调控[3]。而lncRNA的功能则较为复杂多变,可作为信号分子、诱饵分子、导向分子及分子支架。miRNA的“分子海绵”的功能就是其作为诱饵分子的一种体现形式,而正是这种功能将lncRNA和miRNA这2种对细胞的各项生物学活动有重要影响的分子紧密联系到了一起。
miRNA靶向mRNA后,根据是否完全互补匹配引起靶mRNA的剪切,进而加速靶mRNA的降解或对靶mRNA翻译进行抑制,而lncRNA与mRNA的结构非常类似,其内也含有miRNA的结合位点,所以lncRNA作为miRNA的“分子海绵”,其在竞争结合miRNA后,理论上也会受miRNA的调控,即lncRNA与miRNA应存在相互调控关系。我们的实验证实,含有miR-216b结合位点的lncRNA-UCA1结合miR-216b后,自身半衰期显著缩短,说明miR-216b加速了UCA1分子的降解,而miR-216b的抑制剂能够延长UCA1分子的半衰期,加强其稳定性。但是,导致UCA1加速降解的确切分子机制还须探讨。本研究为了解lncRNA的“分子海绵”功能提供了新的线索,同时也加深了我们对lncRNA-miRNA-mRNA之间相互调控网络的理解。
[1]Lagos-Quintana M,Rauhut R,Lendeckel W,et al. Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[2]Lytle J R,Yario T A,Steitz J A.Target mRNAs are repressed as efficiently by microRNA-binding sites in the 5'UTR as in the 3'UTR[J].Proc Natl Acad Sci USA,2007,104(23):9667-9672.
[3]Bartel D P.microRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[4]Londin E,Loher P,Telonis A G,et al.Analysis of 13 cell types reveals evidence for the expression of numerous novel primate-and tissue-specific microRNAs [J].Proc Natl Acad Sci USA,2015,112(10):E1106-E1115.
[5]Spizzo R,Almeida M I,Colombatti A,et al.Long non-coding RNAs and cancer:a new frontier of translational research[J]?Oncogene,2012,31(43):4577-4587.
[6]Wang X,Li M,Wang Z,et al.Silencing of long noncoding RNA MALAT1 by miR-101 and miR-217 inhibits proliferation,migration,and invasion of esophageal squamous cell carcinoma cells[J].J Biol Chem, 2015,290(7):3925-3935.
[7]Deng M,Tang H,Zhou Y,et al.miR-216b suppresses tumor growth and invasion by targeting KRAS in nasopharyngeal carcinoma[J].J Cell Sci,2011,124(17): 2997-3005.
[8]Wang F,Ying H Q,He B S,et al.Upregulated lncRNA-UCA1 contributes to progression of hepatocellular carcinoma through inhibition of miR-216b and activation of FGFR1/ERK signaling pathway[J].Oncotarget,2015,6(10):7899.
[9]Wang X S,Zhang Z,Wang H C,et al.Rapid identification of UCA1 as a very sensitive and specific unique marker for human bladder carcinoma[J].Clin Cancer Res,2006,12(16):4851-4858.
[10]Rafiee P,Shi Y,Su J,et al.Erythropoietin protects the infant heart against ischemia-reperfusion injury by triggering multiple signaling pathways[J].Basic Res Cardiol,2005,100(3):187-197.
[11]张争,郝瀚,张崔建,等.新基因UCA1用于膀胱癌诊断的临床应用价值[J].中华医学杂志,2012,92(6):384-387.
[12]Wang F,Li X,Xie X J,et al.UCA1,a non-proteincoding RNA up-regulated in bladder carcinoma and embryo,influencing cell growth and promoting invasion [J].FEBS Lett,2008,582(13):1919-1927.
[13]Wu W,Zhang S,Li X,et al.Ets-2 regulates cell apoptosis via the Akt pathway,through the regulation of urothelial cancer associated 1,a long non-coding RNA,in bladder cancer cells[J].PLoS One,2013,8(9): e73920.
[14]Li Z,Li X,Wu S,et al.Long non-coding RNA UCA1 promotes glycolysis by upregulating hexokinase 2 through the mTOR-STAT3/microRNA143 pathway [J].Cancer Sci,2014,105(8):951-955.
[15]Xue M,Li X,Li Z,et al.Urothelial carcinoma associated 1 is a hypoxia-inducible factor-1α-targeted long noncoding RNA that enhances hypoxic bladder cancer cell proliferation,migration,and invasion[J].Tumor Biol,2014,35(7):6901-6912.
m iR-216b Accelerated Decay of lncRNA-UCA1 in Cultured Cells
ZHENG Wei,GUO Xiao-Hua,DONG Jie,LI Shao-Hua,DING Hong-Mei,LI Hui, HUANG Ai-Xue,XIA Wei,BAI Chen-Jun,LI Da,GENG Jie,LI Jie*,SHAO Ning-Sheng*
Beijing Institute of Basic Medical Science,Beijing 100850,China
Objective:To explore the effects of miR-216b on lncRNA-UCA1 after miR-216b binding with UCA1.Methods:Genome was extracted from HEK293T cell,and from which UCA1-coding sequence was amplified by PCR with specific primers,then the gene fragment was cloned into pcDNA 6.0b vector.Cells were transfected with miR-216b mimic and treated with actinomycin D,then total RNA were extracted at three time points and qRT-PCR was performed to detect the half-life of UCA1.The recombinant pcDNA6-UCA1 was transfected into cells for 24 h,then we transfected miR-216b mimic or miR-216b inhibitor into cells and treated cells with actinomycin D,three time points total cell RNA was harvested,and UCA 1 half-life was detected by qRT-PCR.Results:UCA1 RNA level was remarkably increased after transfection of pcDNA6-UCA1.Overexpression of miR-216b significantly reduced the half-life of both endogenous and exogenous UCA 1 compared to the control group. miR-216b inhibitor could prolong UCA1 half-life and enhance UCA1 RNA stability.Conclusion:miR-216b could accelerate decay of UCA1 which provided a new thought for interaction between miRNA with lncRNA.
UCA1;long non-coding RNA;miR-216b;decay
Q78
A
1009-0002(2017)03-0227-06
10.3969/j.issn.1009-0002.2017.03.001
2017-01-18
国家自然科学基金(31370794,31570817,31200566)
郑伟(1990-),男,硕士研究生,(E-mail)jaycheng0920@foxmail.com
邵宁生,(E-mail)shaonsh@hotmail.com;李洁,(E-mail)jannbio@163.com
*Co-corresponding authors,SHAO Ning-Sheng,E-mail:shaonsh@hotmail.com;LI Jie,E-mail:jannbio@163.com
