槌果藤对体外诱导Th17细胞增殖及RORγt转录水平的影响
2017-06-08王姗姗梁沛君应旭旻
王姗姗 梁沛君 应旭旻
槌果藤对体外诱导Th17细胞增殖及RORγt转录水平的影响
王姗姗1梁沛君2应旭旻3
目的观察槌果藤对体外诱导的TH17细胞增殖和分化的影响。方法将不同浓度的槌果藤乙醇提取物与Th17细胞共同培养,应用流式细胞术(FCW)检测空白对照组及槌果藤低、中、高剂量组(1、10、20μg/mL)TH17细胞分化水平;进而以10μg/mL浓度为基础药物浓度,采用聚合酶链式反应(PCR)检测槌果藤对维甲酸相关孤儿受体γ(RORγt)转录水平表达的影响。结果FCW检测结果显示,培养3天后,与空白对照组比较,槌果藤中、高剂量组Th17细胞分化比例明显降低[(4.83±0.13)%、(4.99±0.38)%比(8.24±0.34)%,P<0.05];低剂量组与对照组、中剂量与高剂量组Th17细胞分化比例比较差异无统计学意义(P>0.05)。PCR检测结果显示,单纯槌果藤组(10μg/mL)与对照组相比,RORγt转录表达水平明显降低[(0.66±0.25)比1,P<0.05];单纯槌果藤组与ERK抑制剂组相比,RORγt转录表达水平明显降低[(0.66±0.25)比(1.46±0.47),P<0.05)]。P38抑制剂组、JNK抑制剂组与单纯槌果藤组相比,RORγt转录表达水平无显著差异(P>0.05)。结论槌果藤可抑制体外诱导Th17细胞的增殖、分化,其作用机制可能是通过ERK信号通路从而抑制RORγt转录。
槌果藤;Th17;RORγt;增殖;分化
T辅助细胞17(T helper 17 cell,Th17)是新近发现的一种由转化生长因子-β(TGF-β)和白介素-6(IL-6)联合诱导产生的能分泌IL-17A、IL-17F、IL-22等细胞因子的CD4+T细胞,它与调节性T细胞共同参与自身免疫疾病的过程,研究发现,自身免疫疾病的Th17细胞明显升高,而其数量的升高与自身免疫病呈密切相关[1-2],系统性红斑狼疮(systemic lupuserythematosus,SLE)患者外周血Th17细胞数量的升高与疾病活动度明显相关[3]。既往研究[4]表明,槌果藤对局灶节段肾小球硬化(FSGS)小鼠模型可减少尿蛋白,起到免疫调节、抗氧化、抗纤维化作用,但其作用机制有待进一步研究。本实验旨在研究槌果藤提取物对Th17细胞的增殖、分化的影响,并对其可能存在的作用机制进行初步探讨,为槌果藤治疗自身免疫疾病提供更多的理论依据。
1 实验材料
1.1 实验动物正常C57BL/6小鼠6只,鼠龄6~8周,购自上海斯莱克实验动物中心,浙江中医药大学动物中心SPF级别饲养。实验动物生产许可证:SCXK(沪)2012-0005。
1.2 药品槌果藤来自浙江中医药大学门诊部中药房,称取槌果藤干果切成小片,加95%乙醇于70℃水浴中加热回流1h,重复2次,将2次煎煮液合并;于旋转蒸发仪上进行真空浓缩至固态,用二甲基亚矾(DMSO)溶解成1mg/mL,过滤器过滤灭菌,-20℃保存备用。使用时稀释成药物浓度为低(1μg/mL)、中(10μg/mL)、高(20μg/mL)剂量组,0μg/mL为空白对照组。
1.3 试剂和仪器转化生长因子β(TGF-β)(美国R&D公司,NUQ1814072);IL-6(美国R&D公司,NUQ1836152);CD4+Tcell检测盒(德国Miltenyi Biotec公司,批号:5140602356);PMA(中国联科,批号:5155205),BFA(中国联科,批号:5155305);IL-17检测试剂盒(美国eBioscience公司,E00081-1635);trizol(日本Takara公司,v201204Da-2);PCR引物(美国invitrogen公司,2949652)。CO2培养箱(HF151)(上海力中科学仪器有限公司);流式细胞仪(Beckman Coulter公司);旋涡式混合器(太仓华利达实验设备有限公司);PCR仪(美国ABI7500 Real-Time)。
2 方法
2.1 流式细胞术(FCW)检测IL-17表达无菌条件下分离小鼠脾脏,研磨后由淋巴细胞分离液获取脾脏T细胞。向T细胞中加入CD4+Tcell Biotin-Antibody cocktail(100μL/108)、Anti-biotin MicroBeads(100μL/108)抗体孵育,洗去抗体过LS分选柱,收集流出的细胞即CD4+T细胞,加入anti-CD62L-beads(200μL/108)再经MS分选柱分选得CD4+CD25-CD62L+细胞。在TGF-β和IL-6的联合诱导Th17细胞过程中,加入不同浓度的槌果藤乙醇提取液,用流式细胞仪检测IL-17表达。
将待检CD4+CD25-CD62L+细胞接种12空板,分为五组,同型对照组(仅对空白对照组及药物组数据矫正)、空白对照组,槌果藤低、中、高剂量组(药物组),每组各一个副孔,调整细胞浓度为1×106/mL。除空白对照组外,四组均加入TGF-β(1ng/mL)和IL-6 (20ng/mL),药物组加入相应浓度槌果藤乙醇提取液,于5%CO2培养箱中培养3天。(1)各组分别取250μL细胞悬液于流式管中,然后加入1μL PMA(250X),1μL BFA(250X),混匀,于37℃、5%CO2培养箱培养刺激5h,每2h混匀1次,刺激Th17细胞的分泌。(2)分别加入表面抗体FITC anti-mouse CD4 0.25μL(0.125μg/test)4℃避光孵育15min。(3)用预冷流式染色缓冲液洗涤细胞,离心弃上清。(4)重悬细胞,加入1mL Fixation/Permeabilization固定破膜液,4℃避光孵育30min。(5)洗涤细胞,离心弃上清,重复洗2遍。(6)空白对照组及药物组加入Anti-Mouse/Rat IL-17A PE 0.2mg/mL和同型对照管加入同等剂量同型对照,37℃温箱孵育1h。(7)2mL Per Buffer洗涤,1500rpm离心,5min,弃上清,重复2次,加入500μL PBS上机检测IL-17在CD4+Tcell中所占的百分比。
2.2 PCR检测RORγt表达将待检Th17细胞分为五组,每组均给予TGF-β+IL-6联合诱导,其中一组为空白对照组。其余四组分别加入10μg/mL的槌果藤,其中三组分别加入P38抑制剂、JNK抑制剂、ERK抑制剂。每组均加入TGF-β+IL-6联合培养3天,用PCR方法检测RORγt表达。
将待检TH17细胞接种于6孔板,调整细胞浓度为2.5×105/L,抑制剂组先分别加入P38抑制剂(2μM/μL)、JNK抑制剂(50μM/μL)、ERK抑制剂(50μM/2.67μL)于37℃、5%CO2培养箱内培养30min后,五组均加入TGF-β和IL-6,除空白对照组外其余四组再分别加入10μg/mL槌果藤乙醇提取物,联合培养3天,3天后每组均加入PMA、BFA,刺激5h后,离心弃培养基,加入1mL trizol,提取RNA。逆转录:cDNA,上机(37℃180min,85℃5sec,4℃)测RORγt DNA浓度,选用浓度在1.8-2.0之间的DNA浓度。进行扩增Real-time PCR:引物RORγt-F 5'-3':CAGA ACAGGGTCCAGACAGC RORγt-R 5'-3':CCGTGAA AAGAGGTTGGTGCGA-PDH-F 5'-3':TGACGTGCCG CCTGGAGAAA GAPDH-R 5'-3':AGTGTAGCCCAA GATGCCCTTCAG(50℃,2min;95℃,10s;60℃,30s;72℃,30s,40循环),每个样本重复3次,7500 Real-Time PCR上机检测RORγt表达,扩增比例用Ct值(每个反应管内的荧光信号到达设定的阈值时所经历的循环数)显示,结果以GAPDH进行矫正,并以2-ΔΔCt值,即每组基因表达量相对于对照组的倍数,表示每组RORγt相对表达量。
2.3 统计学方法应用SPSS软件15.0软件进行统计分析,数据采用() ,两两比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 FCW检测Th17细胞分化槌果藤中、高剂量组与空白对照组比较,Th17细胞分化比例明显降低,差异有统计学意义(P<0.05);槌果藤低剂量组与对照组间、中剂量与高剂量组间Th17细胞分化水平差异无统计学意义(P>0.05)。见表1。
表1 不同浓度槌果藤对Th17细胞分化比例的影响()
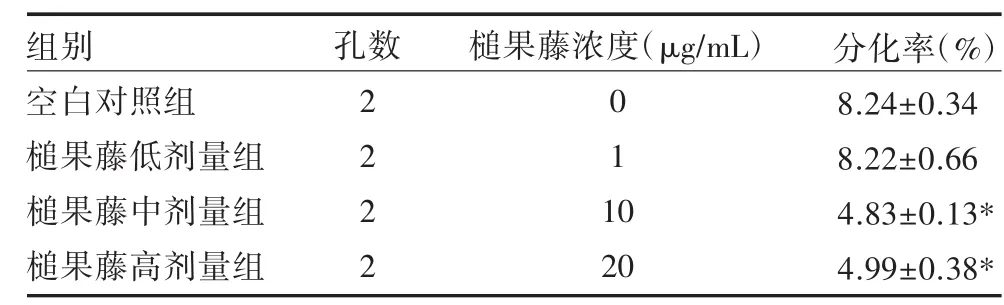
表1 不同浓度槌果藤对Th17细胞分化比例的影响()
注:与空白对照组比较,*P<0.05
组别空白对照组槌果藤低剂量组槌果藤中剂量组槌果藤高剂量组孔数槌果藤浓度(μg/mL)2 2 2 2 0 1 1 0 20分化率(%)8.24±0.34 8.22±0.66 4.83±0.13* 4.99±0.38*
3.2 PCR检测RORγt转录表达水平与对照组比较,单纯槌果藤组RORγt转录表达水平明显降低(P<0.05);不同信号通路阻断剂组中,ERK阻断剂组RORγt转录表达水平明显高于单纯槌果藤组和空白对照组(P<0.05),P38阻断剂组、JNK阻断剂组与单纯槌果藤比较,差异无统计学意义(P>0.05)。见表2。
表2 槌果藤对RORγt转录水平的影响()
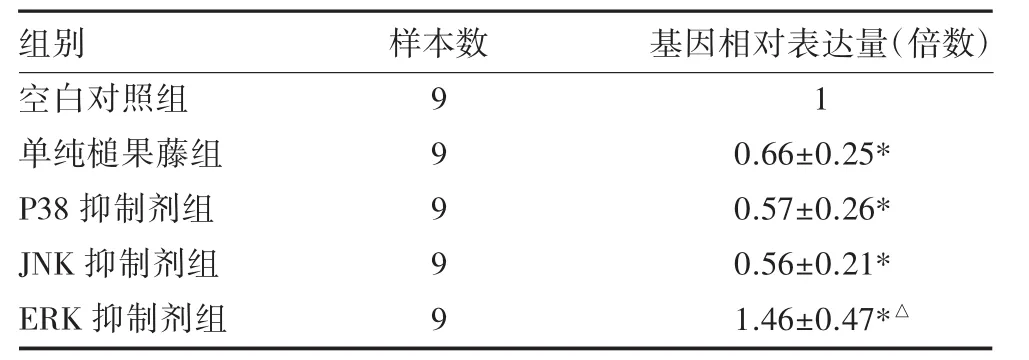
表2 槌果藤对RORγt转录水平的影响()
注:与对照组比较,*P<0.05;与单纯槌果藤组比较,△P<0.05
组别空白对照组单纯槌果藤组P38抑制剂组JNK抑制剂组ERK抑制剂组样本数9 9 9 9 9基因相对表达量(倍数)1 0.66±0.25* 0.57±0.26* 0.56±0.21* 1.46±0.47*△
4 讨论
Th17细胞已被证实在调节免疫与自身免疫性疾病中发挥重要作用,大量研究发现,Th17细胞与实验性脑炎、哮喘、RA等自身免疫性疾病相关。本研究通过乙醇提取法提取槌果藤中药用成分,分为低、中、高剂量组,采用FCW检测Th17在CD4+Tcell分化所占比值。CD4+Tcell在TGF-β+IL-6联合诱导3天,FCW检测对照组Th17水平增加,表明联合诱导Th17细胞过程成功,其中槌果藤低、中、高剂量相比,以中剂量抑制作用最为明显。PCR检测以抑制作用最为明显的抑制浓度中剂量为基础浓度,加入阻断剂,以空白组为对照组,结果显示,槌果藤可抑制RORγt转录表达水平从而抑制Th17细胞的分化,ERK阻断剂组RORγt转录表达水平增高,表明槌果藤可能通过ERK通路影响Th17细胞的分化。
研究[2]表明,Th17细胞是促炎症细胞,由TGF-β和IL-6联合诱导产生,导致组织的炎症反应和自身免疫病发生,在分化过程中,维甲酸受体相关孤儿受体γ(RORγt)控制Th17的分化。近年来MAPK信号通路在TGF-β介导的Th17细胞分化中作用越来越受到重视,MAPK信号通路包括ERK1/2,JNK和P38。在Th17细胞分化中,Tan等[5]发现运用药物抑制ERK信号明显增加Th17细胞的分化和增加IL-17、IL-21、IL-22和IL-23R的表达,Cui等[6]也报道活化ERK信号通路能抑制Th17细胞分化,同时Brereton等[7]报道ERK特异性信号通路抑制剂明显减轻自身免疫病的症状,与降低IL-23和IL-1诱导的IL-17产生有关。以上说明MAPK通路在T细胞分化中占重要地位。本研究将槌果藤提取物与Th17细胞共同培养3天,利用PCR技术检测RORγt受体的表达(P<0.05),发现单纯槌果藤组可明显抑制RORγt受体的表达,进一步通过不同信号通路阻断剂的干预实验发现,ERK阻断剂组与槌果藤提取物共同培养后RORγt的表达明显增高(P<0.05),而JNK和P38阻断剂组与棰果藤提取物共同培养后,对RORγt的表达无影响(P>0.05)。推测槌果藤可能通过MAPK信号通路的ERK信号通路,影响Th17细胞的分化。
槌果藤作为传统中草药,具有临床副作用小、价格低廉、应用广泛的特点,具有祛风、散寒、除湿、消肿、止痛之效,用于风湿性关节炎、肝硬化和肝炎等引起的脾胃病证和浮肿[8]。我们前期研究发现,槌果藤可以减少局灶阶段硬化肾小球鼠尿蛋白,但其作用机制尚不明确。本研究证实了中高剂量槌果藤对体外诱导Th17细胞增殖与分化具有明显抑制作用,并推测其可能通过MAPK信号通路的ERK信号通路影响RORγt的表达。槌果藤其他的免疫抑制作用及机制还有待进一步深入研究。
[1]Iwakura Y,NakasS,Saijo S.Theroles of IL-17A in inflammatory immune responses and host defense against pathogens[J].Immunol,Rev,2008,226(1):57-79.
[2]Korn T,Bettelli E,Oukka M,et al.IL-17 and Th17 cells[J].Annu Rev Immunol,2009,27(1):485-517.
[3]Zheng SG,Dray JD,Ohtsuka K,et al.Generation ex-vivo of TGF-beta producing regulatory T-cells from CD4+CD25-precursors[J].Immunol,2002,169(8):4183-4189.
[4]应旭旻,胡日红,王军,等.槌果藤对局灶阶段肾小球硬化鼠模型的治疗作用及作用机制的初步探讨[J].中国中西医结合肾病杂志,2008,9(8):675-679.
[5]Tan AH,Lam KP.Pharmacologic inhibition of MEK-ERK signaling enhances Th17 differentiation[J].Immunol,2010, 184(4):1849-1857
[6]Cui G,Qin X,Zhang Y,et al.Berberine differentially modulates the activities of ERK,p38 MAPK,and JNK to suppress Th17 and Th1 T cell differentiation in type 1 diabetic mice[J].Biol Chem,2009,284(41):28420-28429.
[7]Brereton CF,Sutton CE,Lalor SJ,et al.Inhibition of ERKMAPK suppresses IL-23-and IL-1-driven IL-17 production and attenuates autoimmune disease[J].Immunol,2009,183(3):1715-1723.
[8]Zhang G,Liu Y,Guo H,et al.Triptolide promotes generation of Foxp3+T regulatory cells in rats[J].Journal of Ethnopharmacology,2009,125(1):41-46.
(收稿:2016-11-21修回:2017-02-23)
Capparis Spinosa L.Inhibit the Proliferation of Th17 Cells and Transcription of RORγtin Vitro
WANG Shanshan1,LIANG Peijun2,YING Xumin3
1 The Second Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou(310053),China;2 The First Clinical Medical College,Zhejiang Chinese Medical University, Hangzhou(310053),China;3 Hangzhou Red Cross Hospital(the author is now working in Hangzhou Emergency Center),Hangzhou(310021),China
ObjectiveTo investigate the effect of Capparis spinosa L.On the proliferation and differentiation of Th17 cells in vitro.MethodsThe Th17 cells were cultrivated with different concentration of Cappris spinosa L.(1,10,and 20μg/mL),then the cells were detected with Flow cytometry.In the second part of the experiment, the Th17 cells was cocultured with 10 μg/mL Capparis spinosa L.for the detection of RORγt by PCR.ResultsAfter 3-d coculture,the differentiation of Th17 cells in 10 and 20 μg/mL Capparis spinosa L.groups was significantly decreased compared to control group(4.83%±0.13%,4.99%±0.38%vs 8.24%±0.34%,P<0.05);no significant difference in Th17 differentiation was found between 1 Capparis spinosa L.group and control and between 10 and 20μg/mL Capparis spinosa L.groups,respectively(P>0.05).The transcription of RORγt in 10 μg/mL Capparis spinosa L.group(0.66±0.25)was lower than that in control group(1,P<0.05)and that in ERK inhibitor group(1.46±0.47,P<0.05);but no significant difference was noted among P38 inhibitor group,JNK inhibitor group,and Capparis spinosa L.Group(P>0.05).ConclusionCapparis spinosa L.can inhibit the proliferation and differentiation of Th17 cells through inhibiting the transcription of RORγt by ERK signaling pathway.
Capparis spinosa L.;Th17;RORγt;proliferation;differentiation
浙江省中医药科技计划项目(No.2011ZA080);浙江省医药卫生科技计划项目(No.2011KYA137)
1浙江中医药大学第二临床医学院(杭州310053);2浙江中医药大学第一临床医学院(杭州310053);3杭州市红十字会医院(现在杭州市急救中心工作)(杭州310021)
应旭旻,Tel:0571-56109531;E-mail:xmyin@163.com
