结缔组织病合并马尔尼菲青霉菌病1例并文献复习
2017-06-06黄慕芳于奕奕
黄慕芳,杨 敏,于奕奕
(南方医科大学南方医院 风湿免疫科,广东 广州 510515)
·病例报告·
结缔组织病合并马尔尼菲青霉菌病1例并文献复习
黄慕芳,杨 敏,于奕奕
(南方医科大学南方医院 风湿免疫科,广东 广州 510515)
结缔组织疾病;马尔尼菲青霉菌;干燥综合征
马尔尼菲青霉菌(PM)是迄今所发现的极少数能使人体致病的青霉菌之一,也是青霉菌属中唯一的温度依赖型双相菌,主要感染免疫缺陷人群,可引起局限性或进行播散性发病,即马尔尼菲青霉菌病(PSM)[1]。这种机会真菌感染通常发生在人类免疫缺陷病毒(HIV)感染患者中。迄今为止,较少的病例报道了PM感染发生在结缔组织病患者中。现就我院1例皮肌炎合并PSM报告如下。
1 临床资料
患者,男,45岁,无业人员,江西赣州市人。因“近端肢体乏力3个月,反复发热2个月,咳嗽1个月,加重2天”于2016年9月8日第2次就诊我院。患者3个月前出现四肢近端无力,伴肌肉酸痛、关节痛,伴颜面部、颈前区红色皮疹,于当地医院就诊,查肌酸激酶341U/L、乳酸脱氢酶433U/L、丙氨酸转氨酶351U/L、天冬氨酸转氨酶113U/L,肌电图未见明显异常,当地医院诊断为皮肌炎,予激素治疗后症状好转。2个月前患者出现发热,于当地医院予激素治疗后体温可降至正常。1个月前开始出现咳嗽、咳痰伴气促,伴低热,于2016年8月18日第1次就诊我院,查肌酸激酶141U/L、乳酸脱氢酶485U/L、天冬氨酸转氨酶262U/L、丙氨酸转氨酶167U/L,自身抗体14项均阴性,肌电图示:①左股内肌、肱二头肌未见纤颤电位、正锐波,运动单位电位时限正常;②左腓总神经CMAP波幅稍降低。胸部CT示:双肺多发片状异常密度增高,考虑间质性肺炎,全身PET-CT示:双上臂肌肉、双侧冈下肌、双侧肩胛下肌、左侧腹直肌、臀部及盆腔部分肌肉内可见多发局限性高代谢病灶,相应部位肌肉密度降低,考虑为多发性肌炎,根据症状及检查结果,我院诊断:皮肌炎、间质性肺炎,此次住院期间予甲泼尼龙琥珀酸钠20mg/d,静脉滴注治疗,后症状好转出院。出院后规律口服甲泼尼龙(12mg,1/早)治疗。2天前患者咳嗽、咳痰加重,伴气促、低热,伴饮水呛咳,为进一步治疗再次入院。既往无冶游史、吸毒史。入院体格检查:体温37.2 ℃,脉搏142次/min,呼吸18次/min,血压98/70mmHg(1mmHg=0.133kPa)。颜面部、眶周、 颈前区、背部、双肘关节及踝关节伸侧红色皮疹,无瘙痒,无破溃。全身浅表淋巴结无肿大。心肺听诊未见明显异常。四肢活动自如,关节未见异常,双下肢无浮肿。四肢近端肌力3-级,抬臂、蹲起无力,远端肌力5级,四肢肌张力正常。血常规示:白细胞10.92×109/L,中性粒细胞0.739,血红蛋白107g/L,血小板240×109/L;C反应蛋白12.0mg/L;血生化:肌酸激酶67U/L,乳酸脱氢酶480U/L,α-羟丁酸脱氢酶223U/L,丙氨酸转氨酶155U/L,天冬氨酸转氨酶169U/L,白蛋白15.4g/L。肾功能、体液免疫(包括免疫球蛋白A、免疫球蛋白M、免疫球蛋白G、补体C3、补体C4)、自身抗体未见明显异常。HIV抗体阴性。胸部CT示:①双肺间质性肺炎;②双侧腋窝及纵膈多发肿大淋巴结,双侧胸膜增厚;③心包少量积液;④脾大。初步诊断:①皮肌炎;②间质性肺炎。入院后予口服甲泼尼龙(12mg,1次/早)治疗,人免疫球蛋白静脉滴注,头孢美唑钠抗感染,辅以止咳、祛痰、补钙、护胃、补充白蛋白等对症治疗,患者症状无好转。9月18日患者出现高热,体温最高39.8 ℃,调整抗生素为帕尼培南联合左氧氟沙星,体温仍无下降。血标本培养出PM。诊断考虑:①播散型PSM;②皮肌炎;③间质性肺炎。予两性霉素B0.6mg/(kg·d)静脉滴注联合口服泊沙康唑(5ml,3次/d)抗真菌治疗,甲泼尼龙调整为8mg, 1次/早,后泊沙康唑调整为伊曲康唑(200mg,2次/d)治疗。经上述治疗后患者体温逐渐恢复正常,咳嗽、咳痰、气促好转,复查血象、肝功能、心肌酶谱明显好转,多次抽血培养未培养出阳性病原菌,症状好转出院。出院后当地医院继续予两性霉素B(总用量1.5g)、伊曲康唑(共8周)治疗。
2 文献检索
在PubMed、CNKI、万方数据库检索。关键词 :马尔尼菲青霉菌、马尔尼菲青霉菌病、Penicillium、marneffei、penicilliosis,剔除非相关文献、临床资料不全、研究对象为儿童及可能重复者,共选入成人结缔组织病合并PSM19例,包括系统性红斑狼疮、混合型结缔组织病、干燥综合征、类风湿关节、多发性肌炎/皮肌炎。选入的病例包括不确定HIV感染。加入本文病例共20例,男5例,女15例,平均发病年龄36.10岁,中位年龄32岁。除了1例到过泰国旅行的日本患者外,其他病例均来自中国、东南亚国家,一般资料见表1。20例结缔组织病合并PM感染的患者临床特点,包括发热、乏力、皮肤或软组织病变、咳嗽、淋巴结增大、腹痛或腹泻、关节炎、呼吸困难、肝脾肿大、骨髓炎(发生率由高到低),其中全部患者均有发热。不常见的症状包括神经系统症状,例如颅内损害导致的惊厥、神经失常等,见表2。剔除缺乏详细实验室检查结果的4例,结果表明结缔组织病合并PM感染患者可能会出现贫血,白细胞数异常(包括白细胞增多、白细胞减少),中性粒细胞数异常(包括中性粒细胞增多、中性粒细胞减少),淋巴细胞减少,血小板减少,其中可能更容易出现贫血、白细胞较少、中心粒细胞减少、血小板减少。实验室检查特点见表3。
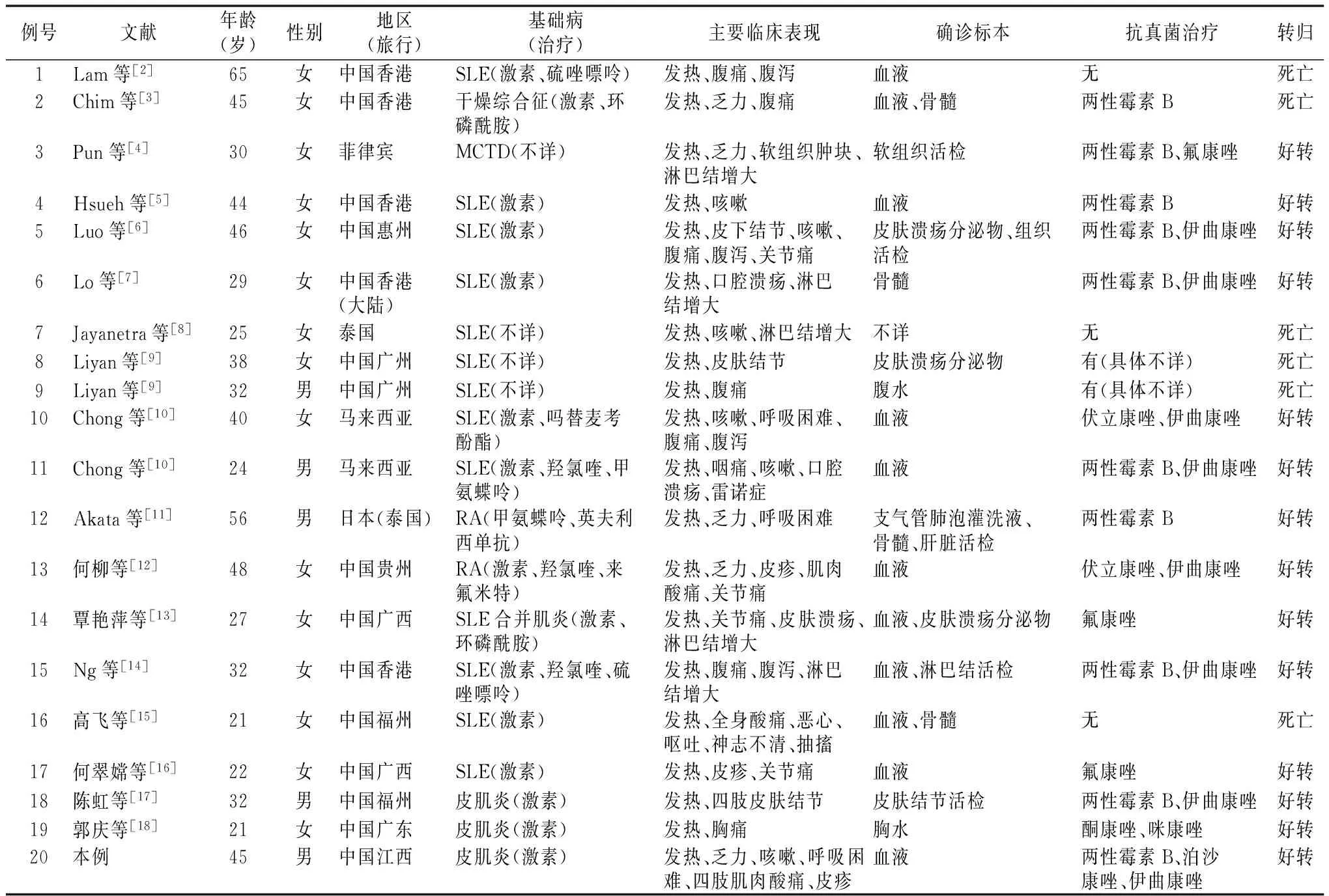
表1 结缔组织病合并PSM患者一般资料
注:CTD:结缔组织病;SLE:系统性红斑狼疮;MCTD:混合型结缔组织病;RA:类风湿关节炎
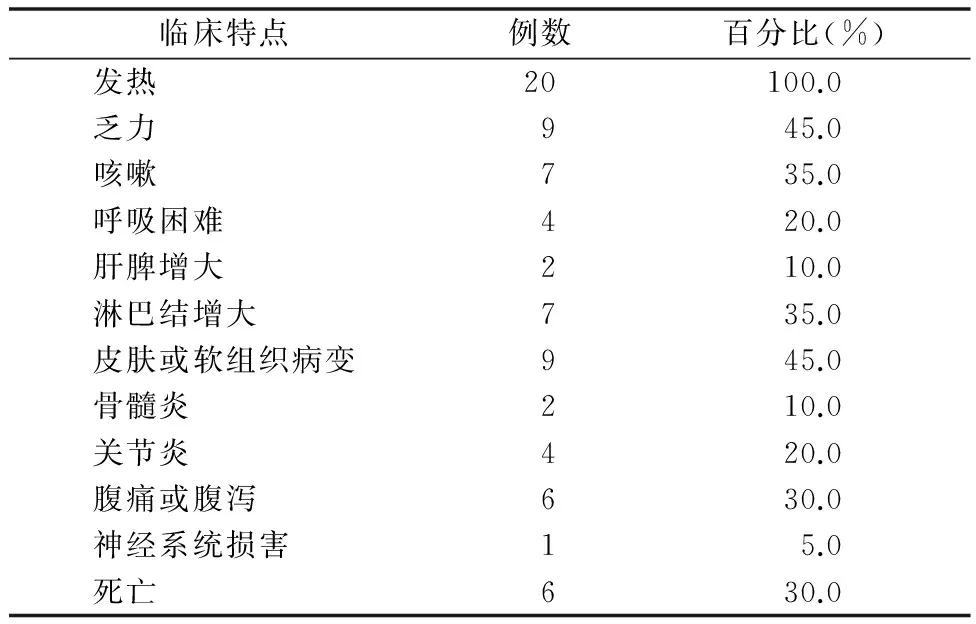
表2 20例结缔组织病合并PSM患者的临床特点

表3 16例结缔组织病合并PSM患者实验室检查
3 讨 论
PSM是由一种罕见的致病性双相青霉菌所致。1956年由Capponi等[19]首先从越南中华竹鼠的肝脏中分离出PM,并在鼠类证实其致病性。PSM是一个地方性疾病,特别是泰国、越南、中国华南地区、香港、台湾、老挝、马来西亚、缅甸、柬埔寨等国家地区[20]。过去认为,PM感染是专门由HIV感染引起的[8]。自90年代以来,越来越多PM感染在细胞免疫受损的非HIV感染患者中被报道出来,主要包括成人发病型免疫缺陷,其他继发性免疫抑制状态,如结缔组织病,器官和造血干细胞移植后,接受免疫抑制药物或抗CD20单克隆抗体等靶向治疗[21-22]。
目前PM感染的作用机制尚不完全明确。很多假说认为CD4+T细胞介导细胞免疫在艾滋病患者的发病过程中起到重要作用[23],同样可能存在于结缔组织病等导致免疫异常的非艾滋病患者中。PM进入宿主体内后在巨噬细胞中增殖,并通过网状内皮系统播散。在健康宿主,PM可以在2~3周内被清除掉,而在裸鼠或T细胞缺乏的小鼠,PM感染是致命的。这些结果说明T细胞,特别是CD4+细胞对于清除PM感染至关重要。一项通过对BALB小鼠进行体外实验发现,保护性免疫由CD4+亚群细胞(Th)1途径应答,极化的Th1通过L-精氨酸依赖的一氧化氮通路激活巨噬细胞,表现出高水平的白细胞介素(IL)-1,IL-2、干扰素(IFN)-7和肿瘤坏死因子(TNF)-α[24],阻止了PM的免疫逃避。人类中性粒细胞对PM的酵母形态有杀伤作用。有结缔组织病等基础疾病的患者,可能存在中性粒细胞减少或功能缺陷,易感PM[25]。有研究认为B细胞功能障碍可能导致中和PM重要毒素的抗体减少,并且随着B细胞细胞因子分泌的减少,而影响T辅助细胞的功能。结缔组织病患者PM的易感性除了跟基础疾病相关,也跟治疗有关[21]。结缔组织病患者,经常使用糖皮质激素及免疫制剂治疗,这些免疫抑制疗法对感染前免疫介质的产生和活化进行干扰都将提高PM的感染风险。因此,在结缔组织病患者治疗PSM的过程中,抗真菌药物治疗的同时,通常需要减少糖皮质激素或免疫抑制剂的用量。
同时研究发现,与HIV感染患者相比,非HIV感染的PSM患者年龄更大,较少发热、肝脾肿大、皮肤病变,并且更可能有热性嗜中性白细胞皮肤病即斯维特(Sweet)综合征、骨关节损害,实验室检查方面,非HIV感染的PSM患者中性粒细胞、CD4淋巴细胞和血小板计数更高,丙氨酸转氨酶水平和血培养阳性率较低[26],由于目前极少有针对结缔组织病合并PSM的研究,而该研究中非HIV感染病例也包括一部分结缔组织病患者,因此该结论对结缔组织病合并PSM与HIV感染合并PSM的差异可能有一定的提示作用,但需要更多的研究进一步探究。
PSM有较高的病死率,特别是在那些延迟诊断或治疗的患者中。本组20例结缔组织病合并PSM病例,其中30%(6/20)病死率,尽管大部分都有接受抗真菌治疗,包括两性霉素B、伊曲康唑、伏立康唑等抗真菌药物。该结果跟其他研究结果相似。Chan等[27]研究表明非HIV感染的PSM患者病死率27.7%(33/119)。Kawila等[26]研究表明非HIV感染的PSM患者病死率29.4%(10/34)。在这两个研究中,非HIV感染患者PSM病死率都比HIV感染患者高。这些都可能反映出由于早期临床意识不足,非HIV感染患者,包括结缔组织病患者,PSM较可能存在诊断延迟。由于PM和结核菌流行病区相似,且有相同的发病诱因和重叠的临床特征,结缔组织病合并PM感染的病例,很多最初被误诊为结核菌感染并予经验性抗结核治疗,而抗结核治疗通常需要几周到几个月时间评估治疗效果[28],从而延误诊断。本文纳入的16例患者中同样有6例(37.5%)误诊为结核菌感染(表3)。另一方面,由于PM可以在感染后一段时间表现出症状,一些居住在非流行病区的患者,在从流行病区回来几个月后才出现症状,无法及时针对PM进行诊断[29],这些因素都导致抗真菌治疗延迟。因此,提高其鉴别诊断对早期确诊结缔组织病合并PSM尤为重要。
目前PSM实验室诊断主要依赖于真菌培养,临床标本包括血、骨髓、淋巴结活检组织、皮肤活检组织、支气管肺泡灌洗液、胸水、腹水、尿液、粪便样本[10]。本组20例中,多部位真菌培养阳性,其中血液11例,皮肤及软组织病损组织5例,骨髓4例,淋巴结、肝脏、胸水、腹水、支气管肺泡灌洗液各1例。标本培养出PM是确诊PSM的金标准,目前公认的诊断依据:①沙氏琼脂培养基25 ℃及37 ℃环境下可培养出PM(金标准)[30]。②经淀粉酶消化后过碘酸雪夫染色(D-PAS)、过碘酸雪夫染色(PAS)或六胺银染色找到“腊肠状”酵母相真菌或找到菌体横隔[31]。从镜检及培养阳性结果来看,标本阳性率由高到低依次为:皮肤、骨髓、消化道黏膜、血、腹腔、痰液[32]。因此,对怀疑PM感染的患者,应反复、多部位取材送检病原学涂片和培养,尤其是血培养、皮疹渗液培养、骨髓培养等阳性率较高且创伤性相对较小的检查。然而,标本培养尽管阳性率比较高,但通常有时间消耗性,可能导致诊断延迟。寻求快速诊断的方法显得尤为重要。以血清和分子为基础的快速、准确的诊断方法正在发展,早期可采用血清学的方法寻找病原菌,通过对血清中PM抗原、抗体测定,可快速诊断PSM。采用间接免疫荧光法检测PM抗体,随后发现PM的甘露糖蛋白1基因能编码甘露糖蛋白[33],利用此特性,采用酶联免疫吸附试验测定患者血清中的PM抗原、抗体,能快速诊断此病[34]。虽然到目前为止,国内尚未开展此测定,且在广泛应用于临床前需要大量的临床试验验证。
当前,多种抗真菌药物对PSM有效,包括两性霉素B、伊曲康唑、酮康唑、伏立康唑等[35]。美国疾病预防控制中心推荐采用2周两性霉素B[0.6mg/(kg·d)]诱导后序贯口服伊曲康唑(200mg,2次/d)方案治疗10周[36]。亦有报道,感染较轻时可直接应用伊曲康唑治疗。对有肾功能损害的患者,相对两性霉素B,伏立康唑由于有效且较耐受可作为选择。本组20例患者中有3例未应用抗真菌治疗,最终导致死亡,另17例接受全身抗真菌治疗患者,14例患者临床好转或痊愈,提示及时针对PSM抗真菌治疗的必要性。
因此,目前临床工作者在诊治结缔组织病或应用免疫抑制剂患者中,应警惕合并PSM的可能,应追问本病流行区域、居住史和旅行史,出现相应症状时,应积极采集血、骨髓、淋巴结、病损皮肤等标本做病原学检查进行确诊,从而及早针对真菌治疗。
[1]ChaiwarithR,CharoenyosN,SirisanthanaT,etal.DiscontinuationofsecondaryprophylaxisagainstpenicilliosismarneffeiinAIDSpatientsafterHAART[J].AIDS, 2007, 21(3):365-367.
[2]LamKY,CheungF,YamLY,etal.Atypicalmanifestationsinapatientwithsystemiclupuserythematosus[J].JClinPathol, 1997, 50(2):174-176.
[3]ChimCS,FongCY,MaSK,etal.ReactivehemophagocyticsyndromeassociatedwithPenicilliummarneffeiinfection[J].AmJMed, 1998, 104(2):196-197.
[4]PunTS,FangD.AcaseofPenicilliummarneffeiosteomyelitisinvolvingtheaxialskeleton[J].HongKongMedJ, 2000, 6(2):231-233.
[5]HsuehPR,TengLJ,HungCC,etal.MolecularevidenceforstraindisseminationofPenicilliummarneffei:anemergingpathogeninTaiwan[J].JInfectDis, 2000, 181(5):1706-1712.
[6]LuoD,ChenM,LiuJ,etal.DisseminatedpenicilliummarneffeiinfectioninanSLEpatient:acasereportandliteraturereview[J].Mycopathologia, 2011, 171(3):191-196.
[7]LoCY,ChanDT,YuenKY,etal.PenicilliummarneffeiinfectioninapatientwithSLE[J].Lupus, 1995, 4(3):229-231.
[8]JayanetraP,NitiyanantP,AjelloL,etal.PenicilliosismarneffeiinThailand:reportoffivehumancases[J].AmJTropMedHyg, 1984, 33(4):637-644.
[9]LiyanX,ChangmingL,XianyiZ,etal.FifteencasesofpenicilliosisinGuangdong,China[J].Mycopathologia, 2004, 158(2):151-155.
[10]ChongYB,TanLP,RobinsonSetal.Penicilliosisinlupuspatientspresentingwithunresolvedfever:areportof2casesandliteraturereview[J].TropBiomed, 2012, 29(2):270-276.
[11]AkataK,YateraK,AokiT,etal.Disseminatedpulmonarypenicilliosisinarheumatoidarthritispatient[J].JThoracImaging, 2014, 29(2):W14-W16.
[12] 何柳, 杨继勇, 王蕊, 等. 类风湿关节炎伴马尔尼菲青霉菌败血症1例[J]. 检验医学与临床, 2015,12(6):875-876.
[13] 覃艳萍, 邱晔, 张建全, 等. 系统性红斑狼疮合并马尔尼菲青霉病一例并文献复习[J]. 中华内科杂志, 2016, 55(4):322-324.
[14]NgGWY,CheukW,LeeMKP,etal.FeveranddisseminatedlymphadenopathyinaSLEpatientinHongKongPart1[J].Pathology, 2006, 38(4):353-355.
[15] 高飞, 林禾. 马尔尼菲青霉菌病4例[J]. 疑难病杂志, 2011, 10(9):711-712.
[16] 何翠嫦, 陈振念, 韦启麒. 系统性红斑狼疮合并马尔尼菲青霉菌病1例报告[J]. 右江民族医学院学报, 2013,35(2):193-194.
[17] 陈虹, 张声, 李国平. 皮肌炎合并马尔尼菲青霉病的临床病理特征[J]. 中国人兽共患病学报, 2009,25(11):1117-1120.
[18] 郭庆, 邓锦惠. 皮肌炎合并马尔尼菲青霉菌胸膜感染一例报告[J]. 中国皮肤性病学杂志, 1992,6(1):35-36.
[19]CapponiM,SegretainG,SureauP.PenicillosisfromRhizomyssinensis[J].BullSocPatholExotFiliales, 1956, 49(3):418-421.
[20]UstianowskiAP,SieuTP,DayJN.PenicilliummarneffeiinfectioninHIV[J].CurrOpinInfectDis, 2008, 21(1):31-36.
[21]ChanJFW,ChanTSY,GillH,etal.Disseminatedinfectionswithtalaromycesmarneffeiinnon-AIDSpatientsgivenMonoclonalAntibodiesagainstCD20andKinaseInhibitors[J].EmergInfectDis,2015, 21(7):1101-1106.
[22]TseE,LeungRYY,KwongY.Invasivefungalinfectionsafterobinutuzumabmonotherapyforrefractorychroniclymphocyticleukemia[J].AnnHemat, 2015, 94(1):165-167.
[23]VanittanakomN,CooperCJ,FisherMC,etal.Penicilliummarneffeiinfectionandrecentadvancesintheepidemiologyandmolecularbiologyaspects[J].ClinMicrobiolRev, 2006, 19(1):95-110.
[24]SistoF,MiluzioA,LeopardiO,etal.DifferentialcytokinepatterninthespleensandliversofBALB/cmiceinfectedwithPenicilliummarneffei:protectiveroleofgammainterferon[J].InfectImmun, 2003, 71(1):465-473.
[25]StathakisA,LimKP,BoanP,etal.Penicilliummarneffeiinfectioninalungtransplantrecipient[J].TransplInfectDis, 2015, 17(3):429-434.
[26]KawilaR,ChaiwarithR,SupparatpinyoK.ClinicalandlaboratorycharacteristicsofpenicilliosismarneffeiamongpatientswithandwithoutHIVinfectioninNorthernThailand:aretrospectivestudy[J].BMCInfectDis, 2013, 13:464.
[27]ChanJF,LauSK,YuenK,etal.Talaromyces(Penicillium)marneffeiinfectioninnon-HIV-infectedpatients[J].EmergMicrobesInfect, 2016, 5(3):e19.
[28]HartJ,DyerJR,ClarkBM,etal.Travel-relateddisseminatedPenicilliummarneffeiinfectioninarenaltransplantpatient[J].TransplInfectDis,2012, 14(4):434-439.
[29]DeMonteA,RissoK,NormandAC,etal.ChronicpulmonarypenicilliosisduetoPenicilliummarneffei:latepresentationinaFrenchtraveler[J].JTravelMed, 2014, 21(4):292-294.
[30] 杜蓉, 赖仕蓉. 艾滋病合并马尔尼菲青霉菌病临床病理观察[J]. 中国社区医师:医学专业, 2012,(21):114-115.
[31] 余梦菊, 梁健科, 许向东, 等. 马尔尼菲青霉菌病胸部CT表现及临床病理分析[J]. 临床误诊误治, 2008,21(8):59-61.
[32] 刘昕超, 索小英, 汪雯, 等. 艾滋病合并马尔尼菲青霉菌感染11例临床分析并文献复习[J]. 北京医学, 2015,37(9):820-823.
[33]YuenKY,WongSS,TsangDN,etal.SerodiagnosisofPenicilliummarneffeiinfection[J].Lancet, 1994, 344(8920):444-445.
[34]WongSS,WongKH,HuiWT,etal.Differencesinclinicalandlaboratorydiagnosticcharacteristicsofpenicilliosismarneffeiinhumanimmunodeficiencyvirus(HIV)-andnon-HIV-infectedpatients[J].JClinMicrobiol, 2001, 39(12):4535-4540.
[35]ZhouF,BiX,ZouX,etal.Retrospectiveanalysisof15casesofPenicilliosismarneffeiinaSouthernChinaHospital[J].Mycopathologia, 2014, 177(5-6):271-279.
[36]KaplanJE,BensonC,HolmesKK,etal.GuidelinesforpreventionandtreatmentofopportunisticinfectionsinHIV-infectedadultsandadolescents:recommendationsfromCDC,theNationalInstitutesofHealth,andtheHIVMedicineAssociationoftheInfectiousDiseasesSocietyofAmerica[J].MMWRRecommRep, 2009, 58(RR-4):1-207,E1-E4.
杨敏,Email:minyanggz@yahoo.com
R593.2
B
1004-583X(2017)06-0531-05
10.3969/j.issn.1004-583X.2017.06.019
2017-02-05 编辑:王秋红
