循环微小RNA对冠心病患者的诊断价值
2017-06-05衣绍蕊孙经武王秀花史孟松曲辅政周红霞刘平平路新磊
衣绍蕊,孙经武,王秀花,史孟松,曲辅政,周红霞,刘平平,路新磊
(滨州医学院烟台附属医院,山东烟台264100)
循环微小RNA对冠心病患者的诊断价值
衣绍蕊,孙经武,王秀花,史孟松,曲辅政,周红霞,刘平平,路新磊
(滨州医学院烟台附属医院,山东烟台264100)
目的 探讨循环中微小RNA(miRNA)作为非侵入性生物学标志物对冠心病(CAD)患者的诊断价值。方法 采用随机、开放、对照的方法连续选取CAD患者99例[包括稳定型心绞痛(SAP)组33例、UA组66例]和非CAD患者30例(非CAD组)。分离患者RNA,应用实时定量逆转录聚合酶链反应检测三组循环中miRNA(miR-149、miR-424和miR-765)表达水平。结果 与非CAD组比较,SAP组、UA组血浆miR-149、 miR-424水平降低,miR-765水平升高,差异有统计学意义(P均<0.05)。SAP组与UA组比较,血浆miR-765水平有统计学差异(P均<0.05)。血浆miR-149、miR-424和miR-765水平鉴别诊断SAP、UA和非CAD患者的敏感性、特异性较高。结论 循环中miR-149、miR-424、miR-765可能成为诊断CAD患者的一种新型非侵入性生物学标志物。
稳定型心绞痛;不稳定型心绞痛;非冠状动脉疾病;循环微小RNA
微小RNA(miRNA)是一种较小(仅22个核苷酸长)的内生性、单链非编码RNA,通过与3′非编码区的结合,可减少或抑制信使RNA翻译,调控靶基因的表达[1]。有研究证实,miRNA在心血管内皮功能异常、炎症、细胞凋亡、新生血管形成、动脉粥样硬化和新生内膜增生或再狭窄等病理生理过程中发挥重要作用[2]。血浆中的miRNA称为循环miRNA,在小囊泡中内化及形成蛋白miRNA复合物能抵抗血浆中RNA酶活性[3,4]。最近有研究证实,循环miRNA的表达水平在不稳定型心绞痛(UA)、急性心肌梗死、心力衰竭、心房纤颤、卒中和肿瘤患者中发生显著改变[5,6]。某些循环miRNA如miR-423-5p、miR-103、miR-142-3p、miR-30b和miR-342-3p已被公认为与心衰高度相关[7]。但目前仍没有关于循环miRNA作为诊断冠心病(CAD)患者的新型生物学标志物的报道。本研究检测CAD患者血浆中miR-149、miR-424、miR-765的水平变化,以判断其对CAD的诊断价值。
1 资料与方法
1.1 临床资料 采用随机、开放、对照的方法连续选取本院2015年6月~2016年6月就诊的CAD患者99例[包括稳定型心绞痛(SAP)组33例、UA组66例]和非CAD患者30例(非CAD组)。根据AHA/ACCCAD分类标准冠状动脉造影检查至少1条主要冠脉狭窄≥50%确诊为CAD,并按照ACC/AHA指南定义SAP和UA[8]。99例CAD排除以下患者:年龄>80岁、既往心肌梗死病史、肌钙蛋白I或CK-Mb升高、左室射血分数(LVEF)≤45%、充血性心力衰竭、心律失常、严重的肝肾功能异常、肾脏替代治疗、慢性炎症或恶性疾病、近期曾行重大手术者。非CAD患者根据12导联心电图、超声心动图检查排除CAD及其他相关疾病,无卒中史、无急性或慢性肝肾疾病病史、入选前1个月无住院史。三组患者在年龄、性别、吸烟史、血压、血糖、血脂、心功能、肝肾功能等方面差异无统计学意义(P均>0.05)。本研究经医院伦理委员会批准,所有入选患者均签署知情同意书。
1.2 血液样本采集 采集CAD和非CAD患者肘前静脉血5 mL,30 min内进行两次离心处理。初次在4 ℃条件下以1 500 r/min离心15 min,收集上清液;在4 ℃条件下以14 000 r/min再次离心15 min,得到纯血浆。最后将血浆在无RNA酶的试管中-80 ℃条件下保存。
1.3 分离RNA 在250 μL血浆中加入750 μL RNA提取剂,混合均匀后室温下孵育5 min,然后加入200 μL三氯甲烷室温下孵育3 min。4 ℃以12 000 r/min离心15 min。收集上层溶液,与500 μL 100%异丙醇混合,-20 ℃保存过夜。然后将样本用离心机在4 ℃下以13 000 r/min离心15 min,使RNA沉淀。用80%乙醇500 μL清洗RNA样本2次,然后在4 ℃下以7 500 r/min离心10 min。移除上清液,将沉淀在室温下干燥5 min。用无RNA酶的清水30 μL 稀释RNA样本,然后在4℃下孵育8 h。最后,用分光光度计测量2 μL 样本中RNA浓度,将RNA样本保存在-80 ℃下供以后使用。
1.4 miRNA检测分析 应用实时定量逆转录聚合酶链反应(qRT-PCR)检测miRNA的表达。首先,在42 ℃下按照说明书应用具有反转录酶-聚合酶链锁反应的反转录试剂盒将4 μL纯RNA逆转录到互补DNA上30 min。第二,应用互补DNA 2 μL作为qRT-PCR模板。应用双链嵌合荧光染色微小miRNA反转录酶-聚合酶链锁反应的反转录试剂盒检测miR-149、miR-424和miR-765表达。选择miR-156a作为内对照,来自每项研究的每个样本均应用PCR一式三份进行分析,应用CT比较成像法计算各种miRNA的相对表达水平,以2-ΔCt表示。qRT-PCR 检测Ct值大于40的样本被认为不表达。为了降低假阳性率,本研究仅测量比健康对照组平均高2倍的CAD或不稳定型心绞痛患者的miRNA。
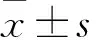
切概率法或χ2检验;应用ROC分析评估各组循环miRNA诊断准确性。P<0.05为差异有统计学意义。
2 结果
2.1 CAD患者血浆miRNA的表达 与非CAD组比较,SAP组、UA组血浆miR-149、 miR-424水平降低,miR-765水平升高,差异有统计学意义(P均<0.05)。SAP组与UA组比较,血浆miR-765水平有统计学差异(P均<0.05)。见表1。
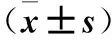
表1 三组血浆miRNA的表达水平比较
注:与非CAD组比较,*P<0.05;与UA组比较,△P<0.05。
2.2 血浆miRNA水平对CAD的诊断价值 ROC曲线分析显示,血浆miR-149,miR-424和miR-765是诊断CAD的生物学标志物。血浆miR-149、miR-424和miR-765水平鉴别诊断SAP、UA和非CAD患者最大临界点、敏感性、特异性、曲线下面积(AUC)见表2。

表2 三种miRNA鉴别诊断CAD的ROC分析
3 讨论
CAD的主要病理基础是动脉粥样硬化。动脉粥样硬化是高血脂诱导的动脉壁的慢性炎症性疾病,主要发生在内皮功能异常致血液层流改变的部位。最新的证据表明,血流状态改变调控内皮细胞中miRNA的表达[9]。循环miRNA能抵抗血浆RNA酶活性,且其性质非常稳定,最有可能成为诊断CAD的可行性生物学标志物。
研究显示,5,10-甲基四氢叶酸还原酶(MTHFR)在同型半胱氨酸代谢中发挥关键作用。MTHFR功能异常会增加血浆同型半胱氨酸水平,促进内皮功能异常和动脉粥样硬化形成,其中TNF-α在内皮功能异常发生发展中起到重要作用。人类MTHFR rs4846049(T等位基因)具有多态性的特点,其通过结合修饰miR-149显著增加中国汉族人口CAD和血脂异常的风险。miR-149能模拟转染抵消TNF-α诱导的金属蛋白酶、诱导型一氧化氮合酶和白介素-6的表达,调控TNF-α诱导内皮功能异常[10]。miR-149在心肌梗死3 d后的大鼠心肌中和接受心脏移植患者心梗边缘区域的心脏组织中的表达显著下降[11]。本研究发现,与非CAD患者相比,SAP和UA 患者血浆中miR-149水平显著下降,与上述研究结果相符,提示血浆miR-149可作为早期诊断CAD的灵敏生物学标志物。
血管内皮功能异常会使单核细胞从循环血液中迁移至血管内膜,与激活的内皮细胞结合,随后分化成巨噬细胞。miR-424促进单核细胞/巨噬细胞分化,参与动脉粥样硬化形成发展及相关并发症的形成[12]。Van Rooij[11]研究发现CAD患者血浆miR-424水平显著下降,与本研究结果一致。此外,Zhao等[13]研究发现在急性缺血性卒中患者血浆中和缺血发生后4 h的大鼠血浆及脑组织中miR-424的表达水平显著下调。其机制可能为miR-424模拟物过度表达抑制G1/S转换的主要催化剂(如CDC25A、CCND1和CDK6)抑制小胶质细胞激活,从而减少缺血性脑损伤[13]。在肺动脉高压患者中由于aplelin多肽和纤维母细胞生长因子2信号通路调节异常,血浆miR-424水平显著下降[14]。
Redell 等[15]报道,与健康志愿者相比,脑外伤患者血浆miR-765水平显著升高。血浆miR-765可能通过调控几种主要的靶基因(如组织缺氧诱导因子-3、NADPH氧化酶、低密度脂蛋白受体相关蛋白6)参与CAD的发病过程。本研究显示,与非CAD患者相比,SAP和UA患者血浆miR-765水平显著升高,提示血浆miR-765可能成为早期诊断CAD的非侵入性生物学标志物。
总之,血浆miR-149、miR-424、miR-765可能是诊断CAD患者新的非侵入性生物学标志物。但是,由于本研究是单中心小样本,该结果的真实性尚需要大型临床研究进一步证实。
[1] Diehl P, Fricke A, Sander L, et al. Microparticles: major transport vehicles for distinct microRNAs in circulation[J]. Cardiovasc Res, 2012, 93(4):633-644.
[2] Peng Y, Song L, Zhao M, et al. Critical roles of miRNA-mediated regulation of TGFb signalling during mouse cardiogenesis[J]. Cardiovasc Res, 2014,103(2):258-267.
[3] Mar-Aguilar F, Rodríguez-Padilla C, Reséndez-Pérez D.Use of serum circulating miRNA profiling for the identification of breast cancer biomarkers[J]. Methods Mol Biol, 2014(1165):71-80.
[4] Sayed AS, Xia K, Salma U, et al. Diagnosis, Prognosis and therapeutic role of circulating mirnas in cardiovascular diseases[J]. Heart Lung Circ, 2014,23(6):503-5101.
[5] Zeller T, Keller T, Ojeda F, et al. Assessment of microRNAs in patients with unstable angina pectoris[J]. Eur Heart J, 2014,35(31):2106-2114.
[6] Waters PS, Dwyer RM, Brougham C, et al. Impact of tumour epithelial subtype on circulating microRNAs in breast cancer patients[J]. PLoS One, 2014,9(3):50-60.
[7] Ellis KL, Cameron VA, Troughton RW, et al. Circulating microRNAs as candidate markers to distinguish heart failure in breathless patients[J]. Eur J Heart Fail, 2013,15(10):1138-1147.
[8] Fihn SD, Gardin JM, Abrams J, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the diagnosis and management of patients with stable ischemic heart disease [J]. Am Coll Cardiol, 2012,60(24):144-164.
[9] Kumar S, Kim CW, Simmons RD, et al. Role of flow-sensitive microRNAs in endothelial dysfunction and atherosclerosis:mechanosensitive athero-miRs[J]. Arterioscler Thromb Vasc Biol, 2014,34(10):2206-2216.
[10] Palmieri D, Capponi S, Geroldi A, et al. TNFa induces the expression of genes associated with endothelial dysfunction through p38MAPK-mediated down-regulation of miR-149[J]. Biochem Biophys Res Commun, 2014,443(1):246-251.
[11] Van Rooij E, Sutherland LB, Thatcher JE, et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proc Natl Acad Sci U S A, 2008,105(35):13027-13032.
[12] Munoz-Pacheco P,Ortega-Hernández A, Miana M,et al.Ezetimibe inhibits PMA induced monocyte/macrophage differentiation by altering microRNA expression: a novel anti-atherosclerotic mechanism[J]. Pharmacol Res, 2012,66(6):536-543.
[13] Zhao H, Wang J, Gao L, et al. MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation[J]. Stroke, 2013,44(6):1706-1713.
[14] Kim J, Kang Y, Kojima Y, et al. An endothelial apelin-FGF link mediated by miR-424 and miR-503 is disrupted in pulmonary arterial hypertension[J]. Nat Med, 2013,19(1):74-82.
[15] Redell JB, Moore AN, Ward NH, et al. Human traumatic brain injury alters plasma microRNA levels[J]. Neurotrauma, 2010,27(12):2147-2156.
10.3969/j.issn.1002-266X.2017.17.019
R541.4
B
1002-266X(2017)17-0056-03
2016-10-27)
