秋水仙素对大蒜愈伤组织四倍体的诱导效应及试管鳞茎快繁体系构建
2017-06-01王宁宁徐李薇高晖何融封尚云涛范宝莉王振英
王宁宁徐李薇高 晖何融封尚云涛范宝莉王振英*
(1天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2天津市水资源与水环境重点实验室,天津 300387)
秋水仙素对大蒜愈伤组织四倍体的诱导效应及试管鳞茎快繁体系构建
王宁宁1徐李薇1高 晖1何融封1尚云涛2范宝莉1王振英1*
(1天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2天津市水资源与水环境重点实验室,天津 300387)
以大蒜品种六瓣红鳞茎片作为外植体诱导愈伤组织,用秋水仙素作为诱变剂对大蒜愈伤组织进行多倍体诱导,并比较了不同秋水仙素浓度及处理时间对大蒜愈伤组织多倍体诱导效应的影响。结果表明,大蒜愈伤组织四倍体诱导率随秋水仙素处理浓度递增而升高,随处理时间递增呈现先升高后降低的趋势;染色体畸变率随秋水仙素浓度升高及处理时间延长而升高。当秋水仙素浓度为0.200%,处理时间为18 h时,四倍体诱导率最高,为36.36%,可以作为最适诱导体系。经秋水仙素诱导后的愈伤组织成功再生出试管苗并获得试管鳞茎。
多倍体育种;大蒜;秋水仙素;愈伤组织;试管鳞茎大蒜(Allium sativumL.)是百合科葱属一年生草本植物,在我国种植历史悠久,栽培广泛,在蔬菜产业发展中占有非常重要的地位。大蒜为二倍体植株,其染色体数为 2n=16,主要以肥大的肉质鳞茎和鲜嫩的花茎器官为产品。大蒜品种资源较为丰富,但由于花器官退化花粉败育,长期利用鳞茎进行无性繁殖而无法杂交育种,大蒜的遗传学和生物学多样性不能得到充分利用,同时一些优良种质也因种性退化而濒临灭绝,因此大蒜的种质资源创新和新品种培育势在必行(Kondo et al.,2000;徐培文 等,2006;杨茹 等,2010;孙奇,2012;张雨 等,2012;Cheng et al.,2012;Dixit & Chaudhary,2014)。自1937年开创倍性育种先河以来,全球掀起了多倍体育种热潮。多倍体育种是近代作物育种常用方法之一,对改良无性繁殖作物的营养器官具有明显的优越性。多倍体植株最明显的特征是相对的“巨大化”、植株生物量及次级代谢产物含量高、适应性和抗逆性强等(Dhawan & Lavania,1996;Gao et al.,1996;周玉丽 等,2011)。因此,多倍体育种可以提高作物产量、改善产品品质、增强抗逆性,是作物品种改良的重要途径(于文艳 等,2008;董飞 等,2011)。常规多倍体诱导技术由于诱变发生在单个细胞中,利用整体植株或器官为材料时常产生嵌合体现象,诱变率低,受环境干扰大,畸变率高,可能发生回复突变等(余建明 等,1991)。而以植物愈伤组织作为诱变材料,在离体条件下染色体加倍具有显著的优越性:试验条件容易控制,试验结果重复性强,工作效率高,嵌合体发生率低,因此,离体组织的染色体加倍日益受到重视(周香君,2008;薛小艳 等,2014)。
作为潜在的多倍体育种优势材料,大蒜多倍体育种研究也受到关注,但进展缓慢。目前大蒜的多倍体育种研究,已经实现了采用大蒜茎尖、根尖、花苞(孔祥祯,1990;张素芝和李纪蓉,2006;周香君和程智慧,2008;武延生,2012;薛小艳 等,2014)等为材料经秋水仙素处理后获得染色体加倍的效果,部分研究获得了染色体加倍的再生植株,但利用大蒜愈伤组织进行多倍体细胞诱导的研究鲜有报道。愈伤组织繁殖系数高,以愈伤组织为诱变材料,处理离体培养的细胞,为大蒜多倍体育种提供了新的途径。化学诱变是多倍体技术诱导普遍采用的方法之一,目前已报道的多倍体诱导剂多属于有丝分裂中期抑制剂,其中秋水仙素是诱导植物细胞染色体加倍最普遍的药剂(张数鑫 等,2005;贾美丽 等,2011;孔素萍 等,2014)。已报道的研究中,直接将大蒜再生植株试管苗种植于田间,由于其根系不能发挥功能,需要重新发生新的根系,在生长过程中幼苗纤细脆弱,恢复生长慢,移栽成活率很低,需较多的人力物力,成本高,同时,试管苗生产与大田栽培对季节依赖性不同,造成微繁工作忙闲不匀,影响设备的周年利用率,这些问题致使大蒜品种改良技术仍受到限制,难以推广。而将试管苗先形成试管鳞茎后再直接种植于大田,虽然增加了离体培养的工作量,但试管鳞茎本身具有较强的抗逆能力,无需驯化,易于管理,能明显提高试管苗的移栽成活率(刘高琼 等,1996;刘伟伟 等,2013)。
本试验以宝坻大蒜品种六瓣红的鳞茎为材料,以横切得到的鳞茎片为外植体诱导愈伤组织,用不同浓度的秋水仙素浸泡处理愈伤组织不同时间后,恢复培养后再生试管苗继而诱导试管鳞茎,以期得到四倍体大蒜试管鳞茎。
1 材料与方法
1.1试验材料
供试大蒜品种为种植于天津师范大学生物科技园的宝坻大蒜品种六瓣红,通常大蒜的形态规则呈六瓣,表皮紫红色,故称为六瓣红。于2014年10底种植于天津师范大学生物科技园中,翌年5月收获,放置于阴凉处备用。诱导愈伤组织的试剂为秋水仙素(Genview,美国)。
1.2试验方法
1.2.1 以大蒜鳞茎片为外植体诱导愈伤组织及继代培养 选取新鲜饱满、没有病斑的大蒜鳞茎,剥去外皮后用自来水冲洗30 min以上,然后于紫外灭菌后的超净工作台中用0.10%的 HgCl2浸泡20 min,无菌蒸馏水洗涤2~3次,再用75%的酒精浸泡10 min,无菌蒸馏水洗涤3~5次。将大蒜鳞茎切成0.2~0.5 cm厚的片状,太薄或太厚均不利于愈伤组织的形成。然后将鳞茎片接到诱导愈伤组织的培养基中,培养基为MS + 1.5 mg·L-12,4-D + 0.5 mg·L-1KT + 30 g·L-1蔗糖 + 7.5 g·L-1琼脂,pH=5.8,置于人工气候箱中进行暗培养,培养温度 (25±2)℃。
当诱导出淡黄色颗粒状的愈伤组织并且愈伤组织足够多时进行继代培养,培养条件同上,约28 d后进行第2次继代。
1.2.2 秋水仙素诱导愈伤组织加倍体系构建 愈伤组织继代2次后,取生长旺盛的愈伤组织,将其分散成约0.1 cm3大小的颗粒状,试验组用0.025%、0.050%、0.100%、0.200% 4种不同浓度(m∶V,溶剂为蒸馏水)的秋水仙素在培养瓶中分别浸泡处理愈伤组织4、8、12、18、24 h(颗粒状愈伤组织刚好平铺于培养瓶底部,秋水仙素溶液能没过愈伤组织即可),共20个处理,于室温暗处静置处理;空白对照组(CK)不经过任何浓度秋水仙素处理,试验组每个处理及空白对照组均做3次平行试验。处理结束后(时间选在细胞分裂最为旺盛的 10:00~11:00),分别用蒸馏水冲洗愈伤组织3~4次,在滤纸上吸干。用卡诺固定液(无水乙醇∶冰醋酸=3V∶1V)过夜固定,固定时间不超过24 h。再用蒸馏水冲洗愈伤组织3~4次,于滤纸上吸干。分别将经过不同处理的愈伤组织材料置于保存液(70%乙醇)中保存,待进行细胞学观察,统计试验组及对照组愈伤组织的分裂指数、四倍体率及畸变率。
取保存液中的愈伤组织,蒸馏水冲洗3~4次,于滤纸上吸干,用1 M HCl 在60 ℃水浴中酸解8 min,蒸馏水冲洗3~4次后滤纸吸干,卡宝品红染色10 min后压片,显微镜下(10×20倍及10×40倍)观察染色体形态。分别统计对照组及试验组愈伤组织细胞的分裂指数、四倍体率及畸变率。3次重复,每次重复中,不同处理下的愈伤组织细胞分别观察并统计了1 000个以上(每个视野约100个细胞,一次重复为10个视野)。四倍体率相对较高并且畸变率相对较低的处理为最适诱导体系。
分裂指数=视野中分裂期细胞数/视野中细胞总数×100%
四倍体率=视野中四倍体细胞数/视野中分裂期细胞数×100%
畸变率=视野中染色体畸变的细胞数/视野中分裂期细胞数×100%
1.2.3 秋水仙素处理愈伤组织及再分化不定芽 用最适诱导体系的秋水仙素浸泡处理愈伤组织,无菌蒸馏水冲洗干净后接入继代培养基(MS + 1.5 mg·L-12,4-D + 0.5 mg·L-1KT + 30 g·L-1蔗糖 + 7.5 g· L-1琼脂,pH=5.8)进行恢复培养,置于人工气候箱中进行暗培养,培养温度(25 ± 2)℃。
恢复培养一段时间后,将秋水仙素处理后的愈伤组织转移至再分化培养基(MS + 3 mg·L-16-BA + 30 g·L-1蔗糖 + 7.5 g·L-1琼脂,pH=5.8)诱导不定芽,对照组的愈伤组织继代2次后直接再分化不定芽。置于人工气候箱中培养,培养温度(25 ± 2)℃,光照强度为1 500 lx,光照时间为6:00~ 22:00,共16 h·d-1。
1.2.4 试管鳞茎诱导与收获 将长至5 cm左右的试管苗移入诱导试管鳞茎培养基,培养基为MS + 120 g·L-1绵白糖 + 6.8 g·L-1琼脂,pH=7.5,置于人工气候箱中培养,培养温度(25 ± 2)℃,光照强度为1 500 lx,光照时间为6:00~22:00,共16 h·d-1,观察并记录试管鳞茎的生长状况。
试管鳞茎成熟后,从培养瓶中将其取出,并将表层培养基清洗干净后阴干,4 ℃低温贮存21 d左右田间种植。
2 结果与分析
2.1以大蒜鳞茎片为外植体诱导愈伤组织及继代培养
将大蒜鳞茎片作为外植体接种到诱导愈伤组织培养基中(图1-a),14 d左右可观察到外植体表面增厚膨大并变得蓬松,随后可观察到鳞茎片表面持续膨大形成透明的突起状结构(图1-b),约42 d后开始出现颗粒状的愈伤组织(图1-c),56 d左右可观察到大量愈伤组织生成(图1-d)。为保证组织活力,防止有毒代谢物积累及培养基枯竭,精选健康的愈伤组织作为新的外植体继代2次,将颗粒状愈伤组织切下转移到继代培养基中进行继代培养,继代28 d后,愈伤组织增殖明显(图1-e),进行第2次继代培养,继代后的愈伤组织生长良好(图1-f)。
2.2秋水仙素诱导愈伤组织加倍体系构建

图1大蒜愈伤组织诱导与继代
对照组二倍体大蒜愈伤组织压片镜检可以清晰观察到16条染色体,染色体分裂期形态如图2-a~e所示。经秋水仙素诱导后,大蒜愈伤组织染色体出现加倍现象,可以观察到四倍体染色体,染色体分裂期形态如图2-f~l所示。诱导后大蒜愈伤组织有丝分裂中期细胞染色体清晰,染色体的着丝点排列在赤道板上(图2-g~j),有丝分裂后期及末期加倍后的染色体分别进入细胞两极(图2-k、l)。
当秋水仙素浓度高于0.100%、诱导时间12 h以上,大蒜愈伤组织染色体畸变现象明显增多,出现多于四倍体现象(图3-a~d),并能观察到部分二倍体愈伤组织染色体分裂异常,出现染色体单桥(图3-e)、多桥(图3-f)、染色体多桥及染色体不均等分裂(图3-g)、微核(图3-h)、染色体滞后 (图3-i)及染色体多极化(图3-j、k),部分加倍得到的四倍体细胞也会出现染色体畸变现象,如染色体散乱(图3-l)等。
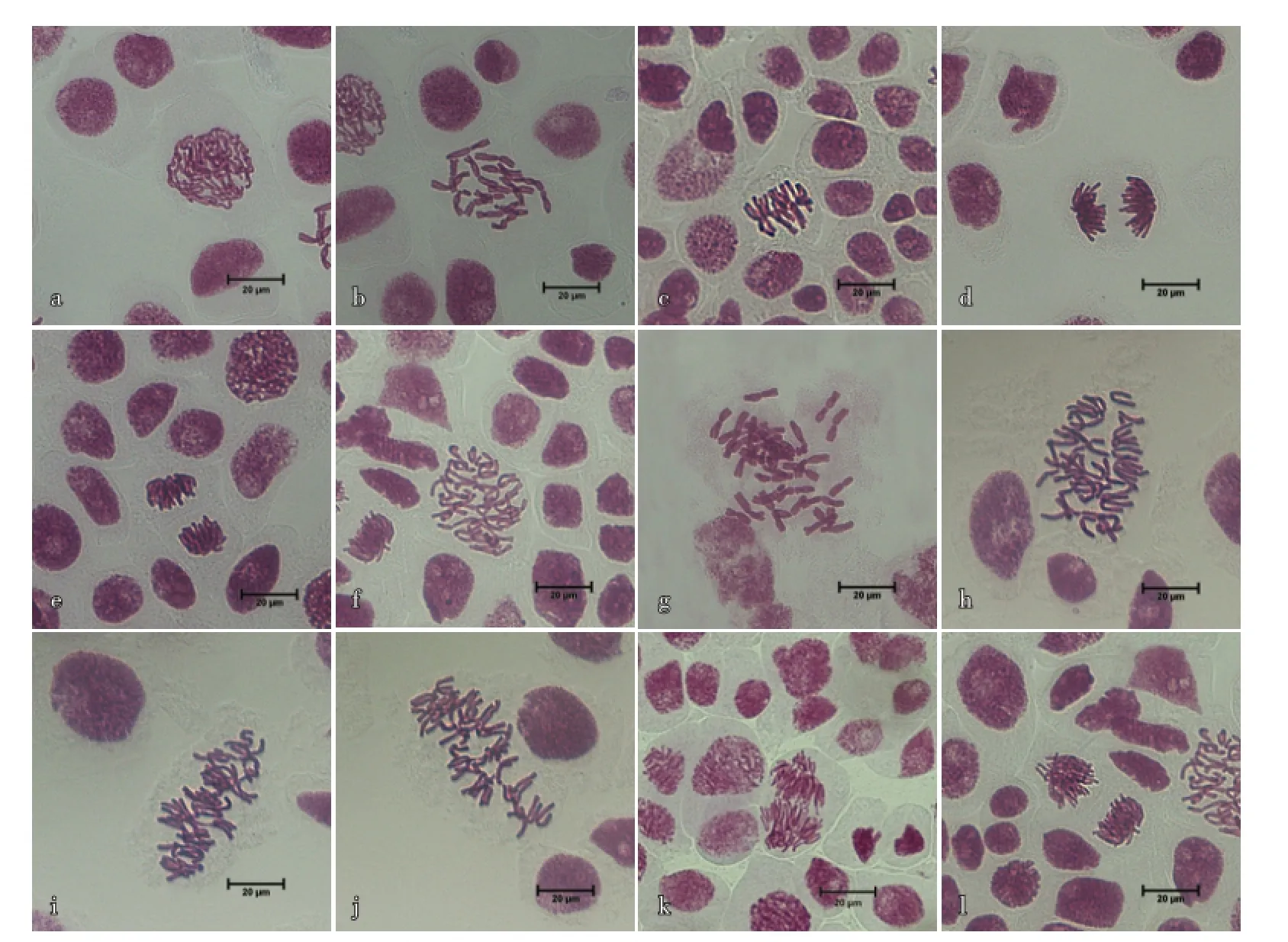
图2二倍体与四倍体大蒜愈伤组织分裂期染色体形态(10×40倍)

图3大蒜愈伤组织染色体畸变类型(10×40倍)
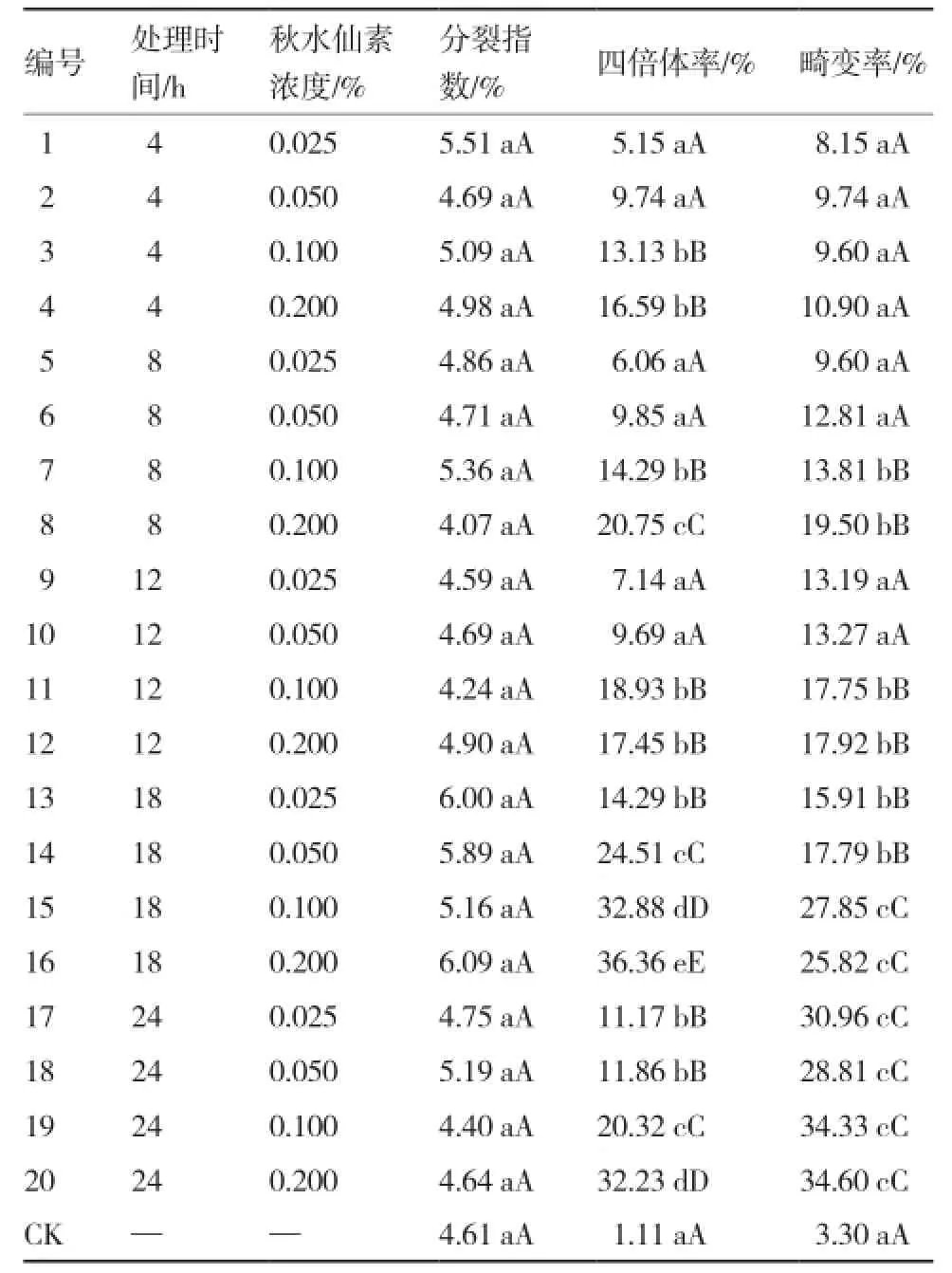
表1不同秋水仙素处理对大蒜愈伤组织的分裂指数、四倍体率及畸变率的影响
从表1可以看出,秋水仙素处理18 h的中期分裂指数较高,继续延长处理时间反而不利于细胞分裂。相同秋水仙素浓度下随处理时间的延长,四倍体率呈先上升后下降的趋势。相同处理时间下秋水仙素浓度越高,四倍体率越高。当秋水仙素浓度为0.200%,处理时间为18 h时,四倍体率最高,达36.36%,且与其他处理差异达极显著水平。过高的秋水仙素浓度及处理时间不能持续提高细胞四倍体率,反而会导致细胞畸变率上升。
图4是以二倍体大蒜六瓣红为对照,用优化后的体系处理愈伤组织的染色体倍性对比,结果表明,二倍体大蒜染色体数为2n=2X=16(图4-a),四倍体大蒜染色体数为2n=4X=32(图4-b)。
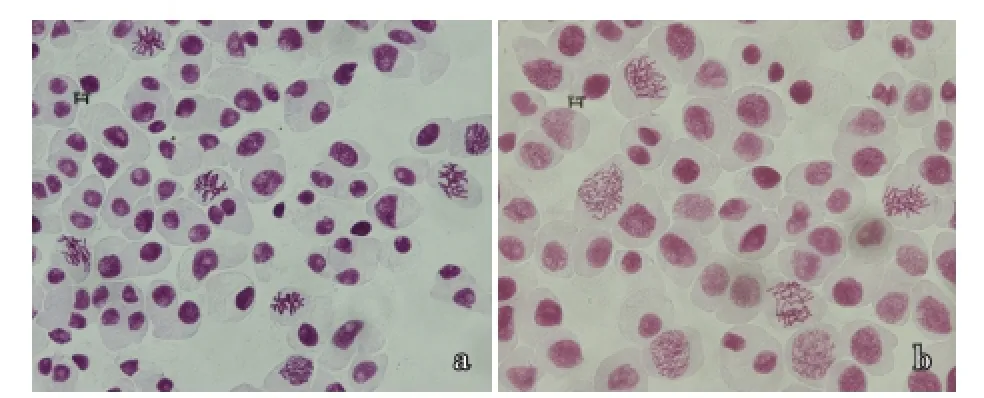
图4二倍体与四倍体大蒜愈伤组织染色体形态(10×20倍)
2.3秋水仙素处理愈伤组织及再分化不定芽
利用秋水仙素浸泡处理愈伤组织(图5-a),置于继代培养基上恢复培养(图5-b)。7 d后,愈伤组织表面出现新生的组织(图5-c);28 d后,愈伤组织生长旺盛(图5-d),可用于再生分化。部分愈伤组织在恢复培养中出现褐化现象(图5-e、f),可能是由于秋水仙素毒性造成细胞生理活性降低甚至死亡。

图5秋水仙素诱导大蒜愈伤组织加倍及恢复培养
将恢复培养后生长旺盛的愈伤组织置于再分化培养基上(图6-a),7 d左右愈伤组织没有明显再分化现象(图6-b),14 d左右可以观察到愈伤组织表面开始出现绿点(图6-c),绿点不断生长,逐渐形成不定芽(图6-d),28 d左右不定芽长至约2 cm(图6-e),42 d后不定芽生长旺盛,约5 cm,可用于诱导试管鳞茎(图6-f)。
2.4试管鳞茎诱导与收获
将生长至5 cm左右的试管苗移入诱导试管鳞茎培养基(图7-a),移植7 d左右试管苗基部开始膨大,逐渐形成试管鳞茎(图7-b),试管鳞茎不断膨大(图7-c、d),28 d左右试管鳞茎表皮开始呈现紫色,趋于成熟(图7-e),42 d后试管苗枯 萎,试管鳞茎完全成熟(图7-f),可以收获。

图6秋水仙素处理后大蒜愈伤组织再分化及再生试管苗
将收获的试管鳞茎(图8-a)进行解剖观察,可清晰观察到生长点(图8-b),表明收获的试管鳞茎可于田间再生出植株,这为后期再生植株田间性状观察及细胞学倍性鉴定奠定了基础。
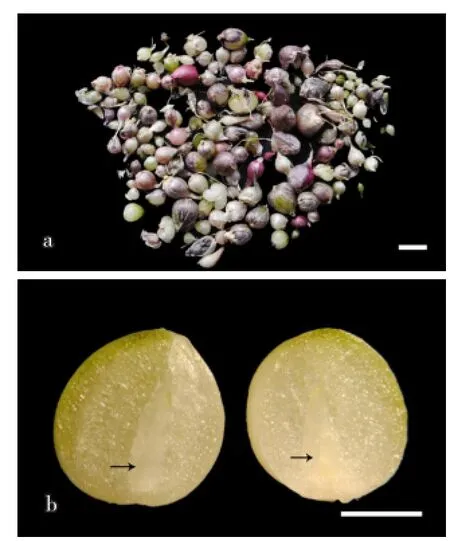
图8大蒜试管鳞茎形态及生长点
3 讨论
秋水仙素是常见的多倍体化学诱导剂之一。不同材料对秋水仙素的耐受性存在差异,因此加倍处理时所用秋水仙素的最适浓度和最佳处理时间也不相同。目前已有应用于大蒜多倍体育种的报道,谢晓玲和邓自发(2009)用秋水仙素处理嘉定白蒜生长点,结果表明秋水仙素浓度为0.05%,处理时间为6 d时染色体加倍率最高,达28.67%;孔素萍等(2014)研究了秋水仙素对山东苍山蒲棵、四川正月早和新疆紫皮3个不同品种大蒜茎尖试管苗成苗率的影响及染色体加倍率效应,结果显示3个品种的大蒜最适诱导条件均不同,其中正月早的成苗率和加倍率最高,分别为48.69%和9.15%,最适秋水仙素浓度为0.268%~0.694%,处理时间为61.1~113.8 h。武延生(2012)以不同浓度秋水仙素处理邢台当地紫皮蒜根尖,结果表明秋水仙素浓度为0.50 g·L-1,处理时间为24~48 h的大蒜根尖膨大率高于82%,并且观察到细胞核显著增大。薛小艳等(2014)用秋水仙素注射苍山糙蒜和金蒜3号花苞,发现随秋水仙素浓度升高,气生鳞茎数不断降低,染色体加倍率升高,两个品种大蒜的最适秋水仙素处理浓度及四倍体诱导率分别为0.20%、7.69%和0.15%、11.76%。前人研究发现,在愈伤组织诱导及培养过程中常常导致细胞染色体组自然发生内源多倍化(李士生和张玉玲,1991),愈伤组织本身的这种染色体不稳定性可能有利于加倍诱导多倍体细胞的发生,且愈伤组织再生能力强。本试验结果表明,秋水仙素浓度及处理时间是大蒜愈伤组织多倍体诱导的关键。
本试验中,大蒜愈伤组织四倍体率随秋水仙素浓度递增呈逐渐上升趋势,随处理时间延长呈先上升后下降趋势。染色体畸变率随秋水仙素浓度递增及处理时间延长而升高。过高的处理浓度及过长的处理时间不一定能增加大蒜愈伤组织四倍体率,反而增加对细胞的毒害作用,这与张素芝和李纪蓉(2006)关于大蒜四倍体的研究结果相一致。秋水仙素已被证实具有诱导染色体畸变效应,这可能是由于秋水仙素与微管蛋白二聚体结合,导致纺锤体微管不能聚合,影响有丝分裂而造成的(翟中和,1995)。李卓等(2009)研究了秋水仙素对黑麦根尖细胞染色体的诱导畸变效应,结果表明,随处理时间的延长和秋水仙素浓度的升高,染色体畸变率呈先上升后下降趋势,最高为8.10%。
秋水仙素具有毒性,谭德冠等(2005)认为,在暗条件下或弱光条件下可减轻秋水仙素对植物的伤害,因此本试验浸泡处理愈伤组织在暗处进行。结果显示,秋水仙素处理后大蒜愈伤组织细胞染色体在加倍的同时也存在畸变现象,这可能是高浓度秋水仙素及长时间处理干扰了细胞有丝分裂进程,染色体不能被纺锤丝正常拉向两极,在有丝分裂中后期染色体分布不规则,形成如染色体单桥、染色体多桥、染色体滞后、染色体多极化、染色体散乱及微核等畸变现象。其中微核的出现表明有丝分裂后期丧失着丝粒的染色体断片不能进入主核,是真核细胞遗传毒性的直观体现,表示秋水仙素对细胞毒害作用加剧。可见确定适宜的处理浓度及时间对提高细胞加倍效率、降低畸变率、减轻诱导剂对细胞的毒害以及节约药剂等方面都是十分必 要的。
目前由组织培养获得大蒜脱毒快繁种苗已成为大蒜组培快繁的常见技术手段,但试管苗的炼苗、移栽及驯化对环境条件要求极高,移栽成活率低,不宜在大田试验推广。通过组培途径诱导发育的试管鳞茎对环境适应性强、耐贮藏、易成活,是理想的大蒜快繁育种技术(刘高琼 等,1996)。本试验将愈伤组织的高诱导率与试管鳞茎的高成活率相结合,对秋水仙素诱导愈伤组织加倍做了初步研究,观察到了四倍体细胞,并成功诱导出试管苗及试管鳞茎,且可明显观察到试管鳞茎的生长点,这为大蒜多倍体育种提出了新的研究思路。再生植株的田间性状观察及细胞学染色体鉴定,有待进一步 研究。
4 结论
4种 不 同 浓 度(m∶V=0.025%、0.050%、0.100%、0.200%)的秋水仙素分别浸泡处理大蒜愈伤组织4、8、12、18、24 h后,四倍体率随秋水仙素处理浓度递增而升高,随处理时间递增呈现先升高后降低的趋势;染色体畸变率随秋水仙素浓度递增及处理时间延长而升高。最优处理为0.200%的秋水仙素处理愈伤组织18 h。采用最优处理来浸泡愈伤组织,恢复培养后可再生出试管苗并获得试管鳞茎。
董飞,陈运起,刘世琦,高莉敏,王传增,陈伟.2011.秋水仙素诱导大葱多倍体的研究.园艺学报,38(12):2381-2386.
贾美丽,王飞,贾爱平,郑丽娜.2011.秋水仙素诱导葡萄风信子多倍体的研究.西北农业学报,20(1):114-118.
孔素萍,曹齐卫,孙敬强,刘波,徐坤.2014.秋水仙素对大蒜茎尖试管苗四倍体的诱导.中国农业科学,47(15): 3025-3033.
孔祥祯.1990.用大蒜根尖诱发多倍体.生命世界,(2):14.
李士生,张玉玲.1991.小麦愈伤组织及再生植株的染色体变异.遗传学报,(4):332-338.
李卓,沈彬,张竞秋.2009.秋水仙素诱导黑麦根尖细胞染色体的畸变效应.麦类作物学报,29(1):44-48.
刘高琼,李式军,张学平.1996.大蒜试管鳞茎微繁技术研究.南京农业大学学报,19(3):31-36.
刘伟伟,刘宇峰,宋淑敏,王晓楠,潘静.2013.矮壮素在大蒜试管苗生长和鳞茎形成上的应用研究.安徽农业科学,(28):11291-11292.
孙奇.2012.鳞茎贮藏时间对诱导大蒜四倍体植株的影响〔硕士论文〕.泰安:山东农业大学.
谭德冠,庄南生,黄华孙.2005.组织培养与秋水仙碱诱导相结合培育植物多倍体的应用.亚热带植物科学,34(1):77-80.
谢晓玲,邓自发.2009.秋水仙素对大蒜生长的影响及多倍体诱导效应分析.安徽农业科学,37(9):4191-4194.
徐培文,刘冰江,孔素平,王精勇.2006.大蒜种质创新和育种研究进展.中国蔬菜,(6):31-33.
薛小艳,刘世琦,郭会平,孙亚丽,于新会,连海峰.2014.秋水仙素注射大蒜花苞诱导四倍体的研究.中国蔬菜,(4): 29-33.
杨茹,刘世琦,张自坤,刘中良,张立伟,马琳.2010.大蒜原生质体游离和纯化的研究.中国农学通报,26(4):195-199.
余建明,吴鹤鸣,陆维忠,周邗扬,丁犁平,濮冶民.1991.秋水仙素对大蒜离体培养细胞染色体倍性的影响.核农学通报,12(4):162-164.
于文艳,刘世琦,梁庆玲,郝树芹.2008.大蒜二倍体与四倍体生长和生理指标的比较研究.山东农业科学,(2):42-44.
武延生.2012.秋水仙素诱导大蒜根尖多倍体的研究.北方园艺,(23):36-38.
翟中和.1995.细胞生物学.北京:高等教育出版社.
张数鑫,谢芝馨,于元杰,张玉喜,程立.2005.秋水仙素结合组织培养技术诱导大葱多倍体的研究.生物技术,15(4):67-70.
张素芝,李纪蓉.2006.秋水仙素诱导大蒜四倍体的研究.核农学报,(4):303-308.
张雨,王勇,陈典.2012.甲基胺草磷诱导大蒜多倍体的研究.中国蔬菜,(14):90-94.
周香君.2008.大蒜多倍体化学诱导技术研究〔硕士论文〕.杨凌:西北农林科技大学.
周香君,程智慧.2008.蒜瓣茎尖注射秋水仙素的诱变效果和诱变方法的建立.西北农业学报,(5):267-271.
周玉丽,任士福,张成合.2011.连翘多倍体诱导与鉴定.河北农业大学学报,34(1):73-77.
Cheng Z H,Zhou X J,Khan M A,Su L,Meng H W.2012.In vitro induction of tetraploid garlic with trifluralin.Genetics and Molecular Research GMR,11(3):2620-2628.
Dhawan O P,Lavania U C.1996.Enhancing productivity of secondary metabolites via induced polyploidy:review.Euphytica,87(2):81-89.
Dixit V,Chaudhary B R.2014.Colchicine-induced tetraploidy in garlic(Allium sativumL.)and its effect on allicin concentration.Journal of Horticultural Science and Biotechnology,89(5):589-591.
Gao S L,Zhu D N,Cai Z H,Xu D R.1996.The relation between characters and quality of crude drug in polyploid lines of danshen(Salvia MiltiorrhizaB.).Journal of Plant Resources and Environment,5(2):1-4.
Kondo T,Hasegawa H,Suzuki M.2000.Transformation and regeneration of garlic(Allium sativumL.)by Agrobacteriummediated gene transfer.Plant Cell Reports,19(10): 989-993.
Tetraploid Inductive Effect of Colchicine in Garlic Callus and Construction of Rapid Propagation System of Bulblets in vitro
WANG Ning-ning1,XU Li-wei1,GAO Hui1,HE Rong-feng1,SHANG Yun-tao2,FAN Bao-li1,WANG Zhen-ying1*
(1CollegeofLifeScience,TianjinNormalUniversity,TianjinKeyLaboratoryofAnimalandPlantResistance,Tianjin300387,China;2TianjinCityKeyLaboratoryofWaterResourcesandEnvironment,Tianjin300387,China)
Taking garlic cultivar ‘Liubanhong’ bulb pies as explants to induce callus,and colchicine as mutagenic agent,this paper conducted polyploid induction on the callus and compared the effect of different colchicine concentrations and treating time on garlic callus. The results showed that the tetraploid inducing rate was increased along with the increasing of colchicine concentration,while showing a tendency of first increasing then decreasing along with the increase of colchicine treatment time. The chromosomal aberration rate was increased along with the increasing of colchicine concentration and treatment time. When the concentration of colchicine was 0.200%,the treating time was 18 h,the highest tetraploid inductivity was 36.36%,which could be used as the optimum induction system. The callus treated by colchicine could successfully regenerate test-tube plantlet and then bulblet in vitro was gained.
Polyploidy breeding;Garlic;Colchicine;Callus;Bulblet in vitro
王宁宁,女,硕士研究生,专业方向:细胞生物学,E-mail:lbxq0801@163.com
*通讯作者(Corresponding author):王振英,教授,硕士生导师,专业方 向:植物抗性分子生物学,E-mail:wzycell@163.com
2017-01-03;接受日期:2017-03-02
天津市农委科技成果转化与推广项目(201302030),天津师范大学应用开发基金项目(52XK1505,52XK1210),天津市科委面上项目(14JCYBJC29900)
