山东地区棕榈蓟马对甜瓜黄斑病毒的传播
2017-06-01代惠洁刘锦刘永杰乔宁马井玉张安盛
代惠洁刘 锦刘永杰乔 宁马井玉张安盛
(1潍坊科技学院,山东寿光 262700;2山东农业大学植物保护学院,山东泰安 271018;3济宁市农业科学研究院,山东济宁 272100;4山东省农业科学院植物保护研究所,山东济南 250100)
山东地区棕榈蓟马对甜瓜黄斑病毒的传播
代惠洁1,2刘 锦2刘永杰2乔 宁2马井玉3张安盛4*
(1潍坊科技学院,山东寿光 262700;2山东农业大学植物保护学院,山东泰安 271018;3济宁市农业科学研究院,山东济宁 272100;4山东省农业科学院植物保护研究所,山东济南 250100)
在山东济南董家镇温室内发现疑似感染甜瓜黄斑病毒(Melon yellow spot virus,MYSV)的黄瓜植株,通过RT-PCR检测,获得大约500 bp的特异性片段。经测序确认,该病毒为MYSV;对发病植株温室内采集的棕榈蓟马进行RT-PCR检测,发现33.3%的棕榈蓟马体内携带MYSV。室内试验中,MYSV感病株率随着带毒棕榈蓟马数量和取食时间增加而明显升高,表明棕榈蓟马能有效传播MYSV,其种群数量和取食时间对MYSV的传播具有显著的影响,生产中可通过防控棕榈蓟马预防MYSV的传播。
甜瓜黄斑病毒;棕榈蓟马;传毒
甜 瓜 黄 斑 病 毒(Melon yellow spot virus,MYSV)属于布尼亚病毒科(Bunyaviridae)番茄斑萎病毒属(Tospovirus),主要危害甜瓜、西瓜、黄瓜和苦瓜(Kato et al.,2000;Takeuchi et al.,2001;Chen et al.,2008)。MYSV侵染植株后叶片出现明脉、褪绿斑点,严重时形成大的坏死斑,导致叶片发黄、干枯,影响果实的品质和产量。甜瓜黄斑病毒2000年首次在日本被发现(Kato et al.,2000),随后泰国也报道了该病毒的发生(Bhunchoth et al.,2005)。我国最早在台湾报道(Chen et al.,2008),而后在海南、山东等地也有报道(Gu et al.,2011;乔宁 等,2015)。MYSV主要是通过棕榈蓟马(Thrip palmiKarny)以持久性增殖方式传播,也可通过汁液摩擦接种传播(古勤生 等,2012)。
棕榈蓟马又叫节瓜蓟马、棕黄蓟马、瓜蓟马,是近年来我国尤其是北方地区新发生的一种灾难性害虫。该虫体型微小,隐蔽性强,在保护地可以常年繁殖,寄主范围广;喜食茄科、葫芦科等多种蔬菜,受害后植株叶片出现银灰色斑点,发育缓慢,果实畸形、脱落。棕榈蓟马除了直接取食为害植株外,还能以持久性方式高效传播植物病毒,如番茄斑萎病毒(Tomato spotted wilt virus,TSWV)(Yeh et al.,1992;杨英华 等,2011)、甜瓜黄斑病毒(MYSV)(Kato et al.,2000)等多种病毒病,严重影响蔬菜的产量和质量,给设施蔬菜安全生产带来极大威胁。本试验对田间采集的疑似感染MYSV的黄瓜植株进行分子鉴定,并对棕榈蓟马体内MYSV进行了检测;室内测定了带毒棕榈蓟马种群数量和取食时间对MYSV感病株率的影响,以期明确棕榈蓟马传播MYSV的发生规律,为甜瓜黄斑病毒的预测预报和综合防治提供理论依据。
1 材料与方法
1.1样品采集
1.1.1 疑似感染病毒样品的采集 2015年5月从济南市董家镇张尔村温室黄瓜棚采集疑似感染MYSV的黄瓜叶片30份,放于-80℃冰箱内备用。健康对照为置于山东省农业科学院温室内严格防虫的健康黄瓜苗,经检测未感染MYSV。
1.1.2 棕榈蓟马样本的采集 采用5点取样法在感病黄瓜植株上采集300头棕榈蓟马成虫,采集的样品置于95%的乙醇中,-80 ℃冰箱保存。
1.2试验方法
1.2.1 引物合成 利用根据甜瓜黄斑病毒的sRNA上N基因保守序列设计的特异性引物MYSV-F/ MYSV-R(杨英华 等,2011)来检测样品。引物由上海生工生物技术有限公司合成,其引物序列如下,MYSV-F:5′- GACAACAGGGCAGAGCGAAT G-3′,MYSV-R:5′- TACCGTTACTAAGCTGACAA AGGAGAA-3′。
1.2.2 黄瓜叶片RNA的提取及RT-PCR检测 取黄瓜植株叶片0.1 g,放入液氮预冷的研钵中,加液氮研磨成粉末,利用TRIzol法提取植物叶片总RNA,用于cDNA合成。
反转录体系:Random6 2 μL、dNTP 1 μL、模板RNA 10 μL、RNase-freeH2O 1.5 μL混匀,70 ℃变性5 min,冰上放置2 min,再加入5×PrimeScript Buffer 4 μL、RNase Inhibitor(40 U·μL-1)0.5 μL、PrimeScriptRTase(200 U·μL-1)1 μL,混匀,总体积为20 μL。30 ℃预热10 min,42 ℃保温50 min,95 ℃保温5 min。
病毒检测采用MYSV通用引物MYSV-F/ MYSV-R扩增,扩增体系如下:PCR MasterMix 10 μL、上游引物1 μL、下游引物1 μL、ddH2O 7 μL、模板1 μL,总体积为20 μL。扩增条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃10 min。PCR扩增产物委托华大基因科技有限公司测序。
1.2.3 棕榈蓟马RNA的提取及RT-PCR检测 取单头棕榈蓟马置于1.5 mL无RNA酶的离心管中,加入10 μL TRIzol研磨,再加入240 μL TRIzol,混匀。室内放置5 min,加入50 μL氯仿混合物(氯仿∶异戊醇=24∶1),振荡器混匀3 min,将样品在4 ℃冷冻离心机离心10 min(12 000 r·min-1)。将上清液移至另一离心管中,加入同等量冷的异丙醇混匀,放置10 min,在4 ℃冷冻离心机离心10 min(12 000 r·min-1),弃上清,加入250 μL 75%预冷的乙醇洗涤,在4 ℃冷冻离心机离心5 min(12 000 r·min-1),弃乙醇,获得单头棕榈蓟马RNA样品。干燥处理后加入10 μL无菌水,进行下一步试验。反转录及病毒扩增方法同1.2.2。
1.2.4 PCR扩增产物回收、克隆和测序 用DNA回收试剂盒对目的片段进行回收,连接到载体pMD-18T上,转入大肠杆菌Trans1-T1 感受态细胞中,筛选阳性菌落,进行测序。
1.2.5 带毒棕榈蓟马数量对MYSV发病的影响 将具有3~4片真叶的健康黄瓜苗置于防虫网罩内隔离,分别将5、10、15、20头带毒棕榈蓟马接在黄瓜苗上,48 h后移除带毒棕榈蓟马。接种30 d后通过RT-PCR检测黄瓜感病株数,并计算感病株率。每个处理3次重复,每个重复10株黄瓜植株。所有处理均在(28±1)℃,相对湿度70%±5%,光周期16∶8(L∶D)条件下进行。
1.2.6 带毒棕榈蓟马取食时间对MYSV发病的影响
现如今,先天性心脏病诊断的金标准当属X线心血管造影(CAG),然而,CAG法是一种有创检查方法,且存在辐射剂量大、对比剂用量大等不足,对人体存在不同程度上的危害[2]。基于此,临床医师十分关注先天性心脏病诊断方法的研究。多层螺旋电子计算机断层扫描(CT),扫描速度快,时间及空间分辨率较高,在儿童先天性心脏病诊断中,具有较高的应用价值。近期有研究发现,CT扫描中对比剂肾病发病风险系数高达7%,需重视[3]。本文用到的270mgI/ml碘克沙醇是一种低碘浓度、低黏度、等渗透压对比剂,不仅可满足心脏儿童CT扫描要求,而且可降低造影剂肾病发生机率,值得推广。
将具有3~4片真叶的健康黄瓜苗置于防虫网罩内隔离,将5头带毒棕榈蓟马接在黄瓜苗上,分别取 食 0.5、1.0、2.0、4.0、6.0、12.0、24.0、48.0、96.0 h后移除带毒棕榈蓟马。接种30 d后通过RTPCR检测黄瓜感病株数,并计算感病株率。每个处理3次重复,每个重复10株黄瓜植株。所有处理均在(28±1)℃,相对湿度70%±5%,光周期16∶8(L∶D)条件下进行。
1.3数据分析
利用SPSS 17.0统计软件进行数据分析,采用单因素方差法进行方差分析,Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1黄瓜样品的病毒检测
对田间采集的30份疑似感病的黄瓜样品进行总RNA提取,利用引物MYSV-F/MYSV-R进行RT-PCR扩增,并经1.5%的琼脂凝胶电泳检测,结果表明,部分样品获得了大约500 bp的特异性片段(图1),与MYSV山东寿光分离物的检测结果一致(乔宁 等,2015),初步证明该温室内黄瓜植株感染了MYSV。

图1田间黄瓜样品病毒检测结果
用DNA回收试剂盒回收目的片段,克隆到载体pMD-18T上进行测序,结果显示,该目的片段由505个碱基组成。将测得的基因序列进行Blast检索,发现该分离物与GenBank中MYSV序列相似性达到99%以上,表明检测样品携带MYSV,检出率为50%。
通过提取田间采集的棕榈蓟马RNA,利用特异性引物MYSV-F/MYSV-R进行RT-PCR扩增,经1.5%的琼脂凝胶电泳检测,33.3%的棕榈蓟马体内检测出500 bp左右的目的片段(图2)。对目的片段进行回收、克隆和测序,结果显示该目的片段由505个碱基组成,Blast检索结果发现该分离物与GenBank中MYSV序列相似性达到99%以上,表明棕榈蓟马体内携带MYSV。
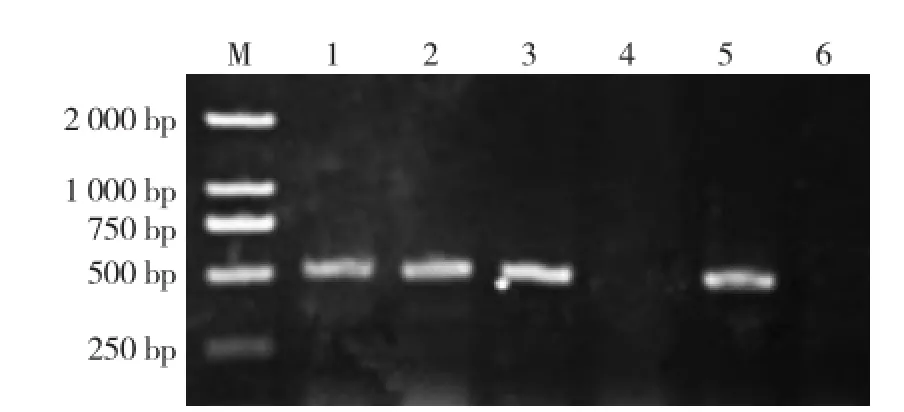
图2田间棕榈蓟马带毒检测结果
2.3棕榈蓟马数量和取食时间对MYSV感病株率的影响
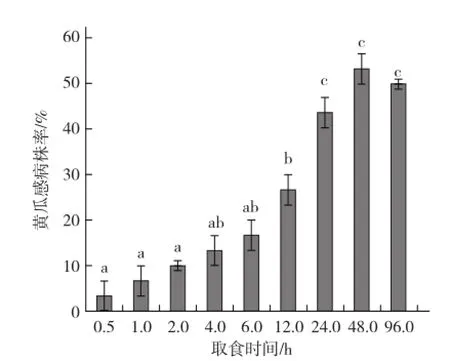
图3带毒棕榈蓟马取食时间对黄瓜感病株率的影响
在健康黄瓜苗上分别接1、5、10、15、20头带毒棕榈蓟马后,黄瓜植株MYSV感病株率分别为3.3%、16.7%、33.3%、46.7%、56.7%,表明黄瓜植株MYSV发病率随着棕榈蓟马数量的增加而 升高。
由图3可以看出,带毒棕榈蓟马成虫在健康黄瓜苗上取食0.5~96.0 h,黄瓜感病株率随着棕榈蓟马取食时间的延长呈上升趋势,各处理间存在明显差异;取食48.0 h时感病株率达到最高,为53.33%;取食96.0 h时,感病株率有所下降,但和48.0 h时无显著差异。
3 讨论
甜瓜黄斑病毒是近几年发现的1种番茄斑萎病毒属病毒,主要危害甜瓜等葫芦科作物。继在中国台湾(Chen et al.,2008)、海南(Gu et al.,2011)发生危害以来,现已在我国北方地区部分蔬菜产区出现(乔宁 等,2015)。笔者在济南董家温室黄瓜棚内证实了MYSV的发生,发病率高达50%,说明该病毒在山东境内有蔓延趋势,应加强对其监控。
甜瓜黄斑病毒主要通过棕榈蓟马以持久性增殖方式传播(Gu et al.,2011),笔者在样品采集的温室内发现了棕榈蓟马的暴发。通过对棕榈蓟马MYSV的特异性检测发现,33.3%的棕榈蓟马体内携带MYSV,表明棕榈蓟马是MYSV的携带者。室内试验表明,黄瓜植株MYSV感病株率随着带毒棕榈蓟马取食时间的延长和种群数量的增加而明显升高,加强对棕榈蓟马携带MYSV的监测将有利于预防、预测该病毒的暴发,减少其危害。当前生产中对甜瓜黄斑病毒还没有足够的认识,但随着设施蔬菜集约化生产的扩大,棕榈蓟马呈发生频繁、危害加重的趋势,甜瓜黄斑病毒势必会暴发,需要加强监控。有关棕榈蓟马如何获取和传播甜瓜黄斑病毒,以及影响有效传播的因素,将会在今后的试验中作进一步研究。
古勤生,吴会杰,彭斌,刘丽锋.2012.瓜类新病毒病害(三):甜瓜黄化斑点病.中国瓜菜,25(1):32-33.
乔宁,王兴翠,田素波,刘永光,姜会霞,李美芹,竺小平.2015. 黄瓜上甜瓜黄斑病毒寿光分离物的初步鉴定及序列分析.中国蔬菜,(7):25-28.
杨英华,陈青,廖富荣,陈红运,林石明,王建国.2011.番茄斑萎病毒属6种病毒的多重RT-PCR检测.植物检疫,25(6):25-29.
Bhunchoth A,Warin N,Chiemsombat P,Seepiban C,Wong yam S.2005.Molecular characterization ofMelon yellow spot virusinfecting cucubits in Thailand.BioThailand 2005 National Conference organized by National Center for Genetic Engineering and Biotechnology.
Chen T C,Lu Y Y,Cheng Y H.2008.Melon yellow spot virusin watermelon a first record from Taiwan.Plant Pathology,57:765.Gu Q S,Wu H J,Zhang X J.2011.Melon yellow spot virusidentified in China for the first time.Plant Pathology,25:7.
Kato K,Hanada K,Kameya-Iwaki M.2000.Melon yellow spot virus:a distinct species of the genusTospovirusisolated from melon.Phytopathology,90:422-426.
Takeuchi S,Okuda M,Hanada K.2001.Spotted wilt disease of cucumber(Cumumis sativus)caused byMelon yellow spot virus.Annals of the Phytopathological Society of Japan,67: 46-51.
Yeh S D,Lin Y C,Cheng Y H,Jih C L,Chen M J.1992.Identification of tomato spotted wilt-like virus on watermelon in Taiwan.Plant Disease,76:835-840.
Melon yellow spot virus(MYSV)Transmitted by Thrip palmi in Shandong
Dai Hui-jie1,2,Liu Jin2,Liu Yong-jie2,Qiao Ning2,Ma Jing-yu3,Zhang An-sheng4*
(1WeifangUniversityofScienceandTechnology,Shouguang262700,Shandong,China;2CollegeofPlantProtection,ShandongAgriculturalUniversity,Tai’an271018,Shandong,China;3JiningAcademyofAgriculturalSciences,Jining272100,Shandong,China;4InstituteofPlantProtection,ShandongAcademyofAgriculturalSciences,Jinan250100,Shandong,China)
Cucumber samples infected possibly byMelon yellow spot virus(MYSV) were found in Jinan,Shandong.A Reverse Transcript-PCR assay was performed with total RNA isolated from diseased samples by specific primers for MYSV,and amplified DNA fragments(500 bp)were obtained.After sequencing,we confirmed that the diseased samples were infected by MYSV.A Reverse Transcript-PCR assay was performed withThrip palmicollecting in the greenhouse,and the results showed that 33.3% ofThrip palmicarried MYSV,meaning thatThrip palmiwas vector of MYSV.MYSV incidence rate increased with viruliferousThrip palmipopulation increasing and feeding time extending.The results indicated that MYSV could be effectively transmitted byThrip palmi,and the prevention and control ofThrip palmiwas an effective measure for controlling MYSV in the fields.
Melon yellow spot virus;Thrip palmiKarny;Viral transmission
代惠洁,女,博士研究生,专业方向:昆虫生理生化,E-mail:climsion@126.com
*通讯作者(Corresponding author):张安盛,男,研究员,专业方向:蔬菜病虫害防治,E-mail:zhangansheng2003@163.com
2016-11-02;接受日期:2017-03-12
公益性行业(农业)科研专项(201303028),山东省农业重大应用技术创新项目
