当归水煎液对刀豆蛋白A诱导急性肝损伤小鼠的保护作用❋
2017-06-01马雅銮朱鏐娈王宪波张剑平
陈 芯,马雅銮,李 蕊,朱鏐娈,王宪波,张剑平△
(1.北京中医药大学基础医学院,北京 100029;2.中国中医科学院中医基础理论研究所,北京 100700;3.首都医科大学附属北京地坛医院传染病研究所,北京 100015;4.新发突发传染病研究北京市重点实验室, 北京 100015; 5.首都医科大学附属北京地坛医院中西医结合中心,北京 100015)
【实验研究】
当归水煎液对刀豆蛋白A诱导急性肝损伤小鼠的保护作用❋
陈 芯1,马雅銮2,李 蕊3,4,朱鏐娈3,4,王宪波5,张剑平3,4△
(1.北京中医药大学基础医学院,北京 100029;2.中国中医科学院中医基础理论研究所,北京 100700;3.首都医科大学附属北京地坛医院传染病研究所,北京 100015;4.新发突发传染病研究北京市重点实验室, 北京 100015; 5.首都医科大学附属北京地坛医院中西医结合中心,北京 100015)
目的:研究当归水煎液对刀豆蛋白A(concanavalin A, ConA)诱导小鼠急性肝损伤的保护作用。方法:6~8周龄C57BL/6雄性小鼠,采用目内眦静脉注射ConA方法制备急性肝损伤小鼠致死模型,同时给予当归水煎液口服灌胃,观察小鼠生存率;制备急性肝损伤非致死模型,10 h后检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)水平并进行病理染色,3 h、10 h后采用流式CBA(Cytometric Bead Array, CBA)方法,检测血清细胞因子水平,造模3 h后采用实时定量PCR检测肝脏诱导型一氧化氮合成酶(iNOS)mRNA表达水平,造模6 h后检测脾脏IFN-γmRNA表达水平。结果:与ConA模型组比较,给予当归水煎液治疗后生存率显著升高,肝组织病理损伤减轻,血清ALT、AST水平降低。当归水煎液治疗后血清炎性细胞因子IL-12、IL-6和IFN-γ降低,肝脏iNOS mRNA表达水平降低,但对脾脏IFN-γ mRNA表达水平无明显作用。结论:当归水煎液对ConA诱导急性肝损伤小鼠具有抗炎和保肝作用。
当归水煎液;刀豆蛋白A;急性肝损伤;细胞因子
急性肝损伤是人类常见疾病之一。急性肝损伤模型是现代研究肝脏疾病机理的重要工具,其模型种类较多,主要有四氯化碳、D-半乳糖胺、由卡介苗加脂多糖、ConA等[1]。目前应用最广泛的是由Tiegs等[2]在1992年应用ConA诱导的小鼠特异性肝损伤模型。该模型是由多种免疫细胞介导的炎症反应,它能较好地模拟人类自身免疫性肝炎、病毒性肝炎等免疫性肝损伤的特征和病理机制。该模型在一定范围内呈剂量依赖性,在0.15 mg/kg至30 mg/kg范围内,血清转氨酶水平随剂量的增加而升高,用量大于20 mg/kg以上时8 h有小鼠死亡。肝组织学显示,大量淋巴细胞和单核细胞浸润,并出现不同程度的坏死,同时分泌大量炎性细胞因子如TNF-α、IFN-γ、IL-6、IL-12等[3-4]。
当归(Angelica sinensis)为伞形科当归属植物的干燥根,具有补血调经、活血止痛、润肠通便之功效,多用于治疗血虚诸证、月经不调、跌打损伤、风湿痹痛、肠燥便秘等病症[5-7]。近年来,随着对当归的深入研究发现,当归对四氯化碳所致的动物药物性急性肝损伤具有保护作用[8]。孙丽霞[9]等发现,当归补血汤对免疫性肝损伤大鼠模型具有保护作用,其机制可能与抑制过氧化物反应及抗自由基损伤有关。本课题组在前期工作中采用治疗肝损伤的经验方解毒凉血方,发现其能显著提高ConA小鼠急性肝损伤模型的生存率,降低血清转氨酶水平。由于当归是解毒凉血方的主要单药,因此研采用ConA小鼠急性肝损伤模型给予当归水煎液灌胃治疗,通过观察小鼠生存率,检测肝功能水平和炎性细胞因子分泌,利用现代免疫学理论,探讨当归水煎液对ConA急性肝损伤小鼠的保护作用和机制。
1 材料与方法
1.1 中药的制备
中药的标准剂量参考全国统编《中药学》第2版[10]教材。小鼠用药剂量以70 kg成人的体表面积换算,小鼠用药量是成人每公斤体质量的9.1倍,本实验小鼠用药量按成人每公斤体质量的10倍换算[11]。当归6 g,购自北京同仁堂前门总店,按传统方法将当归用蒸馏水浸泡,武火煮沸,文火煎2次,去渣合并浓缩至75 ml,当归水煎液浓度为0.08 g/ml分装,-20℃保存备用。
1.2 试剂与主要仪器
小鼠细胞因子CBA试剂盒购于美国BD公司,ALT、AST检测试剂盒购于四川麦克生物科技股份有限公司,720全自动生化分析仪购于日本日立公司,FACS Callibur流式细胞仪购于美国BD公司。RNA提取试剂及实时荧光定量PCR探针GAPDH、IFN-γ、iNOS等均购于Life Technology公司,逆转录试剂盒和PCR试剂盒购于ABI公司,ConA购于SIGMA公司。
1.3 实验动物
野生型C57BL/6雄性小鼠,6~8周龄,体质量(20±2)g,购自中国医学科学院医学实验动物研究所(许可证号SCXK(京)2014-0004),并按照动物保护相关法规饲养于该研究所SPF级实验室。
1.4 模型制备
无菌磷酸盐缓冲液(PBS)配制6 mg/mL ConA储液。将小鼠吸入麻醉10 s,内眦静脉注射100 μL/只,ConA 30 mg/kg剂量制备急性肝衰竭小鼠致死模型,15 mg/kg剂量制备急性肝损伤小鼠非致死模型。主要分为3部分,一是生存率。采用致死模型,56只小鼠随机分为2组各28只,ConA模型组和当归水煎液组造模的同时分别给予250 μL灌胃双蒸水或当归水煎液1次;二是肝功能检测。采用非致死模型,24只小鼠随机分为正常组、ConA模型组、当归水煎液组各8只,造模10 h后取外周血;三是细胞因子检测。造模方法同上,18只小鼠随机分为3组各6只,造模后3 h、10 h取外周血。肝脏iNOS、脾脏IFN-γmRNA表达检测,造模方法同上,于造模3 h后取肝脏、造模后10 h取脾脏。
1.5 生存率
从模型小鼠造模、灌胃后计时开始,至小鼠死亡计时结束,连续观察96 h。注射造模药物后96 h未死亡的小鼠计为生存,记录动物死亡时间点,并绘制生存曲线。
1.6 肝功能检测
制备ConA非致死模型后10 h麻醉小鼠取外周血,2000 r/min离心15 min并分离血清,采用全自动生化分析仪检测血清ALT和AST水平。
1.7 病理染色
制备ConA非致死模型10 h后取肝脏,置于10%中性缓冲福尔马林固定液中,经脱水、包埋、切片、铺片、HE染色、封片干燥后用光学显微镜观察。
1.8 细胞因子检测
制备ConA非致死模型后3 h、10 h分别麻醉小鼠取外周血,2000 r/min离心15 min分离血清,细胞因子采用小鼠细胞因子CBA试剂盒测定,按照说明书进行流式检测。
1.9 实时定量PCR检测
制备ConA非致死模型,3 h后分离肝脏,TRIzol法提取总RNA,按照试剂盒说明书将RNA逆转录为cDNA,采用实时定量PCR方法检测肝细胞iNOS表达水平,使用ABI SDS7500软件分析结果。造模后10 h分离脾脏,检测IFN-γ表达水平。
1.10 统计学方法
采用SPSS 19.0软件进行统计分析,数据呈正态分布的计量资料采用t检验,生存曲线采用Kaplan-Meier统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 当归水煎液对急性肝衰竭小鼠生存率影响
图1显示,造模后观察96 h生存率并持续观察小鼠状态,发现ConA模型与对正常小鼠比较出现活动减少、呼吸加快、皮肤发凉、饮食减少、饮水减少等病态特征。造模4~6 h后2组小鼠均开始死亡,24 h内死亡较集中。但当归水煎液组的小鼠明显比模型组死亡缓慢,之后死亡频率减缓,96 h后趋于稳定,且当归水煎液组存活的小鼠状态明显好于模型组。经Kaplan-Meier统计分析,当归水煎液组与模型组比较(P=0.020),ConA模型组的生存率为21%,当归水煎液组生存率为52%,提示当归水煎液可提高ConA诱导急性肝损伤小鼠的生存率。

图1 当归水煎液对ConA急性肝衰竭小鼠生存率的影响注:*P<0.05
2.2 当归水煎液对急性肝损伤小鼠血清转氨酶的影响
表1显示,为进一步评价当归水煎液的疗效,我们检测各组血清转氨酶的水平。ConA模型组与正常组比较ALT显著升高(P=0.0005),当归水煎液组与ConA模型组比较ALT显著降低(P=0.0068);ConA模型组与正常组比较AST显著升高(P=0.0004),当归水煎液组与ConA模型组比较AST显著降低(P=0.0204),提示当归水煎液能减轻小鼠肝细胞损伤。

表1 当归水煎液对ConA急性肝损伤小鼠血清ALT、AST水平的影响
注:**P<0.001,*P<0.05
2.3 当归水煎液对肝脏组织的影响
图2显示,正常组小鼠在光学显微镜下观察可见,肝脏肝小叶结构完整清晰,肝细胞结构完好,大小均匀排列整齐,有明显分界,无炎性细胞浸润,未见肿胀及坏死,染色正常。ConA模型组小鼠肝脏大量白细胞浸润,肝细胞形成大片坏死灶,当归水煎液组小鼠肝脏白细胞浸润减少,坏死灶面积减小,提示当归水煎液可减轻小鼠肝组织损伤。
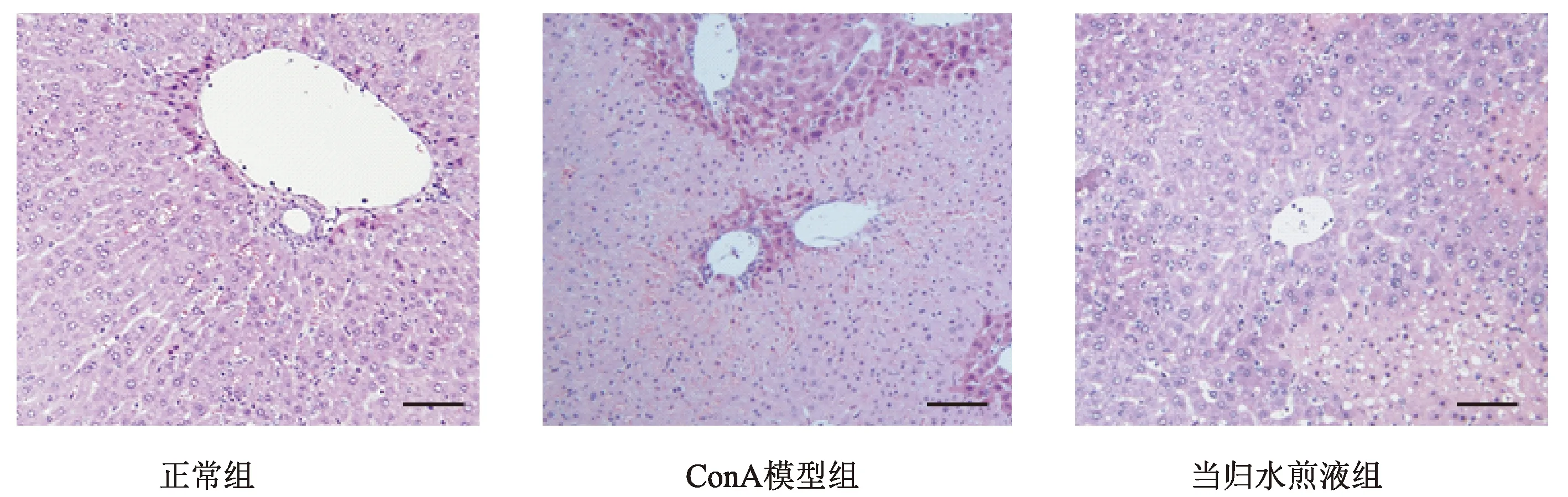
图2 当归水煎液对ConA急性肝损伤小鼠肝组织的影响(标尺50 μm, HE×200)
2.4 当归水煎液对炎性细胞因子分泌的影响
表2显示,由于大量炎性细胞因子分泌ConA诱导急性肝损伤的重要机制,因此我们检测当归水煎液对多种炎性细胞因子分泌的影响。造模后3 h、10 h取外周血,分离血清并检测细胞因子水平。模型组与正常组比较,3 h血清中IL-12、IL-6升高,10 h 血清中IFN-γ升高。当归水煎液组与ConA模型组比较,3 h血清中IL-12、IL-6炎性细胞因子显著下降(P=0.049,P=0.03),10 h血清中IFN-γ炎性细胞因子显著下降(P=0.0045),差异有统计学意义。3 h血清中TNF-α、MCP-1炎性细胞因子虽然下降,但差异有统计学意义(P>0.05),提示当归水煎液能有效降低早期血清IL-6、IL-12及晚期IFN-γ水平。

表2 当归水煎液对急性肝损伤小鼠炎性细胞因子分泌的影响
注:**P<0.01;*P<0.05
2.5 当归水煎液对脾脏IFN-γmRNA水平表达的影响
图3显示,由于CBA结果显示当归水煎液能降低晚期血清中IFN-γ分泌水平,故造模10 h后取脾脏提取mRNA,实时定量PCR检测IFN-γ表达,发现模型组与正常组比较,脾脏IFN-γ mRNA表达升高(P=0.014),当归水煎液不能降低脾脏IFN-γ mRNA的表达(P=0.45),提示当归的抗炎作用不是直接作用于淋巴细胞。
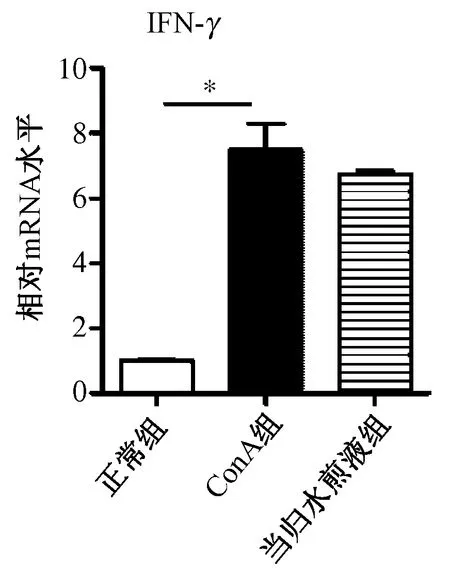
图3 当归水煎液对脾脏IFN-γmRNA表达的影响 注:*P<0.05
2.6 当归水煎液对肝脏iNOS mRNA水平表达的影响
图4显示,由于当归水煎液的作用靶点不是淋巴细胞,因此我们验证药物的作用是否作用于天然免疫细胞。iNOS与机体炎症损伤程度呈正相关,并且给CBA结果显示,当归水煎液能降低早期血清中多种细胞因子水平,故造模3 h后取肝脏提取mRNA,实时定量PCR检测iNOS表达。ConA模型组与正常组比较,肝脏iNOS表达升高(P=0.0023);与ConA模型组比较,当归水煎液组可降低肝脏iNOS表达(P=0.038),提示当归水煎液抑制巨噬细胞活性。

图4 当归水煎液对肝脏iNOS mRNA表达的影响 注:**P<0.05, *P<0.05
3 讨论
急性肝损伤是由各种肝脏疾病所导致的病变结果[12],其发病机制复杂、病因众多,但以免疫性损伤较为多见[13-14]。免疫性肝损伤的共同机制主要有两方面,一方面T淋巴细胞增殖活化,并被募集浸润肝脏,导致肝损伤;另一方面多种免疫细胞释放大量炎性细胞因子,加剧肝细胞损伤[15]。
中医认为肝损伤属于“胁痛”“黄疸”“积聚”“疫毒”等范畴,其病因主要有湿、热、瘀、毒。历代医家对肝病治法甚多,大致可归纳出肝病治疗原则为疏通气血、清热解毒,故活血行气化瘀、清热解毒类中药是临床治疗肝损伤的主要药物[16]。当归入肝经,具有行气活血的作用,是临床常用活血、调经止痛、抗炎药。本研究结果表明,当归水煎液可提高ConA导致急性肝损伤小鼠的生存率,降低血清ALT、AST水平,改善肝组织病理损伤和白细胞浸润,说明其具有保肝作用。
本研究在此基础上进一步探讨了当归水煎液的保肝作用机理。当归水煎液能降低血清炎性细胞因子IL-12、IL-6、IFN-γ水平,IL-12等促炎性细胞因子在ConA诱导的肝损伤中发挥关键作用。因此本研究结果提示,当归水煎液通过抑制炎症反应发挥保肝作用。IL-12主要来源于单核/巨噬细胞,能进一步启动Th1免疫应答,同时促进分泌IFN-γ,进而炎症损伤开始循环放大。动物实验显示,给予小鼠IL-12抗体干预后,能显著降低ConA诱导小鼠肝损伤血清IFN-γ、IL-6等细胞因子水平[17],因此IL-12是介导ConA模型炎症损伤的关键细胞因子。IL-6主要由单核细胞和巨噬细胞产生并参与免疫防御过程,同时可介导炎症反应。IL-6在ConA模型中发挥双向作用,在肝损伤早期发挥保护作用,晚期发挥促炎作用[18]。本研究中,给予当归水煎液治疗后3 h,血清IL-12和IL-6降低,说明当归水煎液在早期降低炎性细胞因子的分泌,抑制炎症反应的循环放大。
IFN-γ主要由活化的T细胞产生,IL-12可诱导其表达,具有活化单核细胞、巨噬细胞并促进其分泌IL-1、IL-6、TNF-α等作用,还能活化中性粒细胞,刺激血管内皮细胞和白细胞产生黏附分子。而在ConA诱导的肝损伤模型中,脾中的T淋巴细胞增殖活化成为效应T细胞,经趋化因子和黏附分子的作用,被肝窦内皮细胞募集至肝窦和肝小叶部位[19-20],浸润的效应T细胞持续向Th1型CD4+T细胞分化,分泌IFN-γ等细胞因子,启动Th1免疫应答[19-21]。文献表明,与野生型小鼠比较,IFN-γ基因敲除小鼠给予ConA注射后生存率明显升高[22]。本实验结果与模型组比较,当归水煎液组虽然能降低血清IFN-γ水平,但脾脏IFN-γ mRNA水平并未降低,提示当归水煎液并不直接作用于淋巴细胞。
巨噬细胞是天然免疫应答中的重要成员,具有吞噬、杀伤、递呈抗原、分泌生物活性物质等多种免疫功能,是机体非特异性免疫的重要组成部分[23-24]。在ConA诱导的急性肝损伤模型中,受损的细胞释放出各种损伤相关模式分子,导致巨噬细胞活化。特异性清除巨噬细胞能减轻肝损伤,说明巨噬细胞能发挥关键作用。活化的巨噬细胞中合成的 iNOS在肝损伤时表达上调,合成一氧化氮(NO)造成肝组织损伤,继而导致肝实质细胞的凋亡、坏死。本研究给予当归水煎液治疗后,肝脏iNOS mRNA表达水平降低,提示当归水煎液可抑制巨噬细胞活化。
综上所述,本研究中当归水煎液可减轻ConA诱导小鼠肝损伤,其机制可能是通过降低炎性细胞因子的分泌,并抑制作用于天然免疫的巨噬细胞活化,从而阻抑炎症损伤进一步循环放大有关。
[1] 张琪, 陈辉, 彭顺利, 等. 肝损伤动物模型制备研究进展[J]. 吉林医药学院学报, 2011, 32(4): 216-220.
[2] G. TIEGS, J. HENTSCHEL, A. WENDEL. A T Cell-dependent Experimental Liver Injury in Mice Inducible by Concanavalin A[J]. The Journal Clinical Investigation,1992,90(1):196-203.
[3] WATANABE Y, MORITA M, AKAIKE T. Concanavalin A induced perforin-mediated but not Fas-mediated hepatic injury[J]. Hepatology, 1996, 24(3):702-710.
[4] 江海涛, 任源浩, 吴雨龙, 等. 不同剂量刀豆蛋白A诱导小鼠肝脏急性员伤的实验研究[J]. 现代预防医学, 2014, 41(12) :2220-2223.
[5] WANG Q, DING F, ZHU N, et al. Determination of the compositions of polysaccharides from Chinese herbs by capillary zone electrophoresis with amperometric detection[J]. Biomedical chromatography, 2003, 17(7):483-488.
[6] 国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社, 2010:170.
[7] 刘医辉, 杨世英, 马伟林, 等. 当归药理作用的研究进展[J]. 中国当代医药, 2014, 21(22):192-196.
[8] 宁康健,张子明,司阳洋,等. 当归对四氯化碳肝损伤的保护作用的电镜观察[J].中国实验方剂学杂志,2009,15(12):68-70.
[9] 孙丽霞, 方南元, 周玲玲, 等.当归补血汤及拆方对大鼠免疫性肝损伤的治疗作用[J].南京中医药大学学报,2014,30(2):150-152.
[10] 高学敏.中药学[M]. 2版. 北京:中国中医药出版社, 2007:234.
[11] 施新猷. 医学实验动物学[M]. 陕西: 陕西科学技术出版社, 1989:368.
[12] 黄娜娜, 孙蓉. 适宜于中药抗急性肝损伤活性发现与药效评价的动物模型应用概况[J]. 中国药物警戒,2015, 12(11):669-673.
[13] 申弘, 聂红明, 叶青艳, 等. 免疫性肝损伤动物模型研究进展[J]. Chinese Hepatology, 2014, 19(10):790-796.
[14] 凌银婵, 刘海燕, 黄巨恩, 等. 急性肝损伤实验动物模型的研究进展[J]. 解剖学杂志, 2012, 35:389-391.
[15] KOERBER K, SASS G, KIEMER AK, et al. In vivo regulation of inducible NO synthase in immune-mediated liver injury in mice[J]. Hepatology, 2002, 36(5):1061-1069.
[16] 黄自平, 梁广寰, 阮幼冰, 等. 当归对大鼠慢性CCl4肝损伤时肝脏超微结构的影响[J]. 中西医结合肝病杂志, 1996, 6(1):16-24.
[17] ZIMMERMANN HW,TRAUTWEIN C,TACKE F. Functional role of monocytes and macrophages for the inflammatory response in acute liver injury[J]. Frontiers in Physiology, 2012,3: 56.
[18] YOH-ICHI TAGAWA, PATRICK MATTYS, HUBERTINE HEREMANS. Bimodal role of endogenous interleukin-6 in concanavalin A-induced hepatitis in mice[J]. Journal of leukocyte Biology, 2000, 67:90-96.
[19] TIEGS G, HENTSCHEL J, WENDEL A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A[J]. Journal of clinical investigation, 1992, 90(1): 196-203.
[20] EKSTEEN B, AFFORD SC, WIGMORE SJ, et al. Immune-mediated liver injury[J]. Seminars in liver disease, 2007,27(4): 351-366.
[21] CHANG CP, YANG MC, LEI HY. Concanavalin A/IFN-gamma triggers autophagy-related necrotic hepatocyte death through IRGM1-mediated lysosomal membrane disruption[J]. Plos one, 2011, 6(12): e28323.
[22] CHIH-PENG CHANG, MING-CHEN YANG, HUAN-YAO LEI. Concanavlain A/IFN-Gamma Triggers Autophagy-Related Necrotic Hepatocyte Death through IRGM1-Mediated Lysosomal Membrane Disruption[J]. PLOS ONE, 2011, 6(12):1-9.
[23] BOWDISH DM, LOFFREDO MS, MUKHOPADHYAY S, et al. Macrophage receptors implicated in the “adaptive” form of innate immunity[J]. Microbes and infection, 2007, 9(14-15):1680-1687.
[24] BELL LN, CHALASANI N. Epidemiology of idiosyncratic drug-induced liver injury [J]. Seminars in liver disease, 2009, 29(4):337-347.
Protective Effect of Angelic Decoction on Acute Liver Injury Mice Induced by Concanavalin A
CHEN Xin1, MA Ya-luan2, LI Rui3,4, ZHU Liu-luan3,4, WANG Xian-bo5, ZHANG Jian-ping3,4△
(1.SchoolofBasicMedicalSciences,BeijingUniversityofChineseMedicine,Beijing100029,China;2.InstituteofBasicTheory,ChinaAcademyofChineseMedicine,Beijing100700,China; 3.InstituteofInfectiousDiseases,BeijingDitanHospital,CapitalMedicalUniversity,Beijing10015,China; 4.BeijingKeyLaboratoryofEmergingInfectiousDisease,Beijing100015,China; 5.CenterofIntegrativeMedicine,BeijingDitanHospital,CapitalMedicalUniversity,Beijing100015,China)
Objective: To investigate the protective effect of Angelic decoction on acute liver injury mice induced by Concanavalin A (ConA). Methods: Preparing acute liver injury mice model, 6-8 weeks old C57BL/6 male mice were adopted by intravenous injection of ConA. The survival rate was observed on the lethal model. For the sub-lethal model, 10hour later, the mice were sacrificed to measure the levels of serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST)and liver HE staining; at 3h and 10h,the serum cytokines were measured by Cytometric Bead Array;the liver inducible nitric oxide synthase was measured at 3h and the spleen interferon γ was measured at 10h by real-time PCR. Results: Compared with normal mice, after giving treatment of Angelic decoction, the survival rate of acute liver injury model was increased remarkable, the liver tissue injury were reduced and the serum levels of ALT, AST were decreased, the serum inflammatory cytokines IL-12,IL-6 and IFN-γ were decreased, the liver iNOS mRNA expression were decreased, but had no effect on the spleen IFN-γ mRNA expression. Conclusion: Angelic decoction has anti-inflammatory and liver protection effect on acute liver injury induced by ConA in mice.
Angelic decoction; Concanavalin A; Acute liver injury; Cytokine
国家自然科学基金面上项目(81273743)-解毒凉血方阻抑IL-12家族生成治疗急性肝衰竭的机制研究
陈 芯(1990-),女,辽宁大连人,在读硕士,从事中西医结合基础免疫研究。
△通讯作者:张剑平(1959-),女,研究员,医学硕士,硕士研究生导师,从事中西医结合基础免疫研究,Tel:010-84322622,E-mail:zhjp2358@126.com。
R285.5
B
1006-3250(2017)04-0492-04
2016-09-12
