水牛波形蛋白基因克隆及其表达分析
2017-05-30濮黎萍候振徐壮壮陈富美王焕景黄凤玲张明
濮黎萍 候振 徐壮壮 陈富美 王焕景 黄凤玲 张明
摘要:【目的】克隆水牛波形蛋白(VIM)基因,并明确VIM因在水牛成熟卵母细胞(MII期)和早期胚胎(2-细胞阶段)中的表达情况,为研究VIM在卵母细胞成熟及附植前胚胎发育中的作用机理打下基础。【方法】根据GenBank上已公布的水牛VIM基因mRNA序列设计引物,采用RT-PCR克隆水牛VIM因,利用在线软件程序对克隆获得的水牛VIM基因进行生物信息学分析,同时以细胞免疫荧光试验检测VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中的表达情况。【结果】水牛VIM基因长度为1469 bp,其编码区长度1401 bp,编码466个氨基酸。水牛VIM基因序列与人类、黑猩猩、食蟹猴、家犬、马和牛的VIM基因序列具有高度的同源性,分别为93%、93%、93%、94%、94%和99%;基于VIM基因序列构建的系统发育进化树也显示水牛与牛的亲缘关系最近。水牛VIM的分子量为53.73 kD,理论等电点(pI)5.05,主要在线粒体中表达,稳定性差(不稳定系数53.65),具有较强的亲水性,无跨膜结构,不属于分泌型蛋白,其蛋白结构以α-螺旋为主。VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中均有表达,且在成熟卵母细胞中的表达量明显高于早期胚胎。【结论】水牛VIM基因编码序列具有较高的保守性,且在水牛成熟卵母细胞(MII期)中的表达量明显高于早期胚胎(2-细胞阶段)。
关键词:水牛;波形蛋白(VIM);基因克隆;生物信息学分析;表达分析
中图分类号:S823.83 文獻标志码:A 文章编号:2095-1191(2017)12-2266-07
0引言
【研究意义】波形蛋白(Vimentin,VIM)与结蛋白、角蛋白组成中间纤维,而中间纤维又与微管、微丝共同构成细胞骨架。VIM主要存在于中胚层来源的细胞中(Coulombe and Wong,2004),由非螺旋的氨基端头部、螺旋杆状区及非螺旋的羧基端尾部组成(Fuchs and Weber,1994),其主要功能包括维持细胞完整性、参与调节基因组DNA表达(Tolstonog et al.,2001;Corbi et al.,2010)、参与细胞信号转导(Perlson et a1.,2005;Li et al.,2006)、影响细胞迁移和黏附(Singh et al.,2003;Zhao et al.,2010)及参与调控细胞凋亡(Byun et al.,2001;Yang et al.,2005;Ise et al.,2012)等。因此,深入研究水牛VIM基因对揭示其在水牛卵母细胞成熟及附植前胚胎发育中的作用机理具有重要意义。【前人研究进展】目前,针对人类VIM基因的研究较多,编码人类VIM的基因位于染色体10p13上,编码区全长1848 bp,编码464个氨基酸,所翻译蛋白质的相对分子量约57.00 kD,其在进化过程中高度保守(Ivaska et al.,2007)。Tol-stonog等(2001)研究发现,VIM可与卫星DNA、线粒体DNANt端粒DNA等DNA结构相互作用;Moisan和Girard(2006)研究表明,VIM基因在人类自发凋亡的中性粒细胞表面表达,进一步佐证VIM与细胞凋亡相关;BhaRacharya等(2009)研究证实,在内皮细胞中VIM与黏附斑的形成有关;Kim等(2010)发现VIM对HEK-293和3T3细胞在胶原中的延伸及迁移起重要作用;Liu等(2010)研究发现,在缺氧情况下VIM可通过激活PAKl信号通路促使自身磷酸化并发生重排,从而增加细胞的稳定性;Ise等(2012)研究表明,VIM以受体形式与凋亡细胞中的配体结合,从而致使凋亡细胞被包裹及清除;奈日乐(2015)研究发现,VIM通过影响内蒙古绒山羊毛囊外根鞘而参与皮肤毛囊周期性生长的调节;邵晓婷等(2017)研究证实,VIM可促进PCI2细胞的神经分化。【本研究切入点】水牛具有耐粗饲、易饲养等优点,但其繁殖性能较差。VIM在组织细胞中不仅作为重要的骨架蛋白,还能通过不同方式调控多项细胞功能,但至今未见有关水牛VIM的研究报道。【拟解决的关键问题】克隆水牛VIM基因并对其基因序列进行生物信息学分析,同时检测VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中的表达情况,旨在为研究VIM在卵母细胞成熟及附植前胚胎发育中的作用机理打下基础。
1材料与方法
1.1试验材料
水牛卵巢采自广西南宁市肉联食品加工厂。TRIzol购自Invitrogen公司,PrimeScriptTMRT reagentKit with gDNA Eraser、pMDl8-T载体、Cloning Kit、大肠杆菌DH5a感受态细胞、胶回收试剂盒等购自TaKaRa公司,其他生化试剂均为进口分析纯。
1.2引物设计与合成
根据GenBank)2已公布的水牛VIM基因mRNA序列(XM 006052364.1),通过Primer 5.0设计一对引物(5-CAGTCCACCGCCACCCTCTGCAG-3′和5′-CTTCTTGCTGGTAGTATTTTGCTG-3′),引物由深圳华大基因科技有限公司合成。
1.3总RNA提取
采用TRizol法提取水牛卵巢组织总RNA,利用紫外分光光度计检测总RNA含量及其完整性。同时去除基因组DNA,反应体系10.0μL,即2.0μL5×gDNA Eraser Buffer,1.0μLgDNA Eraser,1.0μg总RNA,6.0μLRNase Free dH20。反应条件为42℃2 min。
1.4反转录合成cDNA
反应体系20.0μL:10.0μL去除基因组DNA的RNA模板,1.0μL PrimeScriptRTEnzyme Mix I,4.0μL RT Primer Mix,4.0μL 5×PrimeScript Buffer 2,1.0μL RNase Free dH2O。反转录程序:37℃15 min,85℃5 s。
1.5 PCR扩增
反应体系20.0μL:2×Taq PCR Master Mix 10.0μL,上、下游引物各0.5μL,eDNA 2.0μL,ddH2O 7.0μL。扩增程序:98℃预变性3 min;98℃5 s,58℃15 s,72℃20 s,进行34个循环;最后72℃延伸20~30 min。
1.6 PCR产物连接及测序
采用胶回收试剂盒对琼脂糖凝胶电泳分离获得的目的片段进行回收和纯化,然后将目的片段克隆至pMD18-T载体,并转化大肠杆菌DH5a感受态细胞,将菌液涂布于含Amp+的固体培养基上,37℃培养16 h后挑取单克隆菌落,并接种至含Amp+的液体培养基中培养,经PCR检测,阳性菌液送至深圳华大基因科技有限公司进行测序。
1.7生物信息学分析
使用在线软件程序对克隆获得的水牛VIM基因序列进行同源性比对及构建系统发育进化树,并预测其编码蛋白的结构、信号肽、蛋白定位、亲/疏水性及其功能结构域。
1.8表达分析
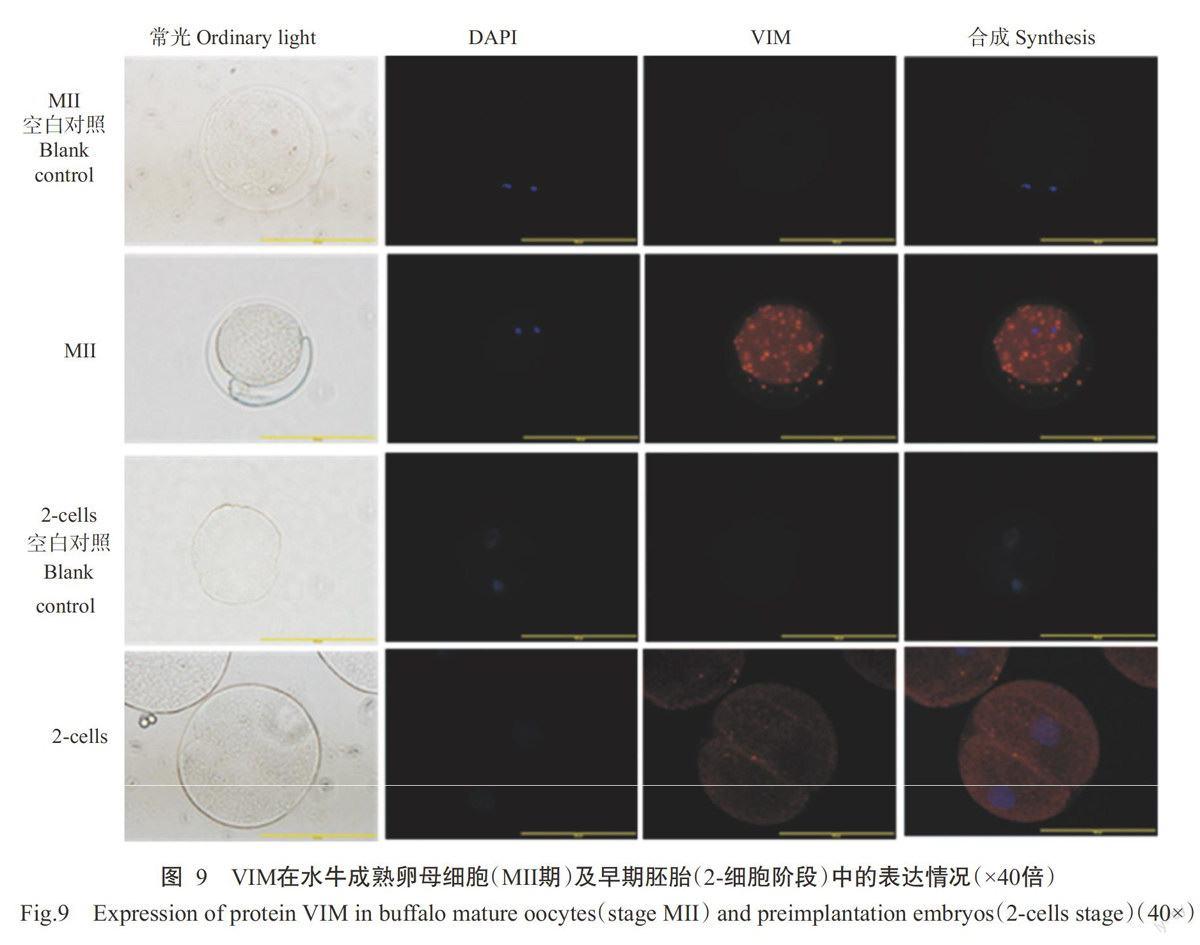
水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)的获得分别参照王彩玲等(2015)、李敏玲等(2016)的方法。采用细胞免疫荧光试验检测VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中的表达情况,将MII期的卵母细胞及2-细胞期的早期胚胎在PBS中清洗3遍,4%多聚甲醛固定30 min,PBS洗3遍,以含1%Triton X-100的PBS透膜20 min,PBS清洗3遍后用含1%BSA的PBS封闭1 h;加入一抗(含1%BSA的PBS,1:200)后4℃下孵育过夜,PBS清洗3遍,每次2 min;加入二抗(含1%BSA的PBS,1:500)并室温孵育1 h,PBS清洗3遍,每次2 min;使用抗荧光淬灭剂(含DAPI)封片,荧光显微镜下检测拍照。
2结果与分析
2.1水牛VIM基因的克隆、鉴定及测序结果
将PCR扩增产物进行琼脂糖凝胶电泳检测,结果发现在1500 bp附近处出现清晰的目的条带(图1),与预期结果相符。菌液PCR鉴定也得到相应的目的条带,可初步判定为阳性克隆菌液。测序结果表明,克隆获得的目的片段(水牛VIM基因)长度为1469 bp,其中编码区长1401 bp,将其提交Gen-Bank数据库,登录号为MF459044。
2.2同源性比对分析结果
将克隆获得的水牛VIM基因序列与其他物种的VIM基因序列进行BLAST比对分析,结果发现该基因序列与人类(NM 003380.3)、黑猩猩(NM001009148.2)、食蟹猴(NM 001284705.1)、家犬(NM001287023.1)、马(NM 001243145.1)和牛(NM 173969.3)的VIM基因序列具有很高的同源性,分别为93%、93%、93%、94%、94%和99%。对VIM基因的推导氨基酸序列进行对比分析,结果发现其同源性更高,与牛的同源性100%,人类的98%、家犬的98%、黑猩猩的97%、食蟹猴的97%、马的97%,说明VIM在物种进化过程中具有高度的保守性。
2.3系统发育进化树分析结果
利用MEGA 7.0构建水牛VIM基因序列与NCBI已公布的牛、野鸡(NM 001048076.2)、家犬、大鼠(NM 031140.1)、人类、小鼠(NM 011701.4)、安大略鲑(NM 001124729.1)、马及虹鳟鱼(NM 001124729.1)等物种VIM基因序列的系统发育进化树(图2),结果发现水牛与牛的亲缘关系最近,其次是马和家犬,而与安大略鲑和虹鳟鱼的亲缘关系较远。
2.4生物信息学分析结果
2.4.1基本理化性质利用NCBI的ORF finder将克隆得到的水牛VIM基因序列翻译成相应的氨基酸序列,结果发现其编码466个氨基酸(图3)。利用Ex-PASy ProtParam程序预测得到水牛VIM的分子量为53.73 kD,分子式为C2298H3736N686O773S12,理论等电点(pI)5.05,负电荷[天冬氨酸(Asp)+谷氨酸(Glu)]氨基酸84个,正电荷[精氨酸(Arg)+赖氨酸(Lys)]氨基酸65个,其中以高氨酸(Leu)、Glu和丝氨酸(ser)含量较高,分别为11.8%、11.6%和8.6%。该蛋白不稳定系数53.65,属于不稳定蛋白。
2.4.2亚细胞定位、跨膜性、信号肽和亲/疏水性以PSORTⅡ程序预测水牛VIM的亚细胞定位情况,发现该蛋白主要定位于线粒体(82.6%)、细胞核(8.7%)和细胞质(8.7%);利用TMHMM 2.0預测分析蛋白跨膜结构,发现水牛VIM无跨膜结构,不属于跨膜蛋白(图4);采用Signal P4.1 Server预测水牛VIM信号肽,发现该蛋白不存在信号肽,不属于分泌型蛋白(图5);利用ExPASy ProtScale预测其亲/疏水性,结果发现该蛋白具有较强的亲水性,图6中红色框内为亲水区域。
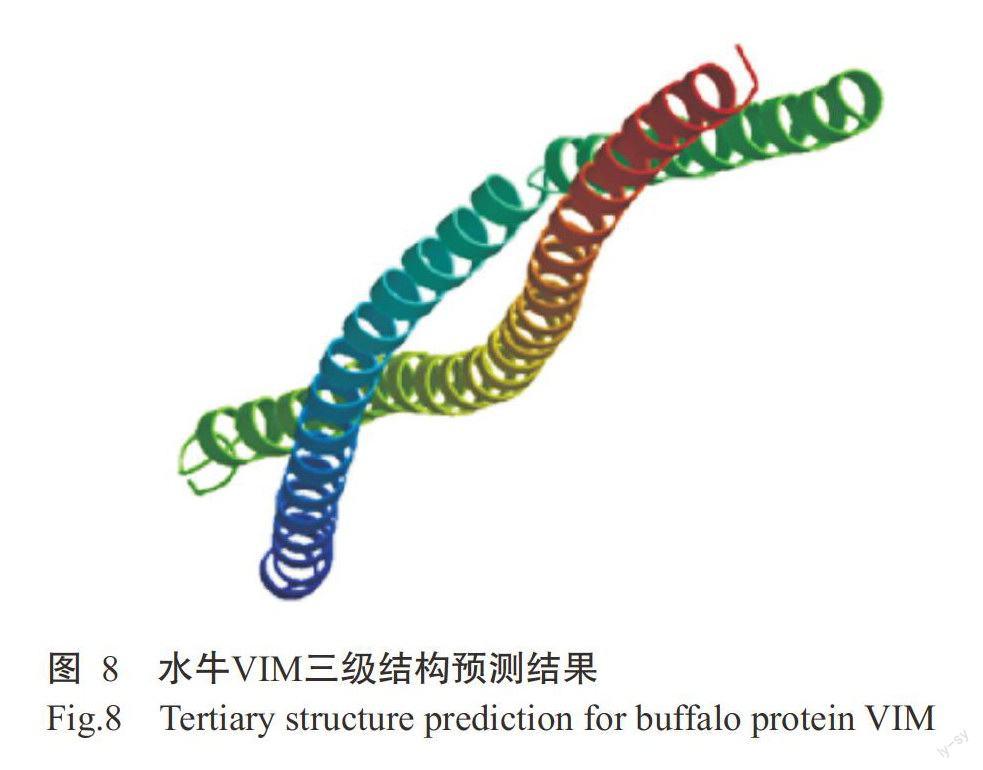
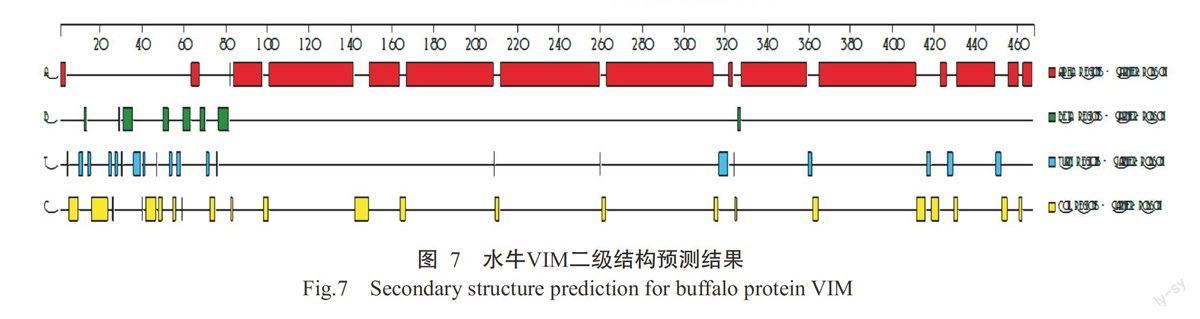
2.4.3蛋白结构 采用DNAStar Protean对水牛VIM二级结构进行预测,结果发现该蛋白的二级结构含有16个α-螺旋、8个β-折叠、21个T-转角和23个无规卷曲,以α-螺旋为主(图7)。同时利用SWISS-MODEL进行同源建模预测水牛VIM三级结构,发现也是以α-螺旋为主(图8),与其二级结构预测结果一致。
2.4.4 VIM在水牛成熟卵母细胞及早期胚胎中的表达情况采用细胞免疫荧光试验检测VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中的表达情况,结果表明,水牛VIM在成熟卵母细胞及早期胚胎中均有表达(图9),且在成熟卵母细胞中的表达量明显高于早期胚胎。
3讨论
目前,有关VIM与疾病相关性的研究较多,并已证实VIM甲基化水平可作为结肠癌(Shirahata et al.,2009)、膀胱癌及腺癌(Costa et al.,2010)、食管及胃癌(Moinova et al.,2012)、宫颈癌(Jung et al.,2011)等癌症的早期诊断指标。Zhao等(2010)还研究发现,VIM与癌细胞的侵袭及转移能力有关,且其表达在分化程度低的癌细胞中明显增加。本研究克隆获得水牛VIM基因,其编码区长1401 bp,编码466个氨基酸,同源性比对和系统发育进化树分析结果均表明,水牛删基因与牛VIM基因的同源性最高,其次是马和家犬,说明VIM在物种进化过程中具有高度的保守性。在线生物信息学分析发现,该蛋白分子量为53.73 kD,理论等电点(pI)5.05,主要在线粒体中表达,稳定性差(不稳定系数53.65),具有较强的亲水性,无跨膜结构,不属于分泌型蛋白,其蛋白结构以α-螺旋为主。
此外,也有关于VIM在细胞其他功能方面的研究报道。Byun等(2001)研究发现VIM的裂解产物可使细胞凋亡加速;Perlson等(2006)研究表明,VIM作为分子伴侣去保护pErk不会被降解,而有利于pErk在细胞中进行信息传递;Kueper等(2007)研究发现抑制VIM的修饰与改变可使组织内源性老化推迟;Corbi等(2010)研究证实,VIM可通过与eEFlγ结合再与RNA polⅡ形成复合体以调控VIM基因的表达。本研究首次研究VIM在水牛卵母细胞附植前胚胎中的表达情况,结果表明,VIM在水牛成熟卵母细胞(MII期)及早期胚胎(2-细胞阶段)中均有表达,且在成熟卵母细胞中的表达量明显高于早期胚胎,但具体原因有待进一步探究。
4结论
水牛VIM基因编码序列具有较高的保守性,且在水牛成熟卵母细胞(MII期)中的表达量明显高于早期胚胎(2-细胞阶段)。
