外源水杨酸对稻瘟病菌效应蛋白BAS4过表达菌株耐受性的影响
2017-05-30王云锋王春梅王长秘张娅玲刘林李成云杨静
王云锋 王春梅 王长秘 张娅玲 刘林 李成云 杨静

摘要:【目的】研究不同水杨酸(SA)浓度对稻瘟病菌菌株形态发育及受侵染水稻防御相关基因表达的影响,探究SA对稻瘟病活体寄生相关效应蛋白BAS4在稻瘟病菌与水稻互作中的作用机制,为生产上有效防控稻瘟病提供理论依据。【方法】利用不同浓度SA(50、100、200、500、1000和2000μmol/L)处理稻瘟病菌过表达菌株(35S:BAS4/Mo-1)和野生型菌株(A1343R-7),统计分析sA对过表达菌株和野生型菌株菌落生长速率、产孢量及孢子萌发和附着胞形成等形态发育的影响。调查200μmol/L SA处理稻瘟病菌菌株侵染水稻的发病率,实时荧光定量PCR(qRT-PCR)分析受侵染水稻防御相关基因表达情况。【结果】不同SA浓度对过表达菌株菌落生长速率、产孢量、孢子萌发率和附着胞形成的影响低于sA对野生型菌株的影响,经200μmol/L SA处理过表达菌株侵染水稻的发病率降低,但降低幅度小于200μmol/L SA处理野生型菌株侵染水稻的发病率。200μmol/L SA处理能提高过表达菌株侵染水稻病程相关基因PR1a早期上调表达及PR10a基因72 h时的高效表达;使SA途径PAL基因表达量下调,JA途径AOS2基因早期上调表达,LOX2基因各时间点下调表达;使PR5基因早期上调表达,后期急剧下调;HSP90基因早期上调表达,但低于野生型菌株侵染水稻的表达量。【结论】BAS4过表达菌株对外源SA刺激有较强的耐受性。
关键词:水稻;稻瘟病菌;效应蛋白;水杨酸
中图分类号:S432.1 文献标志码:A 文章编号:2095-1191(2017)12-2169-07
0引言
【研究意义】植物与病原菌协同进化导致双方均进化形成一系列相应的防御与反防御机制。植物病原菌利用细胞壁降解酶降解寄主植物细胞壁以利于其进一步穿透,当病原菌成功侵入寄主后即分泌大量的胞外效应蛋白。病原菌效应蛋白操纵寄主细胞结构和功能以利于病原菌侵染和抑制寄主免疫响应(Hogenhout et al.,2009),一旦分泌的效应蛋白进入寄主,它们不仅能在胞外基质中发挥作用,还能改变寄主细胞环境而有利于病菌侵染和定殖,病原菌所处环境条件决定了病原菌分泌的效应蛋白种类和数量(Kamoun,2006;Ridout et al.,2006)。因此,研究外源水杨酸(SA)对稻瘟病菌株形态发育的影响及在稻瘟病菌与水稻互作中的作用机制,可为稻瘟病的防控提供重要理论依据。【前人研究进展】大量研究表明,SA信号途径、茉莉酸(JA)信号途径和乙烯信号途径在植物抵抗腐生病原菌和半活体寄生菌侵染中具有重要的作用(Campbell and Madden,1990)。在病原菌侵染寄主植物过程中,寄主植物周围的pH、温度、湿度及寄主植物细胞的微环境如植物响应病原菌侵染时产生的SA和JA等激素水平上升或下降均会影响病原菌侵染寄主过程中的信号转导、裂解酶类或次生代谢产物产生(Verhoeff et al.,1988;Ten et al.,2001)。SA作为一种信号分子在植物细胞的一些重要代谢过程中发挥调控作用。SA可作为植物抗病反应的信号分子激活植物防御保护机制,在抗逆反应和植物信号传导中起重要作用,当病原菌侵染植物时,SA处理可诱导植物内源防御基因表达(Malamy et al.,1990;Mitraux et al.,1990;Durrant and Dong,2004;Tsudant et al.,2009;孟雪娇等,2010)。稻瘟病菌(Magnaporthe oryzae)因对水稻产量和品质造成严重危害而被认为是影响水稻生产最严重的子囊菌亚门真菌之一。稻瘟病菌接种水稻叶片后12 h,侵染菌丝在最开始穿透的表皮细胞内生长增殖,随后IH(Invasive hyphae)扩展至临近的其他细胞,这时效应蛋白可能作为病菌成功侵人相邻细胞的“先锋”;稻瘟病菌效應蛋白包括质外体效应蛋白(BAS4、BAS113和Slp1)及细胞质效应蛋白(Pwl2、AVR-Pita、BAS1、BAS2、BAS3和BAS107)(St Leger et al.,1999)。BAS2和BAS3是两个BIC相关蛋白,在侵染菌丝中表达上调,其在穿过细胞壁进入相邻细胞的菌丝中聚集(Giraldo et al.,2013)。BAS4在稻瘟病菌侵染水稻早期高效表达的基因,在IH和EIHM(Extra-invasive hyphal membrane)间的基质中聚集,而不在BIC中积累。【本研究切入点】本课题组在前期的研究中获得了BAS4过表达稻瘟病菌株,并对其毒性进行分析,发现BAS4在稻瘟病菌株内过表达提高了菌株的毒性。目前,有关SA对BAS4过表达稻瘟病菌株耐受性的影响尚未见文献报道。【拟解决的关键问题】在前期研究基础上,利用不同SA浓度处理BAS4过表达稻瘟病菌株和野生型菌株,观察不同浓度的SA对其形态发育的影响,并分析不同SA浓度处理BAS4过表达菌株和野生型菌株后孢子侵染水稻防御相关基因的表达和受侵染水稻发病率等,探明SA对稻瘟病菌效应蛋白在稻瘟病菌与水稻互作中的作用机制,为农业生产有效防控稻瘟病提供理论依据。
1材料与方法
1.1试验材料
稻瘟病菌株:野生型菌株(构建BAS4过表达菌株的稻瘟病菌株A1343R-7,保存于云南生物资源保护与利用国家重点实验室);过表达菌株35S:BAS4/Mo-1(云南生物资源保护与利用国家重点实验室构建并获得的转化菌株,是mCherry与35S启动下的BAS4融合表达载体转化到A1343R-7后获得的菌株)。水稻品种:丽江新团黑谷(LTH,普通感病水稻品种,保存于云南生物资源保护与利用国家重点实验室)。
1.2试验方法
1.2.1不同SA浓度对稻瘟病菌产孢的影响 挑取稻瘟病菌株35S:BAS4/Mo-1和A1343R-7的菌丝放入PSB培养基中并置于28℃、150 r/mim的摇床培养,将液体培养的稻瘟病菌株的菌丝液接人含不同浓度SA[50、100、200、500、1000和2000μmol/L,依次记为处理1~处理6,以二甲基亚砜(DMSO)溶液为对照(CK)]的PA培养基(西梅汁40 mL、酵母粉1 g、乳糖5 g、琼脂15 g和H20 1000 mL)上,先在28℃光照培养箱中暗培养4 d后,再昼夜交替(黑暗、光照各12 h)培养6 d。用5 mL ddH2O将孢子洗下,利用血球计数板进行计数。试验设生物学重复和技术重复各3次。
1.2.2不同SA浓度对稻瘟病菌菌落生长的影响用打孔器取在PDA培养基上已活化好的稻瘟病菌株35S:BAS4/Mo-1和A1 343R-7的菌块,接种到不同SA浓度的PDA培养基中,置于28℃培养箱中培养,每2 d测量一次菌落直径,持续至10 d。试验设生物学重复和技术重复各3次。
1.2.3不同SA浓度对稻瘟病菌孢子萌发和附着胞形成的影响 将稻瘟病菌株35S:BAS4/Mo-1和A1 343R-7的孢子用蒸馏水洗下后离心去上清液,分别加入不同浓度的SA ddH2O溶液,将孢子悬浮液浓度稀释为1×105个/mL,混匀后用移液枪取10μL孢子悬浮液滴到疏水玻片上,2 h时观察孢子萌发率,6 h时观察孢子附着胞形成情况(Spence et al.,2015)。试验设生物学重复和技术重复各3次。
1.2.4 SA对稻瘟病菌致病性的影响 挑选饱满的水稻种子进行消毒(75%酒精消毒浸泡1 min,清水冲洗3~5次,1.5%次氯酸钠消毒浸泡5 min,清水冲洗直至无次氯酸钠的气味为止),消毒后将种子用清水浸泡后置于28℃恒温培养箱中培养,种子露白后播种到育秧盘中,水稻幼苗长到3叶1心时用于接种。
将稻瘟病菌株35S:BAS4/Mo-1和A1343R-7的孢子洗下过滤后制备孢子悬浮液,离心去上清液,加入200 μmol/L SA,调节孢子悬浮液浓度为1×105个/mL,再加入悬浮液总体积0.02%的吐温-20后用于喷雾接种;以DMSO配制孢子悬浮液接种为对照。在黑暗、高温、高湿条件下放置24 h后,将其转移至温室培养;喷雾接种后分别于0、24、48、72、96和120 h取样,液氮速冻后于-80℃保存。接种7 d后进行病害调查,每次调查的样本量为60株幼苗,计算发病率。发病率(%)=发病叶片数/总叶片数×100。试验设生物学重复和技术重复各3次。
1.2.5总RNA提取、cDNA逆转录及实时荧光定量PCR(qRT-PCR)分析 总RNA提取:根据EasteprSuper总RNA提取试剂盒LS 1040操作。cDNA逆转录:根据GoScriptTMReverse Transcription System A5001试剂盒操作。qRT-PCR荧光染料:SYBR Premix EXTaq Ⅱ,反应体系根据说明配制,总体称为20.0 μL。分析防御相关基因在受侵染水稻中的表达情况,引物设计根据相关文獻报道或在文献报道基础上进行修改设计(Marcel et al.,2010;Xie et al.,2011)(表1),利用2-ΔΔCt法(Livak and Schmittgen,2001)分析检测结果。
利用qRT-PCR分析不同SA浓度处理过表达菌株35S:BAS4/Mo-1孢子接种水稻后不同时间点(0、24、48、72、96和120 h)水稻病程相关基因OsPR1a和OsPR10a、SA介导的信号转导相关基因OsPAL和OsEDS1及JA途径相关基因OsLOX2、OsAOS2和逆境胁迫相关基因HSP90、OsPR5的表达情况。qRT-PCR扩增程序:95℃预变性3 min;95℃20 s,60℃20 s,进行45个循环;60℃升温到98℃获取溶解曲线。3次重复。
1.3统计分析
所有数据统计分析均使用SPSS 13.0完成,用最小显著极差法(LSD0.05)进行平均数显著性检验,再利用Excel 2007作图分析。
2结果与分析
2.1不同SA浓度对过表达菌株35S:BAS4/Mo-1和野生型菌株A1343R-7形态发育的影响
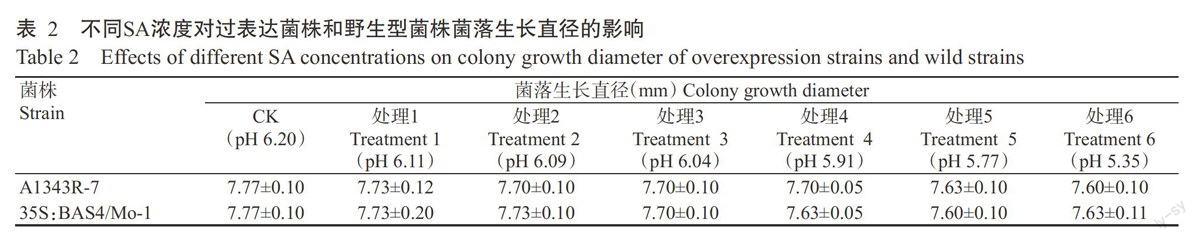
2.1.1不同SA浓度对过表达菌株菌落生长速率的影响 以配制的不同SA浓度处理过表达菌株,测量其菌落生长速率,结果见表2。从表2可看出,培养10 d后野生型菌株和过表达菌株的菌落生长速率基本一致,随着SA浓度的增加,野生型菌株与过表达菌株菌落生长直径均无显著差异(P>0.05,下同)。
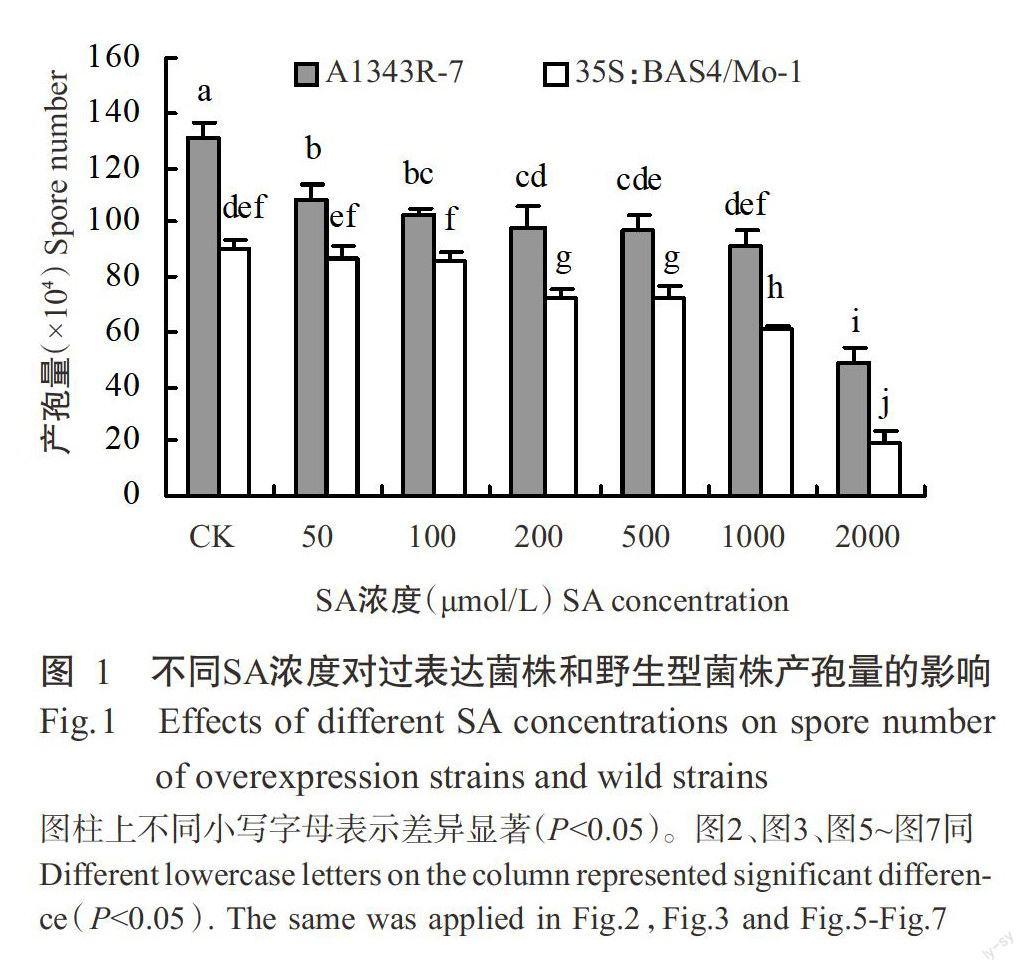
2.1.2不同SA浓度对过表达菌株产孢量的影响利用不同浓度的SA处理过表达菌株孢子,统计其对产孢量的影响,结果(图1)表明,与对照相比,SA处理能降低过表达菌株和野生型菌株的产孢量,且随着SA浓度的增加,过表达菌株产孢量降低幅度越来越大,直至SA浓度为2000 μmol/L时显著降低了过表达菌株和野生型菌株的产孢量(P<0.05,下同)。
2.1.3不同SA浓度对过表达菌株孢子萌发和附着胞形成的影响 利用不同SA浓度处理过表达菌株和野生型菌株的孢子,于2 h时观察孢子萌发,结果(图2)显示,与对照相比,50和100μmol/L SA处理未显著影响过表达菌株和野生型菌株的孢子萌发率,而150和200μmol/L SA处理显著降低过表达菌株和野生型菌株孢子的萌发率,其中200μmol/L SA处理使野生型菌株孢子萌发率降低的幅度大于过表达菌株。表明50和100μmaol/L SA对过表达菌株和野生型菌株孢子萌发没有影响,150μmol/L SA时开始抑制稻瘟病菌孢子萌发,200μmol/L SA时显著抑制稻瘟病菌孢子萌发。
于6 h时观察附着胞形成情况,结果(图3)显示,与对照相比,50和100μmol/L SA对野生型菌株和过表达菌株附着胞形成无影响,150μmol/L SA时开始抑制稻瘟病菌株附着胞形成,200μmol/L SA时显著抑制稻瘟病菌株附着胞形成,其中对野生型菌株附着胞形成的抑制作用明显大于对过表达菌株的抑制作用。因此,不同SA浓度对稻瘟病菌株附着胞形成影响的趋势与其对菌株孢子萌发的影响趋势基本一致。
2.2 SA对过表达菌株和野生型菌株致病性及水稻防御相关基因表达的影响
2.2.1 SA处理过表达菌株孢子侵染水稻病害调查结果 对接种7 d的水稻叶片进行病害调查,结果(图4)显示,经200μmol/L SA处理过表达菌株和野生型菌株孢子侵染水稻引起的发病程度较未经SA处理稻瘟病菌株孢子侵染水稻引起的发病程度轻。
对发病叶片进行发病率统计,结果(表3)显示,经200μmol/L SA处理过表达菌株和野生型菌株喷雾接种水稻引起的发病率均低于未经200μmol/LSA处理野生型菌株和过表达菌株侵染水稻引起的发病率,其中以200μmol/L SA处理野生型菌株喷雾接种水稻引起的发病率最低,显著低于未经200μmol/L SA处理野生型菌株和过表达菌株侵染水稻引起的发病率,但与经200μmol/L SA处理过表达菌株喷雾接种水稻引起的发病率差异不显著。
2.2.2 SA处理过表达菌株侵染水稻防御相关基因表达分析结果
2.2.2.1 SA处理过表达菌株侵染水稻不同时间点病程相关基因PR1a和PR10a的表达分析结果 利用200μmol/L SA处理过表达菌株孢子接种水稻后,运用SPSS 13.0分析接种后水稻在0、24、48、72、96和120 h时病程相关基因的表达量,结果(图5)显示,病程相关基因PR1a在SA处理过表达菌株侵染水稻各时间点(96 h时除外)的表达量均显著高于SA处理野生型菌株侵染水稻的表达量;PR10a基因在SA处理过表达菌株侵染水稻各时间点(96 h时除外)的表达量均高于SA处理野生型菌株侵染水稻的表达量。PRla基因在SA处理野生型菌株侵染水稻各时间点的表达量逐渐上调,但上调幅度较小,最大表达量出现在96 h时;过表达菌株的PR10a和PR1a基因均在72 h时出现表达峰值。
2.2.2.2 SA处理过表达菌株侵染水稻不同时间点水SATLJA信号途径相关基因表达分析结果 利用200μmol/L SA处理过表达菌株孢子接种水稻,采用qRT-PCR分析接种水稻在0、24、48、72、96和120 h时SA和JA途径相关基因的相对表达量,结果(图6)显示,SA途径相关基因EDS1在SA处理过表达菌株侵染水稻5个时间点的表达量高于SA处理野生型菌株侵染水稻的表达量,其中在120 h时的表达量最高;SA途径相关基因PAL在SA处理过表达菌株和野生型菌株侵染水稻各时间点的表达量明显下调,但在SA处理过表达菌株侵染水稻中表达量在72 h后下调幅度小于野生型菌株侵染水稻的表达;JA途径相关基因LOX2在SA处理过表达菌株侵染水稻各时间点的表达量均下调,且下调幅度大于野生型菌株侵染水稻各时间点的表达量;JA途径相关基因AOS2在SA处理过表达菌株侵染水稻24、48、96和120 h时的表达量显著高于野生型菌株侵染水稻的表达量。
2.2.2.3 SA处理过表达菌株侵染水稻不同时间点水稻抗性相关基因及胁迫响应基因的表达分析结果利用200μmol/L SA处理过表达菌株孢子接种水稻后分析水稻在0、24、48、72、96和120 h时胁迫相关基因的相对表达量,结果(图7)显示,胁迫相关基因PR5在SA处理过表达菌株侵染水稻24和48 h的表达量显著高于野生型菌株侵染水稻的表达量,而在侵染水稻72、96和120 h的表达量低于野生型菌株侵染水稻的表达量;胁迫相关基因HSP90在SA处理过表达菌株侵染水稻除96 h外的4个时间点的表达量均小于野生型菌株侵染水稻的表达量。
3讨论
本研究发现SA影响了稻瘟病菌过表达菌株的形态发育,但影响幅度小于对野生型菌株的影响;SA对过表达菌株致病性也有一定影响,但对致病性的影响幅度亦小于野生型菌株。进一步研究SA处理过表达菌株侵染水稻在0、24、48、72、96和120 h时防御相关基因的表达,发现SA提高了过表达菌株侵染水稻病程相关基因PR1a的表达量,表明PR1a基因表达量被外源SA诱导上调,且PR1a作为PCD信号途径的相关基因,其表达量上调会促进受侵染水稻细胞死亡,能进一步阻碍病原菌侵染,而本研究中PR1a基因上调表达,表明过表达菌株活体营养期水稻细胞大量死亡,不利于过表达菌株从活体营养向死体营养期转变;PR10a基因在侵染早期(24和48 h)表达量较低,在72 h时表达量急剧上调,表明PR10a基因在过表达菌株侵染水稻早期并未识别与其互作的稻瘟病菌蛋白,而在72 h时随着病菌的进一步侵染,菌株分泌了一些新的能被PR10a基因识别的效应蛋白,因此PR10a基因上调表达。由此看出,虽然SA影响了BAS4过表达菌株的形态发育,但菌株自身仍能调控侵染水稻的病程相关基因PR1a基因上调和PR10a基因下调,有利于其进一步侵入水稻,使水稻发病。
SA途径的PAL基因是SA合成关键酶基因,本研究发现外源SA降低了受侵染水稻PAL基因表达,表明外源SA可能抑制了受侵染水稻内源SA的合成,因此在后期观察到受侵染水稻仍处于较高发病率。有研究表明,JA途径的AOS2基因过量表达提高了内源JA含量、PR1基因表达量及水稻对稻瘟病菌的抗性(Xie et al.,2011)。本研究发现JA途径的AOS2基因的表达量在SA处理过表达菌株侵染水稻各时间点虽然有上调,但上调幅度均不明显,LOX2基因的表达量则出现急剧下调,由于LOX2是催化JA合成的第一步,虽然AOS2基因表达量有上调,但LOX2基因的表达量大幅下调,因此总体来说受侵染水稻内源JA的合成也受到抑制。其是在水稻应对病原菌侵染及脅迫时上调表达的基因,PR5在受到JA和SA诱导时也呈上调表达,提高了水稻对白叶枯病菌的抗性(Datta et al.,1999;Jwa et al.,2001)。本研究还发现PR5基因在外源SA处理过表达菌株侵染水稻早期表达量上调,表明受侵染水稻早期响应了BAS4过表达菌株的侵染,但后期其响应程度降低。水稻胁迫响应基因HSP90在水稻应对环境刺激及防御响应时起关键作用,其在外源SA处理的过表达菌株侵染水稻早期也出现上调,但上调幅度稍低于野生型菌株侵染的水稻,表明外源SA处理过表达菌株侵染水稻受到的胁迫程度较外源SA处理野生型菌株侵染水稻的低。
综上所述,尽管过表达菌株35S:BAS4/Mo-1受到外源SA处理后其菌株形态发育和致病性均受到一定影响,但受影响的幅度较小,表明BAS4过表达菌株和野生型菌株均受到外源SA的刺激,但BAS4过表达菌株较野生型菌株有较强的调控水稻防御相关基因在不同时间的表达量促进其成功侵染定殖水稻的能力,预示着BAS4过表达菌株对SA的刺激有较强的耐受性,但其机制有待进一步探究。
4结论
不同浓度的外源SA对过表达菌株35S:BAS4/Mo-1形态发育和致病率的影响小于其对野生型菌株A1343R-7的影响,但过表达菌株通过调控受侵染水稻防御相关基因的表达量,促进其成功侵入水稻,表明BAS4过表达菌株对外源SA刺激有较强的耐受性。
