肥胖对成年人心脏功能及运动变化特征的影响
2017-05-23陈贻珊张一民孔振兴于晶晶孙婷婷张瀚月
陈贻珊,张一民,孔振兴,于晶晶,孙婷婷,张瀚月
肥胖对成年人心脏功能及运动变化特征的影响
陈贻珊,张一民,孔振兴,于晶晶,孙婷婷,张瀚月
目的:评价肥胖成人安静及运动状态下心脏结构和功能的特点,旨在评估心脏改变的风险性和不良后果。方法:选取130名40~60岁的北京市居民(男n =29,女n =101),依照BMI分类标准,分成体重正常组(n =57)、超重组(n =56)、肥胖组(n =17)。每名受试者蹬骑卧式功率车进行起始25 W,每2 min递增25 W 的运动,每等级运动结束前30 s 及恢复期测定超声心动图。结果:1)与体重正常组相比,肥胖组舒张末期室间隔厚度(IVSd)、左心室舒张末期内径(LVIDd)、舒张末期左室后壁厚度(LVPWd)、左心室舒张末期容积(EDV)、左心室质量(LVM)、左心室质量指数(LVMI)、心率(HR)、每搏量(SV)、心输出量(CO)均非常显著性增加(P<0.01)。2)肥胖成人发生左心室肥厚的比例远高于体重正常者和超重者。3)运动过程中肥胖者CO、SV非常显著性高于体重正常组(P<0.01),EF、HR无显著性差异(P>0.05)。结论:超重可引起心脏肥大,左室收缩功能异常,并随超重向肥胖过渡而加重。肥胖者运动中每搏量、心输出量较高,但心功能储备低于体重正常者,且运动后心率恢复受损。肥胖者安静及运动状态下心脏功能异常增强的原因尚需进一步深入研究。
超声心动图;心脏;肥胖;运动
1 前言
肥胖症是一种由多因素引起的慢性代谢性疾病,早在1948年世界卫生组织已将它列入疾病名单。肥胖症在我国人群中的患病情况已呈流行趋势,国家体育总局发布的《2014年国民体质监测公报》[1]显示,2014年我国成年人和老年人的肥胖率分别为10.5%和13.9%,而2004年成人肥胖率仅为3.01%[10],肥胖问题已经成为影响我国成年人群体质与健康的突出问题。肥胖对健康的危害是多方面、多系统的,尤以心血管系统损伤对生命的威胁最为严重。肥胖是发生心血管疾病( CVD) 的重要危险因素,肥胖不仅通过其相关疾病,如Ⅱ型糖尿病、高血压、脂代谢紊乱、阻塞性睡眠呼吸暂停等,构成了对心血管系统的不良影响,还可直接影响心脏的结构和功能[8]。
传统的观点认为,肥胖导致的左心室肥厚是以离心性肥厚为主[25],但最近的研究却发现,向心性肥厚在肥胖人群中更为普遍[11,31],而肥胖是否会引起心脏射血分数下降也存在争议[23]。目前关于超重肥胖对心脏结构和功能影响的研究结论并不一致,可能与研究对象的健康状况、肥胖的判断标准及评价指标、测试方法和控制条件的差异有关,有待对更多人群进行广泛、深入的研究加以验证和补充。且研究显示[26],肥胖伴随左心室肥厚者心血管事件危险大大增加。因此,肥胖人群在进行运动前需要了解运动引起的心血管风险情况。有关运动中心血管风险的研究多以动态心电图与血压等指标进行监测[5],鲜有运动中心脏结构和功能变化特征的直接观察报道。若能对肥胖人群进行科学的不同运动负荷下心脏机能筛查,就能更准确地判断其对进行体育锻炼强度的耐受力。
因此,本研究采用递增负荷蹬骑卧式功率自行车的运动形式对受试者进行运动刺激,受试者运动全程进行超声心动图(ultrasonic cardiogram,UCG)的检测。比较安静状态、运动中及恢复期等过程中心脏结构和功能特点,旨在发现超重肥胖的不良后果,探讨和评价肥胖成人运动中的心脏功能和心肌活动的调节能力,掌握其变化特征,从而为其制定合适的运动处方,并为预防运动中心血管意外事件的发生,提供可靠的理论依据。
2 研究对象与方法
2.1 研究对象
选取130名40~59岁的北京市居民,男性29名,女性101名。要求所有受试者无心血管病、糖尿病病史,且均取得知情同意。参照2004年中国肥胖问题工作组研制的“中国成人超重、肥胖筛查BMI分类标准”[10]:以BMI值24 kg/ m2为中国成人超重的界限,BMI值28kg/m2为肥胖的界限,将受试者分成3组:体重正常组、超重组和肥胖组,基本情况如表1所示。

表1 受试者的基本情况Table1 Basic Information of Participants
2.2 研究方法
2.2.1 形态测量
参照《国民体质测定标准手册》的测试方法,对受试者身高、体重进行测试,并计算身体质量指数(body mass index,BMI)。
2.2.2 UCG检查
使用美国GE公司生产的Vivid 7彩色超声诊断仪,M4S探头,频率2.5MHz。检查时受试者取平卧位和(或)侧卧位,平静呼吸,探头置于胸骨左缘检查。于二维图像指导下获得左心室短轴二尖瓣的腱索水平的M型图像,采用美国UCG协会推荐的测量方法,得到左心室结构类指标有舒张末期室间隔厚度(end-diastolic interventricular septal thickness,IVSd)、收缩末期室间隔厚度(end-systolic interventricular septal thickness,IVSs)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVIDd)、左心室收缩末期内径(left ventricular end-systolic dimension,LVIDs)、舒张末期左室后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd)、收缩末期左室后壁厚度(left ventricular end- systolic posterior wall thickness,LVPWs)、左心室舒张末期容积(left ventricular end-diastolic volume,EDV)、左心室收缩末期容积(left ventricular end- systolic volume,ESV)、主动脉根部内径(aortic root dimension,AOD);心脏功能类指标有心率(heart rate,HR)、每搏量(stroke volume,SV)及衍生指标射血分数(ejection fraction,EF)、心输出量(cardiac output,CO)、短轴缩短率(fractional shortening,FS)。所有的测量均由同一人来进行操作,以避免系统误差。根据公式计算左心室质量(left ventricular mass,LVM)、左心室质量指数(left ventricular mass index,LVMI)、相对室壁厚度(relative wall thickness,RWT)[13]。
LVM=0.8×1.04×[(LVIDd+LVPWd+IVSd)3−(LVIDd)3]+0.6(g)。
LVMI=LVM/H2.7(g/m2.7)。
RWT=2LVPWd/ LVIDd(cm)。
左室几何构型根据左室重量指数LVMI和相对室壁厚度RWT的不同,可划分为4种类型:1)左室正常构型(normal):RWT及LVMI均正常;2)向心性重构(concentric remodeling):RWT增加,LVMI正常;3)向心性肥厚(concentrichypertrophy):RWT及LVMI均增加;4)离心性肥厚(eccentric hypertrophy):RWT正常,LVMI增加[13]。男性≥49 g/m2.7、女性≥45 g/m2.7[9]为LVMI增加,RWT≥0.42cm[3]为RWT增加。
2.2.3 运动负荷试验
采用丹麦产LINAK卧式功率自行车为测功仪器。蹬车前受试者保持静息状态10 min后,测定UCG。根据《超声心动图学》(第4版)[6],负荷量从25 W起,每级负荷维持2 min,每次递增25 W负荷量,蹬车的频率保持60 rpm,每等级负荷最后30 s测定UCG,运动终止标准参考《超声心动图学》[6]及《ACSM运动测试与运动处方指南》[7],达到终止条件时停止运动。采用SunTec Tango+动态血压计每隔1min监测1次血压变化。递增负荷试验结束后,要求受试者静卧4 min,均匀呼吸,不得与人交谈,恢复期4 min内,每分后30 s测定UCG,共记录4次。该等级运动持续时间达到90 s以上的终止负荷即为该受试者的最高运动负荷(测试方案表2)。

表2 运动负荷方案Table2 The Program of Exercise Stress Test
2.3 数据统计分析
采用Microsoft Excel 2013整理数据,采用SPSS16.0软件对数据进行统计分析。计量资料以X±SD表示。各组间比较采用单因素方差分析,各变量间的相关关系采用偏相关分析,运动负荷试验心脏结构和功能的变化特征采用配对样本t检验。以P<0.05为差异有统计学意义,以P<0.01表示具有非常显著性意义。
3 研究结果
3.1 肥胖对成年人心脏重构的影响
3.1.1 不同BMI组间心脏结构和功能指标比较
如表3所示,不同BMI组间心脏结构指标IVSd、IVSs、LVIDd、LVPWd、LVPWs、EDV、LWM、LWMI间差异具有统计学意义(P<0.01)。与体重正常组比较,肥胖组LVIDd非常显著性扩大(P<0.01),LVIDd的扩大引起EDV非常显著性增加了21.1%(115.18±18.50 vs. 95.09±20.37,P<0.01),IVSd、LVPWd非常显著性增厚(P<0.01),LVM、LVMI非常显著性增加(P<0.01),LVM增加率达35.3%(156.89±41.27 vs. 115.94±27.18),LVMI也增加32.5%(43.90±9.21 vs. 33.13±7.62);超重组LVM也显著性增加了(P<0.05)。与超重组比较,肥胖组EDV显著性扩大(P<0.05);LVMI非常显著性增加(P<0.01)。
不同BMI组间的心脏功能指标HR、CO、SV间差异有统计学意义(P<0.01),而EF、FS、E/A无显著性差异(P>0.05)。与体重正常组比较,肥胖组HR、SV非常显著性增加了(P<0.01),CO也显著性增加(P<0.05),超重组HR、CO显著性增加(P<0.05)。与超重组比较,肥胖组SV非常显著性增加了(P<0.01)。

表3 不同BMI组间心脏结构和功能指标比较Table3 The Comparison of Indicators of Cardiac Structure and Function in Different BMI Groups
3.1.2 超重肥胖成人左室几何构型的分布
如表4所示,肥胖成人发生左心室肥厚的比例远高于体重正常者和超重者,且多为离心式肥厚。

表4 超重肥胖成人左室几何构型的分布Table4 The Distribution of Left Ventricular Geometry in Overweight and Obesity Adults
3.1.3 BF、BMI与心脏结构和功能指标间的相关分析
采用偏相关分析对BF、BMI与心脏结构和功能指标间的相关关系进行分析。控制年龄、性别变量后,发现BMI与心脏结构类指标LVIDd(r=0. 247,P<0.05)、LVPWd(r=0. 223,P<0.05)、EDV(r=0. 232,P<0.05)、LVM(r=0. 328,P<0.01)、LVMI(r=0. 385,P<0.01)均呈正相关;其中与LVMI的相关程度最高,其次是LVM。BMI与心脏功能类指标HR(P<0.05)、CO(P<0.01)、SV(P<0.05)均呈正相关,r值分别为0.232、0.258、0.252。
3.2 肥胖对运动中心脏结构和功能变化特征的影响
3.2.1 BMI组间运动终止时间及负荷分布情况
如表5所示,受试者达到终止条件停止运动时,超重组和肥胖组在卧式功率自行车进行蹬踏运动所达到的最高运动负荷均显著高于体重正常组(P<0.05)。所有受试者运动均达到第3等级。
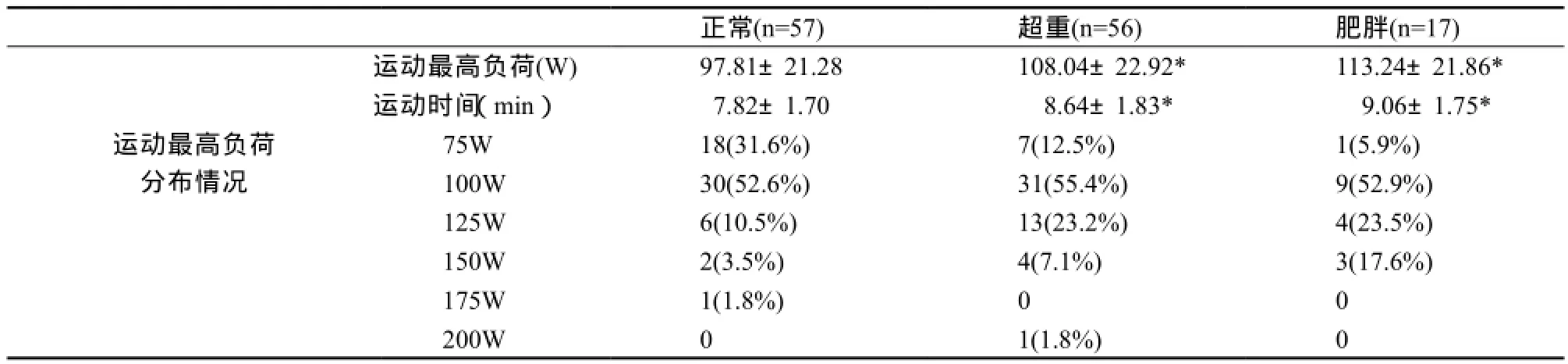
表5 不同BMI组间运动终止时间及负荷分布情况Table5 The Distribution of Exercise Duration and Peak Exercise load in Different BMI Groups
3.2.2 运动过程中不同BMI组间心脏结构和功能指标的比较
如表6所示,与体重正常组比较,运动第1等级末肥胖组LVIDd、EDV非常显著性大于体重正常组(P<0.01),IVSs、LVPWs非常显著性厚于体重正常组(P<0.01),SV非常显著性高于体重正常组(P<0.01),CO也显著性高于体重正常组(P<0.05);运动最高等级末肥胖组LVIDd、EDV显著大于体重正常组(P<0.05),LVPWs非常显著性厚于体重正常组(P<0.01),CO、SV非常显著性高于体重正常组(P<0.01)。
与安静状态相比,不同BMI组间大部分心脏结构和功能指标在递增负荷运动各阶段均出现显著性的变化。但体重正常组和超重组的IVSd无论在运动开始阶段(P<0.05)还是运动最高负荷阶段(P<0.01)均出现显著性增厚,而肥胖组IVSd在各阶段的差异均无统计学意义;且在运动最高负荷阶段,体重正常组CO(P<0.05)、EF(P<0.01)、FS(P<0.01)均显著性增高,但肥胖组这些心脏功能指标的增高并不显著(P>0.05)。与安静状态相比,体重正常组在运动最高负荷阶段EDV扩大14.2%,高于肥胖组的11.7%;HR上升了117.3%,高于肥胖组的89.9%;FS增加了23.8%,低于肥胖组的28.9%;CO增加了130.2%,低于肥胖组的133.8%;EF增加了16.0%,低于肥胖组的18.1%;SV增加了31.9%,高于肥胖组的30.7%。
3.2.3 恢复阶段不同BMI组间心脏结构和功能指标比较
如表7所示,运动后第1 min肥胖组心脏结构和功能指标与体重正常组相比,差异均无统计学意义;运动后第4 min肥胖组LVIDd显著性大于体重正常组(P<0.05),IVSd、LVPWs显著性厚于体重正常组(P<0.05),SV显著性高于体重正常组(P<0.05)。
与运动状态相比,不同BMI组间大部分心脏结构和功能指标在恢复期均出现显著性的变化。体重正常组运动后第1 min LVIDd、EDV、ESV均出现非常显著性减小(P<0.01),运动后第4 min LVIDd、EDV继续出现非常显著性减小(P<0.01),但肥胖组LVIDd、EDV恢复期均无显著性变化(P>0.05)。体重正常组运动后第1 min SV出现非常显著性增加(P<0.01),随后第4min SV非常显著性减小(P<0.01),但肥胖组SV恢复期均无显著性变化(P>0.05)。运动后第1 min肥胖组EF显著性增加(P<0.05),但体重正常组无显著性变化(P>0.05)。与运动最高负荷阶段相比,体重正常组在恢复后第4 min HR下降了41.9%,高于肥胖组的39.7%;EDV下降了8.4%,低于肥胖组的9.1%;CO下降了41.2%,低于肥胖组的46.5%;SV下降了9.4%,低于肥胖组的11.9%;FS下降了2.7%,低于肥胖组的5.9%;体重正常组EF上升了12.8%,而肥胖组却下降了3.8%。
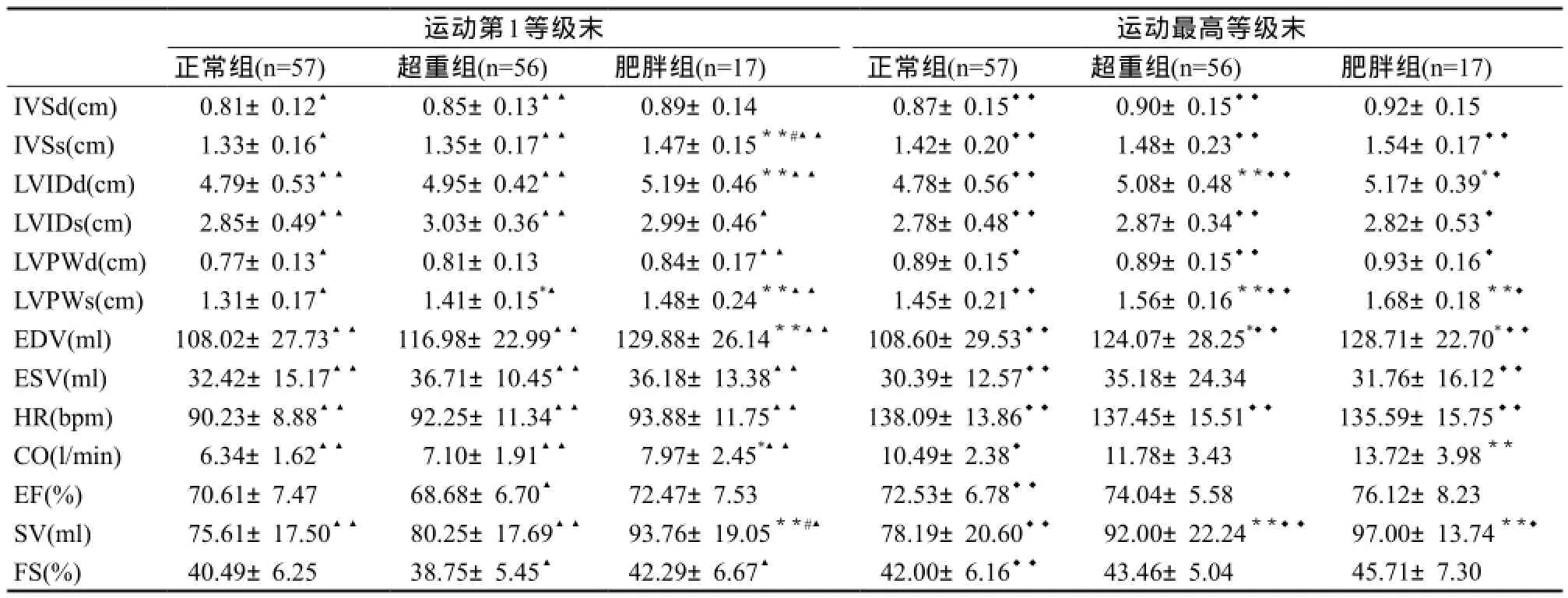
表6 运动过程中不同BMI组间心脏结构和功能指标的比较Table6 The Comparison of Indicators of Cardiac Structure and Function During Exercise in Different BMI Groups
注:1)IVSd舒张末期室间隔厚、IVSs收缩末期室间隔厚度、LVIDd左心室舒张末期内径、LVIDs左心室收缩末期内径、LVPWd舒张末期左室后壁厚度、LVPWs收缩末期左室后壁厚度、EDV左心室舒张末期容积、ESV左心室收缩末期容积、LVM左心室质量、LVMI左心室质量指数、RWT相对室壁厚度、HR心率、CO心输出量、EF射血分数、SV每搏量、FS短轴缩短率、E/AE峰与A峰比值。2)相同运动等级超重组、肥胖组与体重正常组比较:*P<0.05,**P<0.01,肥胖组与超重组比较:#P<0.05。3)相同BMI组运动第一等级末与安静状态比较:▲P<0.05,▲▲P<0.01;相同BMI组运动最高等级末与运动第1等级末比较:◆P<0.05,◆◆P<0.01。
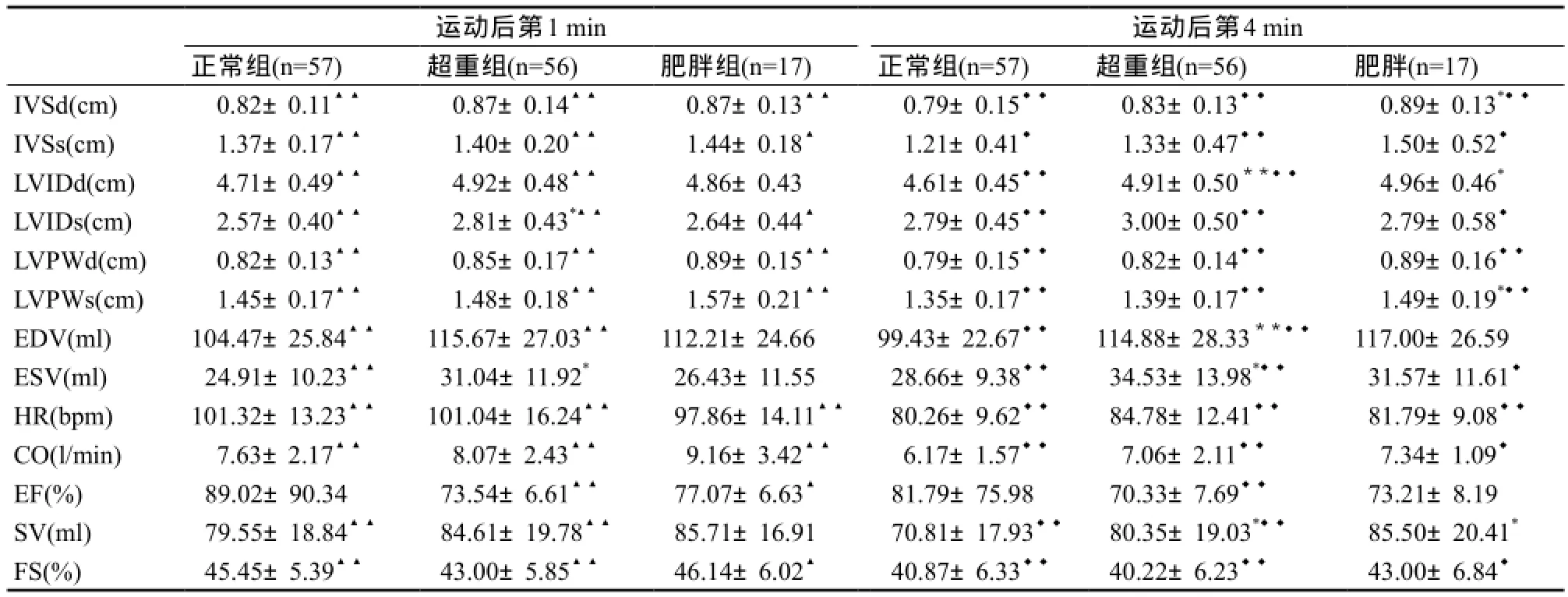
表7 恢复阶段不同BMI组间心脏结构和功能指标的比较Table7 The Comparison of Indicators of Cardiac Structure and Function During Recovery in Different BMI Groups
4 分析与讨论
4.1 肥胖对成年人心脏重构的影响结果分析
肥胖被WHO列为一种全球性的流行病。作为一种慢性营养障碍性疾病,肥胖与多种疾病,尤其是心血管病的发生密切相关,是心力衰竭的一项独立危险因素[22]。在无其他心血管疾病危险因素的作用下,肥胖对心脏结构即可产生较大影响,是导致心源性死亡和全因死亡的主要因素之一[17,27]。肥胖的危害除了引起肥胖者冠状动脉硬化性心脏病、高血压、睡眠呼吸紊乱和糖尿病的患病率增高外,还会直接引起心脏重构和功能异常[11]。
本研究发现,肥胖者虽然没有出现临床症状,且结构和功能各指标均处在正常范围内[6],但提示肥胖者心脏已出现病理性改变,包括IVSd、LVPWd厚度增加,LVIDd、EDV增大,LVM、LVMI增加,HR加快,SV和CO增加,这与大部分研究结果一致[11,27,31,35]。但肥胖者与体重正常者的EF、FS及心脏舒张功能指标E/A的比值并无显著性差异。LVM受体型影响,目前有3种LVM指数可纠正体型的差异,包括LVM/H、LVM/ BSA(体表面积)和LVM/H2.7,而LVM/ H2.7更准确[15],故本研究采用LVM/H2.7作为LVMI。纠正年龄、性别的差异后发现,肥胖者的LVMI增加了32.5%,说明体脂肪过量引起的肥胖确实会导致LVM增加。尽管与体重正常者相比,肥胖者EF无显著差异,SV、CO增强,但这并不代表肥胖者心脏功能增强。相反,研究表明,肥胖者心肌收缩功能异常[11]。关于肥胖者出现心脏重构和功能异常的原因目前尚未明确,但研究表明,与血流动力学因素和代谢因素有关。肥胖导致过量的脂肪不均匀地堆积在皮下和器官周围,器官周围(腹膜、心外膜)的脂肪新陈代谢十分活跃,体重越重,增加的脂肪对代谢的要求越高,心脏负荷加重,就会引起容量超负荷和CO增加,并导致左室质量增加[16]。同时肥胖与炎症或胰岛素抵抗相关的细胞外基质改变有关,改变发生在明显的左心室肥大或心脏功能下降之前[33],并与肥胖的严重程度及持续时间相关。肥胖引起的代谢紊乱可能导致心肌功能障碍,胰岛素抵抗可以修复心肌底物利用,引起心肌脂肪酸氧化和氧气消耗增加,导致心脏工作效率下降[28],因此,肥胖者SV、CO增强。如果这种情况长期得不到缓解,将进一步加重心脏负担,导致心肌肥厚、左室腔扩大、心肌耗氧量增加,出现左室舒张功能不全,并最终影响全心功能,出现心力衰竭[4]。
肥胖者常伴随着心肌肥厚,而心肌肥厚本身即可增加心源性猝死的风险[29]。据统计,血压正常肥胖者心肌肥厚的比例为13%,而高血压肥胖者发生心肌肥厚的概率则高达75%[12]。本研究中,41.1%肥胖者出现心肌肥厚,且向心性肥厚发生比例达17.6%,这是与死亡率最密切相关的心脏重构类型[24],并且这种几何构型往往还伴随着心脏收缩功能障碍和血压升高,可增加肥胖者心血管疾病风险和死亡率[21]。本研究中肥胖者以离心性肥胖为主,与传统的观点一致[25],不同于Rider等[31]的结论,但与Woodiwiss等[35]对309名肥胖者使用LVM/H2.7的结论一致。这说明肥胖引起的心脏肥厚构型确实存在争议,有待对更多人群进行广泛、深入的研究加以验证和补充,但不可否认,肥胖者患心肌肥厚的比例远高于体重正常者。
4.2 肥胖对运动中心脏结构和功能变化特征的影响结果分析
运动功能障碍的发生要早于静息状态异常的出现,且肥胖者由于过量的体重在运动中需要克服更大的工作负荷,因此,对肥胖人群进行科学的不同运动负荷下心脏机能筛查是十分必要的。但目前多在静息状态下研究肥胖对心脏结构和功能影响[12,16,25,27,31],缺乏肥胖者心脏对运动反应的研究,尤其亚极量和极量运动状态下的心脏功能、心肌调节能力及变化特征更是鲜见。本研究选择运动第1等级末、运动最高等级末、运动后第1 min、运动后第4 min,共4个时刻记录的UCG图像进行统计分析,即为分别比较肥胖者进入工作状态、运动终点状态、运动停止即刻状态和恢复状态的心脏结构和功能特点,用以探讨和评价肥胖成人运动中的心脏功能和心肌活动的调节能力与变化特征。
与体重正常组EF相比,肥胖组无论是在安静阶段,或运动阶段,还是在恢复阶段,差异均无统计学意义。而Vella等[34]研究发现,虽然肥胖者EF在极量运动状态与体重正常者并无差异,在安静状态和亚极量运动状态却低于体重正常者。造成这种差异的原因尚未可知,但可能与其肥胖受试者的平均年龄仅为25.1岁,肥胖持续时间较短有关。但其体重正常组与安静状态相比,在极量运动状态HR上升了143.6%,肥胖组仅增加了137.0%,这与本研究中体重正常者在运动最高负荷阶段HR上升了117.3%,高于肥胖组的89.9%的研究结果一致,且体重正常者所能达到的平均最高HR为138.09次/分,高于肥胖者平均135.59次/分,证明了肥胖者的心率储备远低于体重正常者。运动后心率恢复(Heart rate recovery ,HRR)显示,运动停止后心率下降的速度,对于评价运动中心血管风险具有重要的价值,且HRR异常一直被视为预测心血管疾病及其主要心血管事件发生的有效独立危险因素[2]。本研究发现,在恢复后第1min内,体重正常者HR平均下降了36.77 bpm、超重者36.41bpm、肥胖者37.73bpm,不同BMI在运动停止即刻HRR区别不大,但体重正常组在恢复后第4 min与运动最高负荷阶段相比,HR平均下降了57.8次/分,高于肥胖组的53.8次/分,说明肥胖组HRR慢于体重正常组。Gondoni等[20]对554名成年人进行递增运动负荷试验,最高心率平均达139bpm,并以BMI值25 kg/m2、30kg/m2为超重及肥胖的判断标准,比较发现,肥胖者运动后1分内心率恢复平均为23次/分,显著低于体重正常者的29次/分。EI Agaty[19]也发现肥胖女性HRR低于体重正常者,说明肥胖确实会引起HRR受损。在一项纵向研究中发现[14],恢复期5 min后的心率<55次/分者心血管疾病死亡率的风险为>75次/分者的2倍。
本研究还发现,运动刚开始阶段和最高运动负荷阶段,肥胖者CO、SV都显著性高于体重正常者。这与Vella[34]等的研究结果一致。LVIDd、EDV、LVPWs也显著性高于体重正常者。不同BMI组间HR、EF却无显著性差异。说明肥胖并未影响心脏的运动表现,随着运动强度增大,心脏结构和功能适应性调整,但这并不意味着肥胖者心脏功能增强。肥胖者安静状态下SV、CO增加,且在最高运动负荷阶段,肥胖者SV、CO也均非常显著性高于体重正常者。Rajalakshmi[30]发现,无论是在安静还是在运动状态下,肥胖者心肌耗氧量增加,导致更高的血流动力学压力,且肥胖者血容量较大[34],更多的血容量可以促进静脉血流回心,使SV、CO增加。这是心脏对于肥胖的适应性改变和补偿,对于轻度或短期肥胖是有益的,并使肥胖者能耐受运动等对心脏负荷要求较高的状态。这种现象也在肥胖儿童身上发现。Schuster等[32]研究显示,1度肥胖男孩即可出现心脏重构,并随肥胖加重而加重,且1度和2度肥胖男孩SV、CO均显著大于体重正常男孩,2度肥胖男孩无论是在静息还是运动状态,均呈现轻微舒张功能不全,说明随着肥胖持续时间延长和肥胖程度加重,这种改变不足以补偿肥胖对代谢的要求,可能会导致心脏功能障碍[18]。所有肥胖引起的安静和运动状态下心脏重构和功能异常,在减肥后是可逆的[30],因此,肥胖者心脏异常的早期检测是十分必要的。
5 结论
超重可引起心脏肥大,左室收缩功能异常,并随超重向肥胖过渡而加重。肥胖者运动中每搏量、心输出量较高,但心功能储备低于体重正常者,且运动后心率恢复受损。肥胖者安静及运动状态下心脏功能异常增强的原因尚需进一步深入的研究。
[1] 国家体育总局. 2014年国民体质监测公报 [EB/OL]. (2015-11-25). http://www.sport.gov.cn/n16/n1077/n1227/7328132. html.
[2] 康美华,王成. 运动后心率恢复的研究进展[J]. 中国循证儿科杂志,2014,9(1):72-76.
[3] 孔羽,李航,余振球. 难治性高血压肾功能损害与左心室肥厚的关系[J]. 中华高血压杂志,2012,(8):761-765.
[4] 李梅,张晓蓉,薛爱玲. 超声心动图检测单纯性肥胖儿童心脏功能的改变[J]. 中国临床医生,2014,(7):79-81.
[5] 苏浩,谢敏豪,曹建民,等. 40~49岁成年人运动中心血管风险预测研究[J]. 体育科学,2013,33(9):36-45.
[6] 王新房. 超声心动图学[M]. 北京:人民卫生出版社,2009:215-216.
[7] 王正珍. ACSM运动医学检测与处方指南(第8版)[M]. 北京:人民卫生出版社,2010:97.
[8] 谢玲玎,邢小燕. 肥胖与心血管疾病[J]. 中国实用内科杂志,2012,(10):751-753.
[9] 于雪芳,王清,万征,等. 两种方法标化的左心室质量指数对原发性高血压患者左心室肥厚检出率的影响[J]. 中华高血压杂志,2012,(9):852-857.
[10] 中国肥胖问题工作组. 中国成人超重和肥胖症预防与控制指南(节录)[J]. 营养学报,2004,26(1):1-4.
[11] AURIGEMMA G P,De S G,FITZGIBBONS T P. Cardiac remodeling in obesity.[J]. Physiol Rev,2013,6(1):142-152.
[12] AVELAR E,CLOWARD T V,WALKER J M,et al. Left ventricular hypertrophy in severe obesity:interactions among blood pressure,nocturnal hypoxemia,and body mass [J]. Hypertens,2007,49(49):34-39.
[13] BRADY T M. The role of obesity in the development of left ventricular hypertrophy among children and adolescents.[J]. Curr Hypertens Rep,2016,18(1):3.
[14] CHENG Y J,LAUER M S,EARNEST C P,et al. Heart rate recovery following maximal exercise testing as a predictor of cardiovascular disease and all-cause mortality in men with diabetes [J]. Diabetes Care,2003,26(7):2052-2057.
[15] DE S G,DANIELS S R,DEVEREUX R B,et al. Left ventricular mass and body size in normotensive children and adults:assessment of allometric relations and impact of overweight [J]. J Am Coll Cardiol,1992,20(5):1251-1260.
[16] DE S G,DEVEREUX R B,KIZER J R,et al. Body composition and fat distribution influence systemic hemodynamics in the absence of obesity:the HyperGEN Study [J]. Am J Clin Nutr,2005,81(4):757-761.
[17] DE S G,WACHTELL K,PALMIERI V,et al. Body build and risk of cardiovascular events in hypertension and left ventricular hypertrophy:the LIFE (Losartan Intervention For Endpoint reduction in hypertension) study [J]. Circulation,2005,111(15):1924-1931.
[18] DIVITIIS O D,FAZIO S,PETITTO M,et al. Obesity and cardiac function [J]. Circulation,1981,64(3):477-482.
[19] EI AGATY S M,KIRMANI A,LABBAN E. Heart rate variability analysis during immediate recovery from exercise in overweight/obese healthy young adult females [J]. Ann Noninvasive Electrocardiol,2016,12:44-48.
[20] GONDONI L A,TITON A M,NIBBIO F,et al. Heart rate behavior during an exercise stress test in obese patients [J]. Nutr Metab Cardiovas,2009,19(3):170-176.
[21] JING L,BINKLEY C M,SUEVER J D,et al. Cardiac remodeling and dysfunction in childhood obesity:a cardiovascular magnetic resonance study [J]. J Cardiov Magn Reson,2016,18(1):1-12.
[22] KENCHAIAH S,RAMACHANDRAN V S. Obesity and the risk of heart failure [J]. New Engl J Med,2002,347(5):305-313.
[23] KOOPMAN L P,MERTENS L L. Impact of childhood obesity on cardiac structure and function [J]. Curr Treat Options Cardiovasc Med,2014,16(11):1-20.
[24] KRUMHOLZ H M,LARSON M,LEVY D. Prognosis of left ventricular geometric patterns in the Framingham Heart Study [J]. J Am Coll Cardiol,1995,25(4):879-884.
[25] MESSERLI FH,SUNDGAARD-RIISE K,REISIN ED,et al. Dimorphic cardiac adaptation to obesity and arterial hypertension[J]. Ann Intern Med,1983,99(6):757-761.
[26] MUIESAN M L,SALVETTI M,DI C A,et al. [OP.7A.01] Obesity,incident cardiovascular events and electrocardiographic left ventricular hypertrophy:The Moli-sani study [J]. J Hypertens,2016,34 (Suppl 2):e82.
[27] MURPHY N F,MACINTYRE K,STEWART S,et al. Longterm cardiovascular consequences of obesity:20-year follow-up of more than 15 000 middle-aged men and women (the Renfrew-Paisley study) [J]. Eur Heart J,2006,27(1):96-106.
[28] PETERSON L R,HERRERO P,SCHECHTMAN K B,et al. Effect of obesity and insulin resistance on myocardial substrate metabolism and efficiency in young women [J]. Circulat,2004,109(18):2191-2196.
[29] PLOURDE B,SARRAZIN J F,NAULT I,et al. Sudden cardiac death and obesity [J]. Expert Rev Cardiovasc Ther,2014,12(9):1099-1110.
[30] RAJALAKSHMI R,VAGEESH V Y,NATARAJ S M. Myocardial oxygen consumption at rest and during submaximal exercise:effects of increased adiposity [J]. Niger J Physiol Sci,2013,28(1):35-39.
[31] RIDER O J,PETERSEN S E,FRANCIS J M,et al. Ventricular hypertrophy and cavity dilatation in relation to body mass index in women with uncomplicated obesity [J]. Heart,2011,97(3):203-208.
[32] SCHUSTER I,KARPOFF L,PEREZ-MARTIN A,et al. Cardiac function during exercise in obese prepubertal boys:effect of degree of obesity [J]. Obesity,2009,17(10):1878-1883.
[33] SHAH R V,ABBASI S A,NEILAN T G,et al. Myocardial tissue remodeling in adolescent obesity [J]. J Am Heart Assoc,2013,2(4):e000279.
[34] VELLA C A,PAUL D R,BADER J. Cardiac response to exercise in normal-weight and obese,Hispanic men and women:implications for exercise prescription [J]. Acta Physiol,2012,205(1):113-123.
[35] WOODIWISS A J,LIBHABER C D,MAJANE O H I,et al. Obesity promotes left ventricular concentric rather than eccentric geometric remodeling and hypertrophy independent of blood pressure [J]. Am J Hypertens,2008,21(10):1144-1151.
Effect of Obesity on Cardiac Function and Exercise Changes in Adults
CHEN Yi-shan,ZHANG Yi-min,KONG Zhen-xing,YU Jing-jing,SUN Ting-ting,ZHANG Han-yue
Objective: The purpose of the study was to evaluate the impact of adults obesity on cardiac structure and function at rest and during exercise. Methods: 130 adults (29 male, 101 females) aged 40~60 years were recruited in Beijing, dividing into 3 groups according to BMI, including 1 lean group (n=57), 1 overweight group (n=56) and 1 obesity group (n=17). After resting echocardiography, all subjects performed a horizontal exercise test that the initial load was 25W, increasing 25W every two minutes. Conventional echocardiography was acquired at rest and each workload. Results: 1) Compared with the lean group, the obesity group showed increasing interventricular septal thickness (IVSd), left ventricular end-diastolic dimension (LVIDd), left ventricular posterior wall thickness (LVPWd), left ventricular end-diastolic volume (EDV), left ventricular mass (LVM) , left ventricular mass index (LVMI) , heart rate (HR), stroke volume (SV) and cardiac output (CO) (P<0.01). 2) Left ventricular hypertrophy in obese adults is much higher than the normal weight or overweight. 3) Significant main effects for group indicated obese participants had higher CO and SV during incremental exercise to exhaustion compared with their normal-weight peers (P<0.01), despite EF, HR had no significant differences among the groups (P>0.05). Conclusions: Our findings suggest that alterations of cardiac structure and function in overweight adults were similar to those in obese, including increased left ventricular mass and cardiac dysfunction. Although CO and SV were higher in obese adults, lower cardiac reserve function and impaired heart rate recovery when compared to matched, normal-weight adults. The abnormal enhancement of cardiac function in obese people at rest and during exercise needs to be further research.
echocardiography;cardiac;obesity;exercise
G804.2
A
1000-677X(2017)05-0061-07
10. 16469/j. css. 201705006
2017-01-20;
2017-04-19
“十二五”国家科技支撑计划课题资助项目(2012BAK21B01)
陈贻珊,女,博士,研究方向为全民健身的关键技术 、体质测量与评价,Tel:(010)62972161,E-mail:chenyishanbsu@126.com;张一民,男,教授,博士,博士研究生导师,Tel:(010)62972161。
北京体育大学 运动与体质健康教育部重点实验室,北京 100084
Beijing Sport University, Beijing 100084 China.
