呋喃肟酸合成液的萃取分离工艺研究
2017-05-21宋同和
肖 华,宋同和
(1.山东金城医药化工有限公司,山东 淄博 255100;2.山东中医药大学,山东 济南 250355)
呋喃肟酸(2-Methoxyimino-2-fruylacetic Acid)是合成头孢抗菌素头孢呋辛的重要中间体。目前主要的合成方法是利用乙酰呋喃作为起始原料,经亚硝酸钠酸性氧化、甲氧盐酸盐肟化合成及有机溶剂萃取、蒸馏而得。由于制备过程全部是在在水相中进行的,因而从水相中用有机溶剂萃取显得尤其重要。
1 呋喃肟酸合成液的萃取原理与分析
1.1 呋喃肟酸萃取概述
呋喃肟酸水溶液,经脱色过滤后,加入工业盐,再用无机酸调节pH值到规定值以下,然后用卤代烃类有机溶剂进行萃取分离操作,将水溶液中的呋喃酮酸萃取到有机相中。具体的操作步骤如图1所示。

图1 呋喃肟酸萃取过程示意图
将定量的二氯甲烷加入到事先调好pH值的合成液中,搅拌充分混合,溶质(呋喃肟酸)通过相界面由水相转向有机相中扩散。萃取过程中,萃取剂与合成液中的有关组分不发生化学反应而仅为物理传递过程,为物理萃取过程中两相间的传质过程。在该萃取过程中,萃取剂在水相中由较小的溶解度(约为0.2%),合成液中除了待分离组分外还含有少量其它副产物杂质等;而水也少量的存在与二氯甲烷中(约为2.0%)。这样两相中将同时出现多个组分,致使过程的数学描述和计算较为复杂。由于本工艺中合成液内待分离组分的含量很低(≤5%),且为难挥发组分(水),若采用其他方法需将大量原溶剂(水)汽化,能耗很大,并且合成液中所需分离出的物质呋喃肟酸对高温敏感,所以采用萃取分离是合适的选择方案。
呋喃肟酸是有机酸,pH值对其分配系数有很大影响。实验发现在较低pH值下有利于呋喃酮酸在有机相中的分配。当pH值较大时,几乎全部分配于水中。所以,选择适当的pH值,不仅有利于提高呋喃酮酸的收率,还可以根据共存杂质和分配系数,提高呋喃酮酸萃取的选择性。
在萃取过程中常加入溶于水相本身不被萃取也不与金属离子络合的无机盐作盐析剂。盐析剂由于水合作用吸引了部分自由水分子,使水溶液中的自由水分子减少,因而被萃物在水中的浓度相应地增加,有利于萃取;在萃取过程中,由于种种原因有机相和水相之间往往会形成乳化层或第三相,它的生成不仅会降低产品呋喃肟酸的萃取率和分相速度,而且会损失有机相,污染产品,降低产品质量,增加后续精制工作的难度。
对于加盐萃取而言,三元体系溶解度曲线和关联方程能确定有机溶剂-水体系的最小加盐量,对萃取过程中盐的用量有一定的指导作用。另外根据系线MN还可以确定盐的最大加入量。
有机化合物在盐水溶液中溶解度的盐效应可用Setschenow 方程来加以描述:

(1)
将上述公式加以扩展用来描述部分互溶液-液相平衡盐效应,扩展的Setschenow 方程如下:
(2)

(3)
对于一个常规的萃取过程,当搅拌停止后两液相因密度差而分为两层:下层以萃取剂为主,含有较多的呋喃肟酸,称为萃取相;上层以水为主,且含有未被萃取完的溶质呋喃肟酸,称为萃余相。由此可见,一次的萃取操作并未能将反应液中的溶质呋喃肟酸完全分离提取出来,为提高产品收率,需经多次萃取操作才能将合成液中的溶质尽可能的分理出来。故此,小试采用4次萃取来实现这一目标。
由于工业生产中合成液的体积较大,需要消耗大量的萃取剂,为节省其用量,提高产品收率,生产中采用向合成液中加入部分工业盐的方式,进行盐析萃取进而达到上述目的。
1.2 呋喃肟酸萃取分离物系的类型
利用二氯甲烷作萃取剂从合成液中萃取呋喃肟酸属于溶质A可完全溶于水及萃取剂,水与溶剂萃取剂部分互溶的情况,为第Ⅰ类物系。此类物系的溶解度曲线如图2所示。

图2 溶解度曲线
图中的溶解度曲线将三角形相图分为两个区域:曲线以内的区域为两相区,以外的区域为均相区。位于两相区内的混合物分成两个互相平衡的液相,称为共轭相,萃取操作就在两相区内进行。
1.3 分配系数和分配曲线
1.3.1 分配系数
一定温度下,某组分在互相平衡的萃取相(E相)和萃余相(R相)中的组成之比称为该组分的分配系数,以k表示,即:
溶质A kA=yA/xA
(4)
原溶剂B kB=yB/xB
(5)
式中,yA,yB—萃取剂E中组分A、B的质量分数,
xA,xB—萃余相R中组分A、B的质量分数。
分配系数kA表达了溶质在两个平衡液相中的分配关系。显然,kA值越大,萃取分离效果越好。同一物系,其kA值随温度和组成而变。对于呋喃肟酸水溶液物系,kA值随温度的升高或溶质组成的增大而降低。一定温度下,本工艺中溶质组成变化不大,因而kA值可视为常数。
1.3.2 分配曲线
由相律可知,温度、压力一定时,三组分体系两液相成平衡时,自由度为1。故只要记住任一平衡液相中的任一组分的组成,则其它组分的组成及其共轭相的组成就为定值。换言之,温度、压力一定时,溶质呋喃肟酸在两平衡液相间的平衡关系可表示为
yA=f(xA)
(6)
式中:yA—萃取相E(二氯甲烷)中组分A(呋喃肟酸)的质量分数;
xA—萃余相R(水)中组分A(呋喃肟酸)的质量分数。
此即分配曲线的数学表达式。
分配曲线表达了溶质A(呋喃肟酸)在互成平衡的E(二氯甲烷)相和R(水)相中的分配关系。若已知某液相的组成,则可由分配曲线求出其共轭相的组成。若在分层区组成范围内y均大于x,即分配系数kA>1,则分配曲线位于y=x线上侧,曲线形状如图3所示。

图3 一对部分互溶时的分配曲线
1.4 温度对相平衡关系的影响

图4 温度对互溶度的影响
通常物系的温度升高,溶质在溶剂中的溶解度增大,反之减小。因此,温度明显的影响着溶解度曲线的形状、联结线的斜率和两相区的面积,从而也影响到分配曲线的形状。图4示出了温度对第Ⅰ类物系溶解度曲线和联结线的影响,显而易见,温度升高,呋喃肟酸产品的分层区面积减小。
1.5 萃取剂的选择性和选择性系数
萃取剂的选择性是指萃取剂S(二氯甲烷)对原料液中两个组分溶解能力的差异。溶剂的选择性可用选择性系数β表示,其定义是为:

(7)
式中:β—选择性系数,无因次;
yA,yB—萃取相中A、B组分的质量分数;
xA,xB—萃余相R中组分A、B的质量分数;
kA、kB—组分A、B的分配系数。
若β>1,说明组分A(呋喃肟酸 )在萃取相中的相对含量比萃余相中的高,即组分A、B得到了一定程度的分离,如图5所示。显然,萃取剂的选择性越高,则完成一定的分离任务所需萃取剂的用量也就越少,相应的用于回收溶剂操作的能耗也就越低。因而选择合适的萃取剂是保证萃取操作能够正常进行且经济合理的关键。
由式(7)可知,当原溶剂B(水)与萃取剂S(二氯甲烷)完全不互溶时,yB=0,则选择性系数趋于无穷大,显然这是选择性的最理想状态。但实际操作当中,原溶剂与萃取剂之间多少会有部分的互溶度,图5示出了在一定温度下,同一种二元原料液与不同萃取剂S1、S2所构成的平衡关系图。由图可见,萃取剂S1与组分B的互溶度较小。研究表明:互溶度越小,可能得到的溶质的组成y′max便越高,也就越有利于萃取分离。由图5可以看出,选择与组分B具有较小互溶度的萃取剂S1更有利于溶质A的萃取分离。

图5 互溶度对萃取操作的影响
2 呋喃肟酸萃取分离过程中工业盐用量的影响
如前所述,萃取操作的关键是选择合适的萃取剂。当萃取剂确定以后,如何使用最少量的萃取剂达到预期的萃取效果便成为问题的关键。从原理上分析,加入部分的工业盐只是起到部分的辅助作用,工业盐的加入量并非决定因素。因而适当减少工业盐的用量应该是可能的。通过下面几批实验结果的研究可以发现其中的规律。从理论上分析,加入工业盐以后,盐全部溶于水溶液中,使水的溶解度接近饱和,从而更加有利于二氯有机溶剂的萃取,节省二氯溶剂的用量。但萃取剂的选则是第一位的因素,在用二氯萃取合成液中呋喃肟酸的过程中,二氯甲烷的选择性系数较大,盐的用量在一定程度上降低了对该过程的影响,从近期为浓缩的甲氧铵盐吸收液2700 kg不经浓缩直接用于合成工序的应用情况,所的粗品的收率,与原来1800 kg左右浓缩液的情况未见变化。尽管合成釜体系内增加了900 kg的水溶剂(这还不包括因甲氧铵盐水量而增加的中和用液碱带入的水量)。此步过程中工业盐的用量只是增加了40 kg(由原来的660 kg增加到700 kg)。依此反推,若体系减少900 kg以上的水分后,再继续减少工业盐的重量应当也是可行的。据此假设进行如下实验研究,所的实验数据如表1所示。
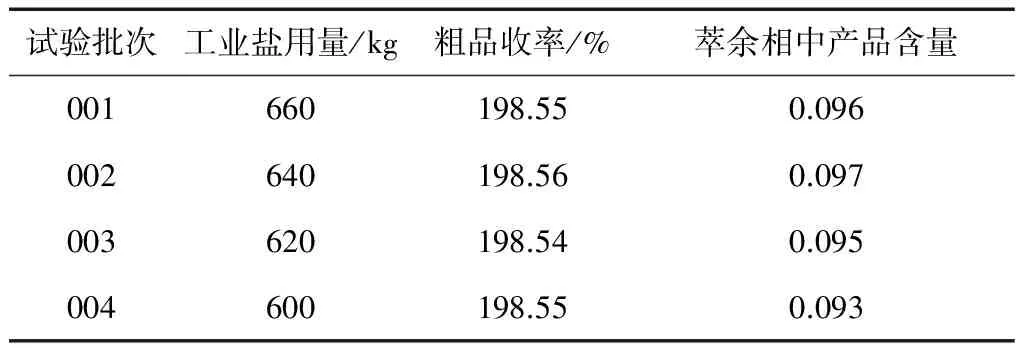
表1 工业盐用量对产品收率的影响
3 结论
(1)萃取操作影响因素较多,一次萃取操作并未能将反应液中的溶质呋喃肟酸完全分离提取出来,本试验确定采用4次萃取可将产品萃取完全;
(2)工业生产中合成液的体积较大,需要消耗大量的萃取剂,为节省其用量,生产中采用向合成液中加入部分工业盐的方式,进行盐析萃取进而达到上述目的;
(3)呋喃肟酸是有机酸,pH值对其分配系数有很大影响,在较低pH值下有利于呋喃酮酸在有机相中的分配;
(4)在本萃取体系中,加入适量的工业盐,可以防止过多杂质进入有机相中,提高分离的纯度,适当减少工业盐用量,对产品质量和收率基本没有影响。
参考文献
[1]廖晓祥,李 晖,李延芳,等.硫酸钠盐析对萃取微量铜的增敏及其应用[J].化学研究与应用,2011,23(2):244-247.
[2]李亚军.拓扑指数在环境与制药领域模型化应用研究[D].北京:北京化工大学,2005.
[3]Masterton W L,Lee T P.Sating coefficients from scaled particle theory[J].Journal of Physical Chemistry,1970,74:1776-1782.
[4]罗 旭.化学统计学[M].1版.北京:科学出版社,2001.
[5]王一丁,刘向宏,魏鹏丽.呋喃铵盐生产工艺研究[J].辽宁化工,2010,39(4):362-366.
[6]马正飞,谷和平,吕效平.化工英语[M].南京:东南大学出版社,1999.
[7]王志魁.化工原理[M].3版.天津:天津大学出版社,2004.
